Akt1和Akt2基因轉染對人胃黏膜上皮細胞GES-1生長的影響
謝甲貝,張慶瑜,康春生,韓靜,王濤,張潔
Akt1和Akt2基因轉染對人胃黏膜上皮細胞GES-1生長的影響
謝甲貝,張慶瑜,康春生,韓靜,王濤,張潔
【摘要】
目的觀察 Akt1 和 Akt2 基因轉染人胃黏膜上皮 GES-1細胞后對其生長的影響。
方法采用脂質體法將分別含 Akt1 和 Akt2 基因全長cDNA 序列的 p-LXSN-Akt1(Akt1 組)和 p-LXSN-Akt2(Akt2 組)質粒轉染人胃黏膜上皮 GES-1 細胞,以轉染p-LXSN 空質粒的細胞作為空載組,正常未轉染細胞作為對照組,并經抗生素 G418 篩選抗性克隆。提取各組細胞的總蛋白,蛋白質印跡法檢測轉染后細胞 Akt1、Akt2 蛋白及細胞周期蛋白 D1(Cyclin D1)的表達水平;采用 MTT 法檢測轉染后細胞的增殖活性;應用流式細胞儀檢測 Akt1 和Akt2 基因轉染對細胞周期的影響。
結果Akt1 和 Akt2 組均獲得了穩定表達 Akt1 和 Akt2基因的 GES-1 細胞模型。Akt1 組:① Akt1 蛋白相對表達量(0.96 ± 0.05)分別是空載組(0.47 ± 0.02)和對照組(0.64 ± 0.03)的 2.03 ± 0.22 和 1.48 ± 0.19 倍(均 P <0.01),Cyclin D1 蛋白相對表達量(0.74 ± 0.01)分別是空載組(0.29 ± 0.01)和對照組(0.22 ± 0.01)的 2.57 ± 0.05 和3.44 ± 0.04 倍(均 P < 0.01);②吸光度(A490)值于第 1、2 天分別與空載組和對照組比較差異無統計學意義,第 3 ~6 天差異均有統計學意義(均 P < 0.01);③ S 期細胞數與空載組和對照組比較分別增多約 20.00% 和 21.10%,G2期細胞數減少約 20.80% 和 15.48%(均 P < 0.01)。Akt2組:① Akt2 蛋白相對表達量(0.95 ± 0.01)分別是空載組(0.62 ± 0.02)和對照組(0.56 ± 0.01)的 1.53 ± 0.04 和1.69 ± 0.01 倍(均 P < 0.01),Cyclin D1 蛋白相對表達量(0.31 ± 0.02)與空載組(0.29 ± 0.01)和對照組(0.22 ± 0.01)比較差異均無統計學意義;② A490值于第 1 ~ 6 天分別與空載組和對照組比較差別均無統計學意義;③ S 期細胞數與空載組和對照組比較差異均無統計學意義。
結論Akt1 基因可使 GES-1 細胞 S 期細胞數增多,并提高細胞的增殖能力;而 Akt2 基因對 GES-1 細胞的細胞周期和增殖能力的影響不明顯。
【關鍵詞】基因轉移技術; 細胞周期蛋白 D1; 胃黏膜
www.cmbp.net.cn 中國醫藥生物技術, 2010, 5(6):423-428
胃癌的發生是一個多步驟、多因素的發展過程。Akt 信號通路與腫瘤發生發展密切相關,在促進其生長增殖和侵襲轉移方面發揮著重要作用[1],并且 Akt 信號通路與胃癌的發生發展亦密切相關[2]。Akt 亞型 Akt1、Akt2 對細胞增殖周期的作用不盡相同,在不同細胞系中對增殖和轉移的影響甚至相反[3-4]。為此我們將外源性 Akt1、Akt2 基因導入人胃黏膜上皮 GES-1 細胞中,分析觀察兩者對 GES-1 細胞的增殖和細胞周期的影響,旨在探索 Akt1、Akt2 基因是否通過延長細胞生存時間為胃黏膜上皮細胞惡性轉化提供可能性。
1 材料與方法
1.1 材料
1.1.1 細胞株與質粒 人胃黏膜上皮 GES-1 細胞購自北京百和營科技發展有限責任公司;p-LXSN質粒以及分別含 Akt1 和 Akt2 基因全長 cDNA序列的 p-LXSN-Akt1、p-LXSN-Akt2 質粒由美國南佛羅里達大學 Dr. Jin Q. Cheng 惠贈。
1.1.2 主要試劑與儀器 質粒抽提及純化試劑盒、總蛋白提取試劑盒購自天根生化科技(北京)有限公司;脂質體 LipofectamineTM2000、DMEM培養液、小牛血清、MTT、抗生素 G418 購自北京索萊寶科技有限公司;兔抗人 Akt1、Akt2、細胞周期蛋白 D1(Cyclin D1)單抗購自美國 Santa Cruz公司;抗 GAPDH 單克隆抗體、HRP 標記的羊抗兔 IgG 抗體購自北京中杉金橋生物技術有限公司;ECL 化學發光試劑盒和化學發光檢測系統購自美國 Pierce 公司(Super Signal West Pico 34080);FACS Calibur 流式細胞儀為美國 BD 公司產品;熒光相差倒置顯微鏡 IX-71 為日本 Olympus 公司產品。
1.2 方法
1.2.1 基因轉染和克隆篩選 人胃黏膜上皮GES-1 細胞置于含 10% 小牛血清的 DMEM 完全培養液中,于 37 ℃、5% CO2、濕潤條件下進行體外培養。當細胞生長到 60% ~ 70% 融合時,參照脂質體 LipofectamineTM2000 說明書分別轉染p-LXSN-Akt1(Akt1 組)、p-LXSN-Akt2 質粒(Akt2組),48 h 后換用含濃度為 400 μg/ml G418 的完全培養液篩選,3 周后選出抗性克隆株繼續擴大培養。以正常未轉染的 GES-1 細胞作為對照組,以轉染 p-LXSN 空質粒的 GES-1 細胞作為空載組。
1.2.2 轉染后細胞蛋白表達檢測 采用蛋白質印跡法。待各組細胞培養至約 5 × 107時,按總蛋白提取試劑盒說明書分別提取各組待測細胞的總蛋白,并檢測樣品蛋白濃度。將各組細胞總蛋白按比例與 5 倍上樣緩沖液混合,置 100 ℃ 沸水中煮15 min。取等量蛋白樣品溶液及蛋白 Marker 上樣進行 SDS-PAGE 凝膠電泳,然后將凝膠電轉移至PVDF 膜上,置于膜封閉液中封閉過夜。依次加入一抗為兔抗人 Akt1、Akt2、Cyclin D1 單抗(1∶1000),二抗為 HRP 標記的羊抗兔 IgG 抗體(1∶1000)。用增強化學發光法(ECL)顯色,化學發光檢測系統進行檢測。洗膜后以抗 GAPDH單克隆抗體二次雜交檢測作為內對照。實驗重復3 次。
1.2.3 轉染后細胞增殖活性檢測 采用 MTT法。取處于對數生長期的各組細胞,常規 0.25% 胰酶消化,以 200 μl/孔接種于 96 孔培養板中繼續培養,以加入 200 μl DMEM 完全培養液作為空白對照,每組各設 8 孔。每孔加入 20 μl MTT 溶液(5 mg/ml),37 ℃ 繼續孵育 4 h,小心吸棄孔內培養上清液。每孔加入 150 μl DMSO,振蕩 10 min,使結晶物充分溶解。在酶聯免疫檢測儀上測定各孔波長 490 nm 處吸光度(A490)值,記錄結果并繪制細胞生長曲線。連續檢測 6 d,實驗每天重復3 次。
1.2.4 轉染后細胞周期檢測 取處于對數生長時期的各組細胞,常規 0.25% 胰酶消化,離心收集細胞,冷 PBS 洗滌 2 次。加入預冷(4 ℃)的 75%乙醇溶液固定,RNA 酶 A(RNase A)消化,碘化丙啶染色 30 min 后,應用 FACS Calibur 流式細胞儀(激發波長 488 nm)檢測各組細胞的細胞周期。實驗重復 3 次。
1.3 統計學處理
應用 SPSS16.0 統計學軟件進行數據處理,檢測數據以±s表示,組間數據的比較采用單因素方差分析和 χ2檢驗,以 P < 0.05 為差異有統計學意義。
2 結果
2.1 轉染 Akt1、Akt2 基因的 GES-1 細胞篩選
p-LXSN-Akt1、p-LXSN-Akt2 質粒分別轉染GES-1 細胞后,在抗生素 G418(400 μg/ml)作用下大部分細胞死亡,培養約 10 d 后可見剩余細胞成島狀生長;經過 3 周抗生素 G418 抗性篩選,獲得生長良好的抗性克隆株,而正常未轉染 GES-1細胞在約 10 d 后完全死亡。
2.2 轉染 Akt1、Akt2 基因的 GES-1 細胞蛋白表達
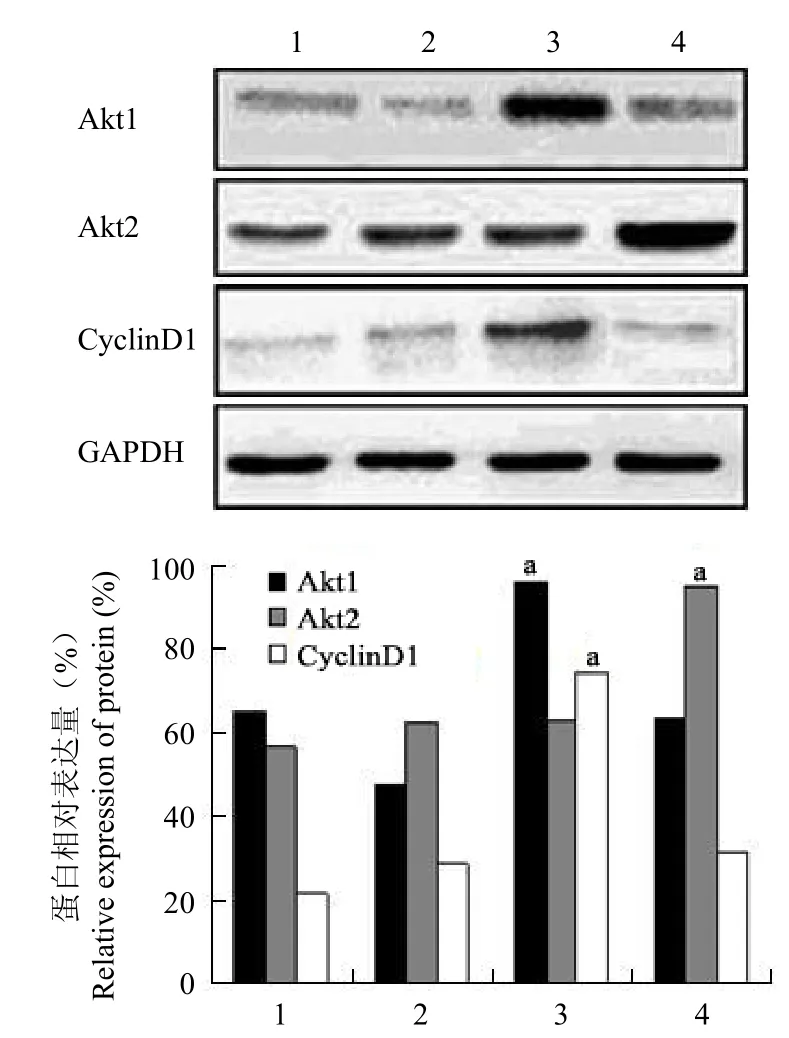
圖 1 轉染 Akt1 和 Akt2 基因的 GES-1 細胞蛋白表達的蛋白質印跡檢測(a分別與對照組和空載組比較,均 P <0.01)Figure 1 The expression of protein in the GES-1 cells transfected by Akt1 and Akt2 genes by Western blot.aCompare with the control group and blank vector group respectively, all P < 0.01.
蛋白質印跡分析顯示,Akt1 組 Akt1 蛋白的表達水平高于空載組和對照組,灰度值(Akt1/GAPDH)分析表明其 Akt1 蛋白相對表達量(0.96 ± 0.05)分別是空載組(0.47 ± 0.02)和對照組(0.64 ± 0.03)的 2.03 ± 0.22 和 1.48 ± 0.19倍,差異均有統計學意義(均 P < 0.01);同時 Akt1組 Cyclin D1 蛋白相對表達量(0.74 ± 0.01)分別是空載組(0.29± 0.01)和對照組(0.22 ± 0.01)的2.57 ± 0.05 和 3.44 ± 0.04 倍,差異也均有統計學意義(均 P < 0.01)。Akt2 組 Akt2 蛋白的表達水平高于空載組和對照組,灰度值(Akt2/GAPDH)分析表明其 Akt2 蛋白相對表達量(0.95 ± 0.01)分別是空載組(0.62 ± 0.02)和對照組(0.56 ± 0.01)的 1.53 ± 0.04 和 1.69 ± 0.01 倍,差異均有統計學意義(均 P < 0.01);而 Akt2 組 Cyclin D1 蛋白相對表達量(0.31 ± 0.02)與空載組(0.29 ± 0.01)和對照組(0.22 ± 0.01)比較無明顯升高,差異均無統計學意義(均 P > 0.05)(圖 1)。表明 p-LXSNAkt1 和 p-LXSN-Akt2 質粒可以在 GES-1 內穩定表達。
表 1 MTT 法測定轉染 Akt1 和 Akt2 基因的 GES-1 細胞的 A490值(±s)Table 1 The A490values of the GES-1 cells transfected by Akt1 and Akt2 genes by MTT method (±s)
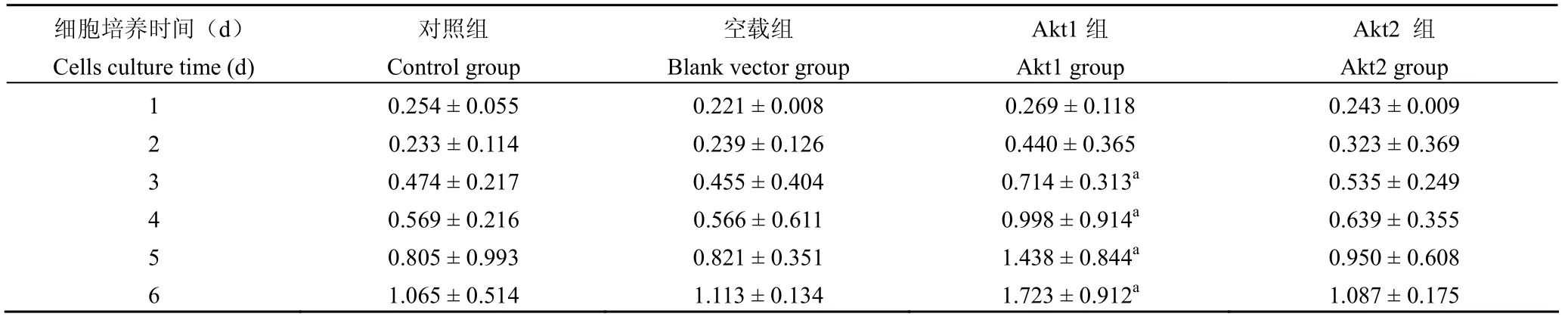
表 1 MTT 法測定轉染 Akt1 和 Akt2 基因的 GES-1 細胞的 A490值(±s)Table 1 The A490values of the GES-1 cells transfected by Akt1 and Akt2 genes by MTT method (±s)
注:a分別與對照組和空載組比較,均 P < 0.01Note:aCompared with the control group and blank vector group respectively, all P < 0.01
細胞培養時間(d)Cells culture time (d)對照組Control group空載組Blank vector group Akt1組Akt1 group Akt2 組Akt2 group 1 0.254 ± 0.055 0.221 ± 0.008 0.269 ± 0.118 0.243 ± 0.009 2 0.233 ± 0.114 0.239 ± 0.126 0.440 ± 0.365 0.323 ± 0.369 3 0.474 ± 0.217 0.455 ± 0.404 0.714 ± 0.313a 0.535 ± 0.249 4 0.569 ± 0.216 0.566 ± 0.611 0.998 ± 0.914a 0.639 ± 0.355 5 0.805 ± 0.993 0.821 ± 0.351 1.438 ± 0.844a 0.950 ± 0.608 6 1.065 ± 0.514 1.113 ± 0.134 1.723 ± 0.912a 1.087 ± 0.175
2.3 Akt1、Akt2 基因對 GES-1 細胞增殖能力的影響
MTT 法檢測結果表明,Akt1 組吸光度(A490)值于第 1、2 天分別與空載組和對照組比較差異無統計學意義(均 P > 0.05),第 3 ~ 6 天差異均有統計學意義(均 P < 0.01)。而 Akt2 組吸光度(A490)值于第 1 ~ 6 天分別與空載組和對照組比較差異均無統計學意義(均 P > 0.05)(表 1、圖 2)。表明轉染 Akt1 基因后 GES-1 細胞增殖能力增強。
2.4 Akt1、Akt2 基因對 GES-1 細胞細胞周期的影響
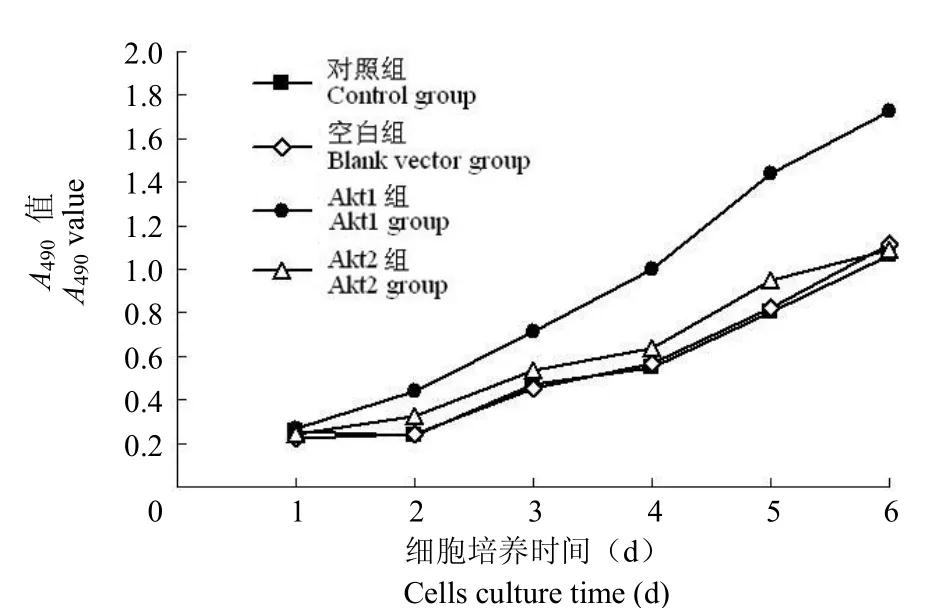
圖 2 轉染 Akt1 和 Akt2 基因的 GES-1 細胞生長曲線Figure 2 The cells growth curves of the GES-1 cells transfected by Akt1 and Akt2 genes
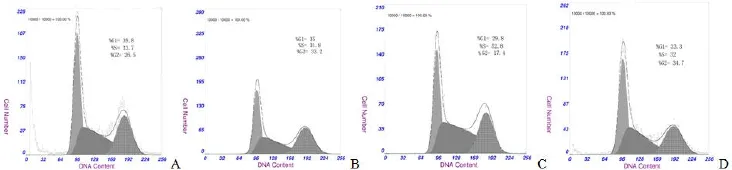
圖 3 轉染 Akt1 和 Akt2 基因的 GES-1 細胞細胞周期的流式細胞術分析(A:對照組;B:空載組;C:Akt1 組;D:Akt2 組)Figure 3 The cells cycle distribution of the GES-1 cells transfected by Akt1 and Akt2 genes by flow cytometry. A: Control group; B: Blank vector group; C: Akt1 group; D: Akt2 group.
相對于空載組和對照組,Akt1 組 S 期細胞數分別增多約 20.00% 和 21.10%,G2 期細胞數相應減少約 20.80% 和 15.48%,差異均有統計學意義(均 P < 0.01);而與空載組和對照組比較,Akt2 組S 期細胞數僅增多 1% ~ 2%,差異均無統計學意義(P > 0.05)(圖 3、表 2)。
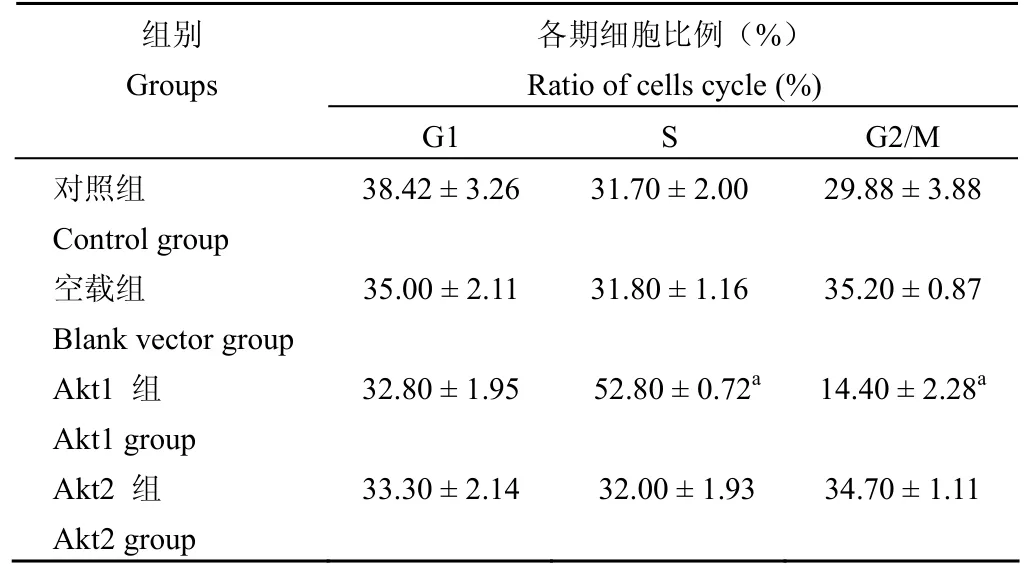
表 2 Akt1、Akt2 基因轉染對 GES-1 細胞細胞周期的影響Table 2 The effect of Akt1 and Akt2 genes transfection on the cells cycle of the GES-1 cells
3 討論
Akt/PKB 信號通路是細胞內信號傳導的重要環節,參與細胞代謝、生存、凋亡、分化和增殖等過程。哺乳動物的 Akt/PKB 由 3 個亞型組成,分別是 Akt1/PKBα、Akt2/PKBβ 和 Akt3/PKBγ,它們分別受 3 個完全不同的基因編碼調節,主要表現為位于激酶區域的第 308 號位點蘇氨酸(Thr308)和位于 C 末端的第 473 號位點絲氨酸(Ser473)的磷酸化,只有這 2 個位點的氨基酸都被激活,才能充分發揮其激酶功能。3 個亞型都具有相似的蛋白質結構,對底物表現相似的特異性。動物實驗證明,敲低 Akt1 基因的小鼠生長發育遲緩,細胞凋亡增加,表明 Akt1 基因在細胞存活過程中具有關鍵作用;敲低 Akt2 基因的小鼠表現為糖代謝障礙;而敲低 Akt3 基因的小鼠有腦損傷表現,實際上 Akt 各亞型特別是 Akt1 和 Akt2,有著極其復雜的作用,并且相互重疊[5-7]。在不同的組織細胞,Akt 各亞型的表達水平不一,Akt1 基因擴增見于胃癌,其高表達見于乳腺癌;Akt2 基因擴增見于卵巢癌和胰腺癌,其高表達見于肝癌和結腸癌[8]。Koseoglu 等[9]發現 Akt 這 3 種亞型依賴性細胞的存活具有細胞系特異性,在人乳腺癌ZR-75 細胞中,Akt1 基因對細胞增殖和存活起主導作用;而對于人卵巢腺癌 IGROV1 細胞,Akt2基因則對細胞增殖起主導作用,但其存活非依賴單一 Akt 亞型。研究顯示 Akt1 基因及磷酸化 Akt1(p-Akt1)基因在胃腺癌組織中的陽性表達率高于癌旁組織和正常胃黏膜組織,并且其表達水平也同腫瘤分級和 TNM 分期相關;利用磷酸肌醇 3-激酶(phosphatidylinositide 3-kinase,PI-3K)抑制劑LY-294002 抑制 p-Akt1 基因,尤其對于 Akt1 激活的細胞,可使胃癌細胞增殖受阻,并誘導 G1 期停滯,表明 Akt1 基因作為一個激酶與胃癌的進展和細胞增殖密切相關[10-11]。
Akt1、Akt2 基因在細胞周期進程中的作用不盡相同。Yun 等[12]研究發現,Akt1 基因在細胞周期 G1/S 期過度和增殖中具有重要作用。細胞缺少Akt1 基因則表現為增殖伴 G1/S 期過度減弱,缺少 Akt2 基因的細胞該進程不受影響;而 Akt1 基因對增殖和 G1/S 期過度的作用完全可以通過Akt2 基因交換 PH 區域來廢止,這表明 PH 區域是 Akt1 基因完全激活并促使 G1 到 S 期過度的關鍵結構域。Héron-Milhavet 等[3]發現敲低非轉化哺乳動物細胞的 Akt1 基因而不是 Akt2 基因,可導致 Cyclin A 水平下降,細胞進入 S 期減弱;而Akt2 基因的過表達則通過增加核內 p21 蛋白使細胞周期阻滯在 M-G1 期。這同樣證明了 Akt1基因對細胞增殖的關鍵作用,而 Akt2 基因則促進細胞周期阻滯。本實驗與以上研究結果基本一致,其機制可能是 Akt 基因通過其下游雷帕霉素靶點(mTOR)將有絲分裂信號傳遞給 p70S6K1,使細胞周期主要蛋白如細胞周期蛋白的翻譯上調,以及抑制 p21CIP1、p27KIP1的表達,促進 G1 期進展,使細胞周期加速。
本實驗以脂質體介導的基因轉染法將含有Akt1-cDNA、Akt2-cDNA 的真核表達載體 p-LXSN導入人胃黏膜上皮 GES-1 細胞,成功地建立了穩定表達 Akt1 及 Akt2 蛋白的 GES-1-Akt1 和GES-1-Akt2。進一步的 MTT 生長曲線測定和流式細胞周期分析實驗表明,轉染 Akt1 基因的 GES-1細胞,增殖能力提高,細胞周期 S 期明顯增多,提示 Akt1 基因可能通過延長細胞生存時間為人胃黏膜上皮細胞的惡性轉化提供可能,而 Akt2 基因對 GES-1 細胞的影響不明顯。下一步我們需要探討的是 Akt 通路下游,如 mTOR 等一系列與細胞增殖相關靶基因的變化,并從細胞形態及遷移能力方面進行對比分析,期待能為抑制 GES-1 細胞惡性轉化提供新的途徑或方法。
參考文獻
[1] Samuels Y, Ericson K. Oncogenic PI3K and its role in cancer. Curr Opin Oncol, 2006, 18(1):77-82.
[2] Han Z, Wu K, Shen H, et al. Akt1/protein kinase B alpha is invoved in gastric cancer progression and cell proliferation. Dig Dis Sci, 2008, 53(7):1801-1810.
[3] Héron-Milhavet L, Franckhauser C, Rana V, et al. Only Akt1 is required for proliferation, while Akt2 promotes cell cycle exit through p21 binding. Mol Cell Biol, 2006, 26(22):8267-8280.
[4] Toker A, Yoeli-Lerner M. Akt signaling and cancer: surviving but not moving on. Cancer Res, 2006, 66(8):3963-3966.
[5] Chen WS, Xu PZ, Gottlob K, et al. Growth retardation and increased apoptosis in mice with homozygous disruption of the Akt1 gene. Genes Dev, 2001, 15(17):2203-2208.
[6] Garofalo RS, Orena SJ, Rafidi K, et al. Severe diabetes, age-dependent loss of adipose tissue, and mild growth deficiency in mice lacking Akt2/PKBbeta. J Clin Invest, 2003, 112(2):197-208.
[7] Tschopp O, Yang ZZ, Brodbeck D, et al. Essential role of protein kinase B gamma (PKB gamma/Akt3) in postnatal brain development but not in glucose homeostasis. Development, 2005, 132(13):2943-2954.
[8] Gonzalez E, McGraw TE. The Akt kinases: isoform specificity in metabolism and cancer. Cell Cycle, 2009, 8(16):2502-2508.
[9] Koseoglu S, Lu Z, Kumar C, et al. AKT1, AKT2 and AKT3-dependent cell survival is cell line-specific and knockdown of all three isoforms selectively induces apoptosis in 20 human tumor cell lines. Cancer Biol Ther, 2007, 6(5):755-762.
[10] Cui XW, Zhang QY, Kang CS, et al. Protein expression of Akt1, MMP2 and PTEN in gastric adenocarcinoma and the correlations among these indices. Chin J Clin Oncol, 2009, 36(5):258-261.(in Chinese)崔小偉, 張慶瑜, 康春生, 等. 利用組織芯片技術研究 Akt1、MMP2和 PTEN在胃腺癌中的表達及其相關性. 中國腫瘤臨床, 2009, 36(5):258-261.
[11] Han Z, Wu K, Shen H, et al. Akt1/protein kinase B alpha is involved in gastric cancer progression and cell proliferation. Dig Dis Sci, 2008, 53(7):1801-1810.
[12] Yun SJ, Tucker DF, Kim EK, et al. Differential regulation of Akt/protein kinase B isoforms during cell cycle progression. FEBS Lett, 2009, 583(4):685-690.
ObjectiveTo observe the effects of Akt1 and Akt2 genes transfection on the growth of human gastric epithelial GES-1 cells.
MethodsThe plasmids of p-LXSN-Akt1 which contained the whole Akt1 gene sequence (Akt1 group) and p-LXSN-Akt2 which contained the whole Akt2 gene sequence (Akt2 group) were used to transfect human gastric epithelial GES-1 cells with lipofectamine, the GES-1 cells which were transfected by the empty vector p-LXSN were used as the black vector group, and the no transfected ones were used as the control group. Then the positive cell clones were selected with antibiotics G418. The protein expressions of Akt1, Akt2 and Cyclin D1 in the GES-1 cells were measured by Western blotting analysis; MTT method was applied to detect the proliferation activity of GES-1 cells; the effect of Akt1 and Akt2 genes transfection on the cells cycle of the GES-1 cells was tested by flow cytometry (FCM).
Results Cell modes which expressed Akt1 gene (Akt1 group) and which expressed Akt2 gene (Akt2 group) were obtained. Akt1 group: ①The relative expressions of Akt1 protein (0.96 ± 0.05) were respectively 2.03 ± 0.22 times of the black vector group (0.47 ± 0.02) and 1.48 ± 0.19 times of the control group (0.64 ± 0.03) (all P < 0.01), the relative expressions of Cyclin D1 protein (0.74 ± 0.01) were respectively 2.57 ± 0.05 times of black vector group (0.29 ± 0.01) and 3.44 ± 0.04 times of the control group (0.22 ± 0.01) (all P < 0.01); ②Compared with the black vector group and control group, the absorbance (A490) values in the first 1, 2 days were no significant differences, but there were statistically significant differences (all P < 0.01) in the first 3 to 6 days; ③Compared with the black vector group and control group, S phase cells were increased by approximately 20.00% and 21.10%, G2 phase cells were reduced by approximately 20.80% and 15.48% (all P < 0.01). Akt2 group: ①The relative expression of Akt2 protein (0.95 ± 0.01) were 1.53 ± 0.04 times of the black vector group (0.62 ± 0.02) and 1.69 ± 0.01 times of the control group (0.56 ± 0.01) (all P < 0.01), compared with the black vector group (0.29 ± 0.01) and the control group (0.22 ± 0.01), the relative expression of Cyclin D1 protein (0.31 ± 0.02) was no significant differences; ②Compared with the black vector group and the control group, the A490values of the first 1 to 6 days were no significant differences; ③Compared with the black vector group and control group, S phase cells were no significant differences.
ConclusionAkt1 gene transfection could increase the proportion of S-phase cells and enhance the proliferation ability of the GES-1 cells, but the effects of Akt2 gene was not obvious.
【Key words】Gene transfer techniques; Cyclin D1; Gastric mucosa
Author Affiliation:Department of Gastroenterology, Tianjin Medical University General Hospital, Tianjin 300052, China (XIE Jia-bei, ZHANG Qing-yu, HAN Jing, WANG Tao, ZHANG Jie); Laboratory of Neuro-Oncology, Tianjin Neurological Institute, Tianjin 300052, China (KANG Chun-sheng)
Chin Med Biotechnol, 2010, 5(6):423-428
Corresponding Author:ZHANG Qing-yu, Email: zhangqy@tijmu.edu.cn www.cmbp.net.cn
作者單位:300052 天津醫科大學總醫院消化內科(謝甲貝、張慶瑜、韓靜、王濤、張潔);300052 天津市神經病學研究所神經腫瘤研究室(康春生)
通訊作者:張慶瑜,Email:zhangqy@tijmu.edu.cn
收稿日期:2010-08-25
DOI:10.3969/cmba.j.issn.1673-713X.2010.06.005
The effect of Akt1 and Akt2 gene transfection on growth of human gastric epithelial cell GES-1
XIE Jia-bei, ZHANG Qing-yu, KANG Chun-sheng, HAN Jing, WANG Tao, ZHANG Jie
【Abstract】

