內皮素受體A在不同毛色羊駝皮膚中的分布
穆曉麗,孫樂天,耿建軍,張 杰
(1.山西農業大學動物科技學院,山西太谷030801;2.太原動物園獸醫院,山西太原030009)
羊駝(alpaca)作為一種毛用型特種經濟動物,毛色是該物種最主要的經濟性狀[1]。內皮素(endothelin,ET)是 1988 年 Yanagisawa等[2]從豬主動脈內皮細胞培養液中分離到的一種血管活性多肽,是目前所知體內最強的縮血管物質。研究表明,動物體內有3種內皮素基因,分別編碼3種ET異構肽:ET-1,ET-2和ET-3。哺乳動物體內的內皮素受體(Endothelin receptor)有 A,B這2種類型,均屬于G蛋白偶聯受體。其中,內皮素受體A(EDNRA)對ET-1,ET-2親和力強,而受體 B(EDNRB)對 ET-1,ET-2,ET-3 的親和力相同[3]。研究不同毛色羊駝皮膚中EDNRA的表達對羊駝毛色形成的影響,有助于深入了解內皮素系統參與毛色形成的機理。
本研究擬從蛋白水平探討不同毛色中ED-NRA的表達差異,為研究EDNRA對羊駝皮膚黑色素生成及毛色形成的影響奠定理論基礎。
1 材料和方法
1.1 實驗樣本
選用毛色為白色和棕色的3歲雄性羊駝各3只(由山西農業大學羊駝養殖基地提供),取每只羊駝體側皮膚,剃毛刮凈后再用取皮器取直徑8mm羊駝皮膚組織各1塊,放置于4%的中性甲醛溶液中固定,以進行免疫組織化學研究。
1.2 實驗試劑、耗材及儀器
實驗試劑為無水乙醇、二甲苯、苦味酸、甲醛、冰醋酸、APES黏片劑、0.01mol/LPBS緩沖液(pH 7.2~7.4)、丙酮、蘇木精、伊紅、中性樹膠、EDNRA多克隆兔抗人一抗(Boster,武漢)、單克隆小鼠抗兔二抗SABC試劑盒、DAB顯色液、5%BSA封閉液(Boster,武漢)等。
實驗用耗材有石蠟塊、載玻片、蓋玻片、取皮器、紗布、切片刀等。
實驗用儀器包括KD-BM生物組織包埋機、YD-335電腦切片機(浙江金華益迪醫療設備廠)、YD-A生物組織攤片機(浙江金華益迪醫療設備廠)、HPP-9160電熱恒溫培養箱、HH-6數顯恒溫水浴鍋、DMLB型顯微鏡(LeiCa,德國)等。
1.3 實驗方法
(1)將皮膚組織固定于Bouin氏固定液(飽和苦味酸水溶液75mL,40%甲醛25mL,冰醋酸5mL),固定24 h后,于70%酒精中充分沖洗。(2)組織塊浸入80%酒精2 h→85%酒精2 h→90%酒精1 h→95%酒精Ⅰ1 h→95%酒精Ⅱ1 h→無水酒精Ⅰ45min→無水酒精Ⅱ45min→無水酒精∶二甲苯(體積比為1∶1)20min→二甲苯Ⅰ30min→二甲苯Ⅱ30min→二甲苯Ⅲ30min;經二甲苯透明后浸蠟2.5 h,包埋(脫水透明及包埋在 4℃進行為宜)。(3)厚度 4~5μm,54~55℃攤片機展片,50℃烘片1 h。(4)二甲苯Ⅰ15min→二甲苯Ⅱ15min→無水酒精Ⅰ5min→無水酒精Ⅱ3min→95%酒精Ⅰ3min→95%酒精Ⅱ3min→90%酒精3 min→80%酒精2 min→70%酒精2 min→50%酒精2min→PBS緩沖液3min→3%雙氧水10min→PBS緩沖液5min,重復3次。(5)滴加5%BSA封閉液,37℃反應30min,甩去多余液體,不洗。(6)滴加一抗工作液(1∶100),將切片置于濕盒,4℃反應過夜后繼續在37℃反應 1 h。(7)PBS洗 20min,重復 2 次,滴加二抗IgG,37℃反應 30min。(8)PBS洗 5min,重復 3次,滴加 SABC,37 ℃ 30min,PBS洗 5min,重復3次。(9)取1mL蒸餾水,加入試劑盒中A,B,C試劑各1滴,混勻后加至切片。室溫顯色,鏡下控制反應時間,蒸餾水洗滌。(10)Mayor蘇木精復染,返藍,脫水,中性樹脂封片。(11)用PBS替代一抗作為陰性對照,用已知陽性切片作為陽性對照。染色陽性為細胞質中存在棕黃色顆粒。
1.4 圖像分析及統計學方法
光鏡下觀察切片并采集圖片,將圖像輸入Image-Pro Plus6.0軟件中,對EDNRA在棕色和白色皮膚組織中的免疫組織化學結果進行光密度測定,每個樣本取5張切片,每張切片取5個視野,得到陽性細胞的平均光密度值。
將所得數據用SPSS 13.0軟件進行分析,數據符合正態分布。不同樣本的細胞中光密度(OpticalDensity,OD)用One-way ANOVA單因素方差分析差異顯著,經同質性檢驗不顯著,用多重比較LSD檢驗進行兩兩比較,分析結果用平均值±標準誤差表示。
2 結果與分析
2.1 免疫組織化學結果
觀察免疫組織化學切片可見,內皮素受體A在白毛組和棕毛組中均有表達,且二者在2個對照組切片里的皮膚毛乳頭細胞、毛根鞘細胞及表皮細胞層中均存在棕黃色陽性顆粒(圖1)。
2.2 圖像分析及統計結果
EDNRA在棕色毛和白色毛羊駝皮膚組織中的免疫組織化學結果經圖像分析并進行統計學處理后顯示,所測數據均呈正態分布。軟件分析光密度值結果(表1)顯示,EDNRA只在毛根鞘處的表達差異顯著(P<0.05)。
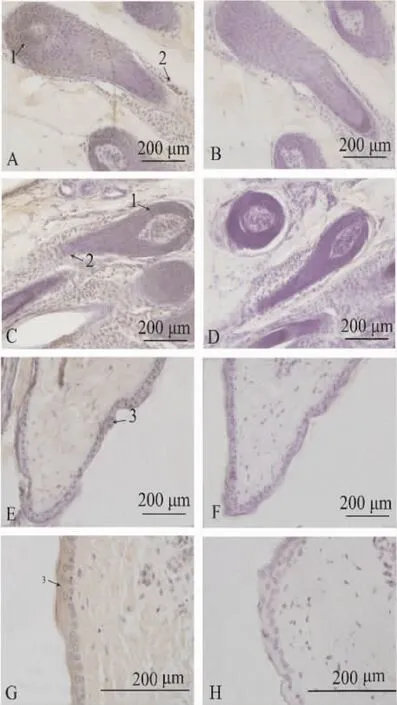
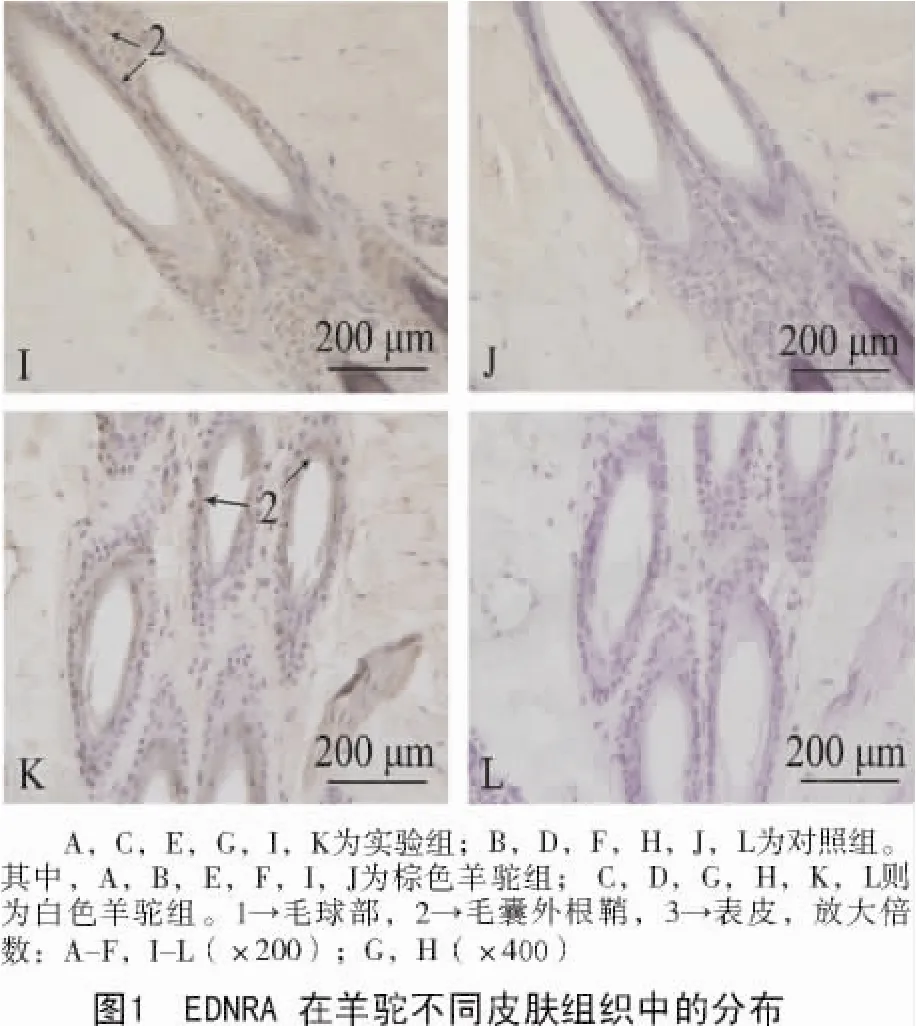
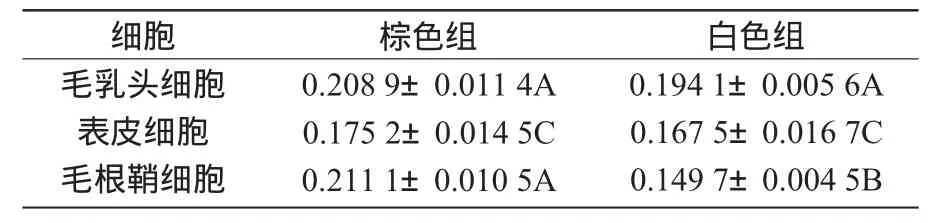
表1 EDNRA陽性表達組織的平均光密度(n=3)
3 討論
在胚胎發育過程中,黑素細胞(Melanocyte,Mc)的發育依次經歷3個階段,即神經嵴細胞、黑素母細胞和黑素細胞。黑素細胞從神經嵴沿軀干側向遷移,而其他神經嵴細胞則沿著軀干腹側部遷移,其定向分化與MITF,FGF-2,內皮素以及諸多因子的作用相關[4-5]。內皮素在黑素細胞的生長過程中有2個方面的重要作用,即調節黑素細胞前體的數量并刺激黑素細胞前體向成熟黑素細胞分化[6]。在小鼠上,內皮素可刺激其神經嵴細胞表達早期的黑素母細胞的標記物——多巴色素互變異構酶,從而導致黑素母細胞的增殖和黑素生成[7]。當小鼠ET-1或者EDNRA缺乏時,均表現為頭和心臟的神經嵴細胞亞型的缺乏[8-9]。
有研究表明,EDNRA受體主要存在于心臟、主動脈和腦血管的平滑肌細胞(VSMC)中,發揮縮血管、促進細胞增殖和組織纖維化等作用[10];在多種癌變組織中,EDNRA受體在原發腫瘤和轉移灶中表達增加,提示EDNRA受體與這些腫瘤的生長和轉移關系更為密切[11]。在本研究中,通過免疫組織化學實驗研究發現,內皮素受體A在不同毛色皮膚中的毛乳頭細胞、毛根鞘細胞以及表皮細胞中均有分布;但是受體A僅在棕毛組皮膚的毛根鞘處有較高量的表達,其他部位的表達狀況與白毛組皮膚無異,這可能與該受體在正常動物體內的主要分布狀況有關。
實驗結果提示,EDNRA與羊駝毛色形成過程中黑素細胞的生成相關,但其在羊駝毛色形成調控過程中的作用還有待于進一步的研究。
[1] 劉一飛,范瑞文,董常生.羊駝皮膚KAP3.2基因3′端序列的cDNA克隆機序列分析 [J].山西農業科學,2010,38(7):108-111.
[2] Yanagisawa M,Kurihara H,Kimura S,et al.A novel potent vasoconstrictor peptide produced by vascular endothelial cells[J].Nature,1988,332:411-415.
[3] Williams D L Jr,Jones K L,Colton CD,etal.Identification of high affinity endothelin-1 recep tor subtypes in human tissies[J].Biochemical and Biophysical Research Communications,1991,180(2):475-480.
[4] Dupin E,Douarin NM Le.Developmentofmelanocyte precursors from the vertebrate neural crest[J].Oncogene,2003,22:3016-3023.
[5] Goding CR.Melanocytes:TheNew Black[J].Int JBiochem Cell Biol,2007,39(2):275.
[6] Reid K,Turnley AM,MaxwellGD,etal.Multiple roles for endothelin in melanocyte development:regulation of progenitor number and stimulation of differentiation[J].Development,1996,122:3911-3919.
[7] Lee JM,Shin M K.The endothelin receptor B is required for the migration of neural crest-derived melanocyte and enteric neuron precursors[J].Dev Biol,2003,259:162-175.
[8] Clouthier D E,Hosoda K,Richardson JA,et al.Cranial and cardiac neural crestdefects in endothelin-A receptor-deficient mice[J].Development,1998,125:813-824.
[9] Kurihara Y,Kurihara H,Oda H,et al.Aortic arch malformationsand ventricular septaldefectinmice deficientin endothelin-1[J].JClin Invest,1995,96:293-300.
[10] Honore JC,Fecteau M H,Brochu I,etal.Concomitantantagonism ofendothelialand vascularsmoothmusclecell-EDNRB receptors for endothelin induces hypertension in the hamster[J].American Journal of Physiology Heart and Circulatory Physiology,2005,289(3):1258-1264.
[11] Cohen A J,Gilman LB,Miller Y E,etal.Endothelin receptor expression in lung cancer cell lines and bronchial epithelial cell lines[J].FASEBJ,1997,11:3221.

