牦牛血液銅鋅超氧化物歧化酶cDNA克隆測序
陳增國,毛德才,毛 亮,海思源,徐亞歐
(1.西南民族大學生命科學與技術學院,四川 成都 610041;2.瀘州醫學院心肌電生理研究室,四川 瀘州 646000)
超氧化物歧化酶(Superoxide dismutase)簡稱SOD。1938年,Mann和Keilin首次從牛紅細胞中分離出一種含銅蛋白質(Hemocuprein),1953年又從小牛等動物肝中分離出肝銅蛋白。1968年,McCord和Fridovich等對Hemocuprein的功能進行研究,由于能催化超氧陰離子O2.-的歧化反應,因此將其命名為超氧化物歧化酶(SOD),超氧化物歧化酶的作用主要是專一地清除生物氧化中產生的超氧陰離子自由基(Superoxide radical,O2.-)等中間物的毒性,能有效地防御活性氧對生物體的毒害作用。
按SOD中金屬輔基的不同,可將其分為以下3類:第一類是Cu/Zn-SOD,主要存在于真核細胞的細胞質中;第二類為含有Fe、Mn或二者都有的Fe/Mn-SOD,Fe-SOD主要存在于原核細胞和真核細胞的基質中,Mn-SOD主要存在于原核細胞體、真核細胞的細胞漿和線粒體內;第三類是NiSOD,在土壤鏈霉菌和藻青菌中發現。
1991年侯金泉等研究表明,不同生物的SOD含量有很大差別,就是同種生物的不同組織或同一組織的不同部位,其SOD含量也各不相同。其中SOD含量最豐富的是動物肝臟組織,動物血液中也富含SOD。因此,在生產實際中動物Cu/Zn-SOD基本是從動物血液的紅細胞中提取的。眾所周知,成熟的紅細胞內沒有細胞核,那么紅細胞中的Cu/Zn-SOD是在成熟紅細胞中合成的,還是在其他細胞合成后轉運到紅細胞中的呢?為此,本試驗選擇牦牛血液作為研究對象,檢測牦牛血液中是否存在合成Cu/Zn-SOD的mRNA。
1 材料與方法
1.1 材料 牦牛新鮮血液取自四川省阿壩州紅原縣的純種牦牛,頸靜脈采血10mL,置-20℃保存備用。
主要儀器及試劑:iCycler iQTM熒光定量PCR儀(Bio-Rad公司,美國);凝膠成像系統Doc2000(Bio-Rad公司,美國);Tgradient PCR 儀(Biometra公司,德國)。無水乙醇,瓊脂糖等購自Promga公司;分子量標準物 DL2000,Takara RNA PCR Kit(AMV)Ver.3.0試劑盒,DEPC、PCR 產物純化試劑盒,BL21(DE3)感受態細胞,pGM-T PCR產物克隆試劑盒均購自北京天為時代公司。
1.2 方法
1.2.1 牦牛血液總RNA提取 取牦牛新鮮血液300 μL,采用trizol法提取總RNA,通過瓊脂糖凝膠電泳檢測其純度。
1.2.2 PCR引物設計與合成 根據奶牛Cu/Zn-SOD cDNA序列(序列號:NM 174615),用Primer 5軟件設計一對PCR引物,上游引物序列為5′-GGCGTCGTTT TCTCTACTTGGT-3′、下游引物序列為 5′-GTGCCACA GAGAATGTTTAT-3′(Ysod1、Ysod2),由四川英駿生物公司合成。擴增片段大小為483bp。
1.2.3 cDNA第一條鏈合成和PCR擴增 以提取的總RNA樣品為模板,Oligo-dT為引物,用AMV反轉錄酶合成cDNA第一條鏈。反應體系用Takara RNA PCR Kit(AMV)Ver.3.0試劑盒合成cDNA第一條鏈,其配置參考Takara RNA PCR試劑盒說明書。反應條件為45℃反應45min,99℃反應5min,4℃保存。
以合成的第一條cDNA鏈為模板,以Ysod1、Ysod2為引物進行PCR擴增。
PCR 反應體積 50μL,包括 2μLMgCl2,5μL 10×PCR Buffer,0.25 μL ExTaq,1 μL dNTP,0.5 μL Ysod1,0.5μL Ysod2,2μL RT產物,38.75μL去離子水。94℃預變性2 min,然后進入PCR循環,58.5℃退火30 s、72℃延伸1min,進行40個循環,4℃保存,用1.0%瓊脂糖凝膠電泳檢測。
1.2.4 RT-PCR產物克隆測序 按pBS-T PCR產物克隆試劑盒提供的方法將PCR產物與載體連接后轉化到大腸桿菌TOP10感受態細胞,逐一挑取單個白色菌落,接種于LB培養基中,振蕩培養后取菌液進行PCR鑒定,所得條帶與RT-PCR擴增條帶大小相同。挑選經過PCR、凝膠電泳檢測為陽性的菌液交由四川省成都市英駿生物公司測序。
2 結果及分析
2.1 牦牛血液總RNA提取 對從牦牛血液中提取的總RNA樣品進行瓊脂糖凝膠電泳,結果見圖1。由圖1可見,從牦牛血液中提取的總RNA電泳后可見一條較淺的28S的RNA譜帶,這與本實驗室毛德才從牦牛肝臟組織樣品中提取的總RNA存在28S、18S、5S譜帶有明顯的不同(圖2)。
2.2 牦牛Cu/Zn-SOD RT-PCR擴增產物電泳結果RT-PCR擴增產物用1%瓊脂糖凝膠電泳后,獲得1條大小約為483bp的特異性條帶,與預期目標片段大小基本一致,見圖3。

圖1 牦牛血液總RNA樣品電泳圖
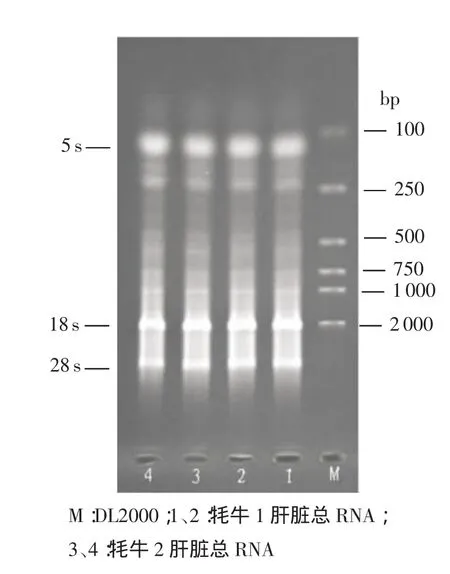
圖2 牦牛肝臟總RNA電泳結果
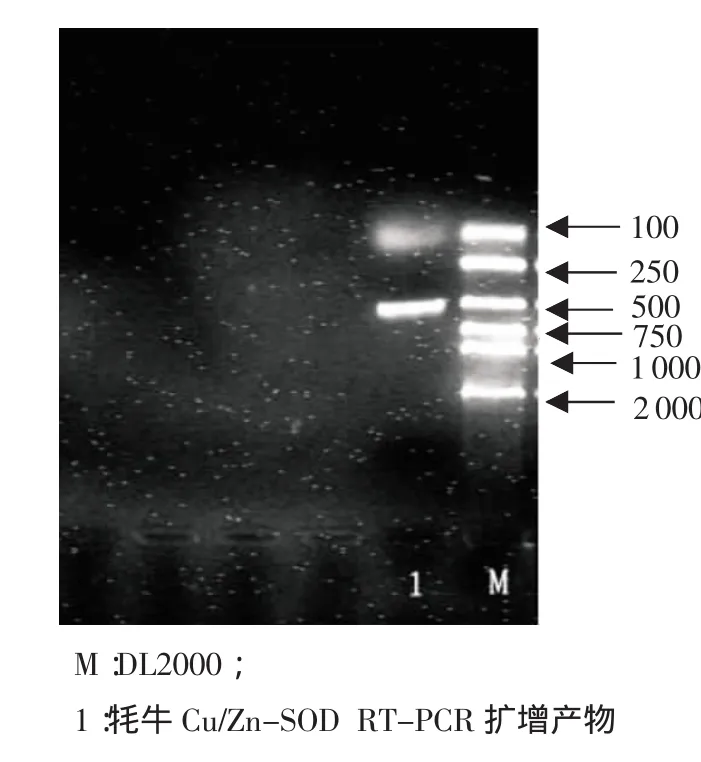
圖3 RT-PCR產物凝膠電泳圖
2.3 牦牛Cu/Zn-SOD T-A克隆鑒定 將RT-PCR擴增產物按少量DNA膠回收說明書進行回收后,取5 μL回收產物用1%瓊脂糖凝膠電泳,出現一條較純的目的片段,說明膠回收成功。膠回收產物與pGM-T載體連接后,轉化到宿主菌TOP10并涂在含有Amp的LB固體平板上,37℃培養過夜,隨機挑取白斑轉到含100 mM Amp的LB液體培養基中搖轉培養過夜,然后以菌液為模板進行PCR擴增反應鑒定重組結果。
2.4 重組子的PCR鑒定 挑選白色菌落,接種于LB液體培養基中進行培養,以菌液中的重組子為模板進行PCR擴增,產物經凝膠電泳后發現PCR擴增片段位于約483bp處,與RT-PCR產物電泳圖一致,初步確定克隆成功(見圖4)。
2.5 克隆產物測序 挑選經過PCR、凝膠電泳檢測為陽性的菌液交由四川省成都市英駿生物公司測序,結果得出測序片段大小為483bp。經比較,與毛德才從牦牛肝臟組織中獲得的cDNA序列完全一致。
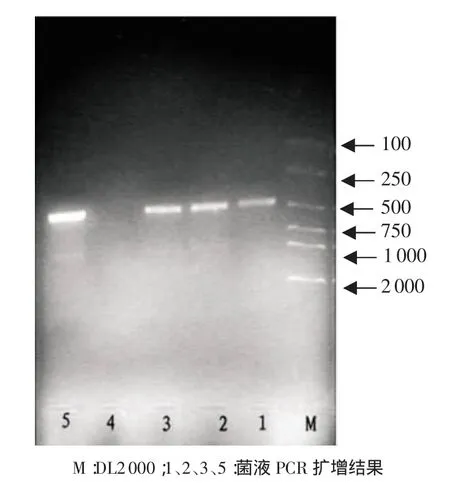
圖4 重組子PCR鑒定結果圖
3 小結與討論
通過對比牦牛血液總RNA樣品電泳圖和牦牛肝臟組織總RNA電泳圖,發現牦牛血液樣品總RNA樣品電泳圖可見一條較淺的28S RNA譜帶,因此證實了牦牛血液中的RNA含量很低。
本試驗選取高原畜種牦牛為研究對象,從牦牛血液中提取總RNA,反轉錄克隆了牦牛Cu/Zn-SOD cDNA,經測序,片段大小為483bp。證實該序列是牦牛SOD的cDNA序列。
由于成熟的紅細胞中沒有細胞核,因此并不具備合成SOD的條件,但是本試驗卻從牦牛血液中提取到了少量SOD的mRNA。那么,牦牛血液中合成SOD的mRNA就可能有幾個來源:第一,可能是紅細胞還沒有成熟前就已經合成了SOD蛋白質;第二,可能是其他細胞合成后轉運到紅細胞中的。而紅細胞中的具體來源還有待于進一步研究證實。
[1]Mannt,Keilin D. Hemocuprein and hepatocuprein copper-protein compounds of blood and liverin mammals[J].Proe R SoeB,1938,126:303-315.
[2]McCord J M,Frodovich I.Superoxide dismutase.An enzymic function for erythrocuprein (hemocuprein)[J].Biol.Chem.,1969,244:6049-6055.
[3]李文杰.超氧化物歧化酶在治療超氧陰離子自由基所引起的疾病及抗衰老上的應用 [J].中國藥學雜志,1989,24(7):397-400.
[4]王慶莉,王居亮,陳德展.超氧化物歧化酶的理論研究進展[J].山東師范大學學報(自然科學版),2009,24(2).
[5]侯金泉,等.十八種動植物SOD含量探討[J].生化藥物雜志,1991,(2):25.

