電極材料Li4Ti5O12制備方法研究進展
劉浩文,劉針邑,唐定國
(中南民族大學化學與材料科學學院催化材料科學湖北省重點實驗室,湖北武漢 430074)
鋰離子電池具有電壓高、能量密度大、循環壽命長、無環境污染等特點,自從20世紀90年代由Sony公司引入市場以來,已廣泛應用于移動電話、筆記本電腦、小型攝像機等便攜式電子設備中。而且,作為電源更新換代產品,鋰離子電池還將在電動汽車、衛星及航天等領域得到廣泛應用。
鋰離子電池多采用碳素材料作為負極。碳負極材料一般具有石墨的層狀結構,可以嵌入/脫嵌鋰,和正極材料一起構成電池。由于碳電極與金屬鋰的電極電位相近,在充電過程中電解液將發生還原分解反應并在碳電極表面形成固體-電解質界面(SEI),消耗電解液并惡化電極性能。而且,在電池過充電狀況下,碳電極表面可能析出金屬鋰而形成枝晶造成短路,給電池帶來極大的安全隱患。基于高電化學性能和高安全性的考慮,負極材料的研究除了碳之外,還有硅負極、硫化物、錫基合金等,但這些材料還無法獲得理想效果。這時,“零應變”鈦酸鹽材料Li4Ti5O12逐漸成為研究的熱點。Li4Ti5O12在1.55 V電壓下的較高放電容量和穩定的循環性能,使它可以作為負極與LiMn2O4、LiCoO3、LiNiO2等4 V正極材料組裝成2.5 V鋰離子電池[1],與5 V正極LiCoPO4組裝成3.5 V鋰離子電池[2],或與3.5 V正極LiFePO4組裝成2 V鋰離子電池[3]。
1 電極材料Li4Ti5O12的特點
Li4Ti5O12(也寫作Li4/3Ti5/3O4)為白色物質,在空氣中能穩定存在。Li4Ti5O12為尖晶石結構,具有與 LiMn2O4相似的“(A)[B2]O4”結構,空間群為Fd3m,其中 O2-離子構成 FCC點陣,位于32e的位置,部分Li+位于8a的四面體間隙中,同時部分Li+和Ti4+位于16d的八面體間隙中,其結構式可寫為[Li]8a[Li1/3Ti5/3]16d[O4]32e,晶格常數a=0.836 nm。充電過程中,結構變化如下[4]:
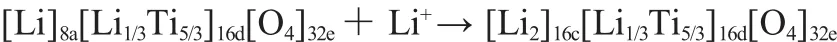
參與反應的Li+嵌入到Li4Ti5O12的晶格中時占據16c位置,且原來位于8a的Li+也遷移到16c位置,最后所有16c位置都被Li+占據,反應產物Li7Ti5O12為淡藍色。
研究發現,在Li+嵌入或脫嵌過程中,Li4Ti5O12的晶型不發生變化,晶胞參數a在0.836 nm和0.837 nm之間變化,體積變化小于1%,因此被稱為“零應變”材料[4]。這具有重要意義,能夠避免充放電循環中由于電極材料的膨脹收縮而導致的結構破壞,從而提高電極的循環性能和使用壽命,減慢循環過程中電池容量衰減的速度,使Li4Ti5O12具有比碳電極更優良的電化學性能。
Li4Ti5O12相對于金屬鋰的電極電位為1.55 V,理論比容量為175mAh/g,實際比容量約為150~160mAh/g[5]。由于Li4Ti5O12電極的工作電壓較高,因此在鋰離子電池充放電過程中,有機電解液將不會在較低的電壓(<0.8 Vvs.Li+/Li)下發生還原分解,提高了電池的循環性能和安全性[6]。在25℃下,Li4Ti5O12的化學擴散系數為2×10-8cm2/s,比鋰在碳負極材料中的擴散系數約高一個數量級,使其能以較大電流快速地充放電[7]。同時,Li4Ti5O12在全充電狀態下有良好的熱穩定性、較小的吸濕性及穩定的充放電平臺,使它成為下一代鋰離子電池的候選負極材料[6]。
2 電極材料Li4Ti5O12的合成方法
2.1 高溫固相合成法
高溫固相合成法技術成熟,操作簡單,對設備要求低,適用于大規模生產,因此在很多研究中通過高溫固相反應合成Li4Ti5O12。Li4Ti5O12的高溫固相合成工藝與其他金屬復合氧化物的合成工藝類似,通常以LiOH·H2O或Li2CO3與TiO2為原料,通過高溫(800~1 000℃)、長時間(24 h以上)的熱處理制備產物。常用的表征手段包括熱失重(TG)分析和X射線衍射圖譜(XRD)分析。一般按一定物質的量比例[如n(Li)∶n(Ti)=4∶5]將LiOH·H2O和TiO2分散在有機溶劑或水中,在高溫下除去溶劑,然后在空氣氣氛中800~1 000℃燒結3~24 h,自然冷卻后球磨得到理想的尖晶石結構Li4Ti5O12。Izquierdo[8]在對鋰鈦氧化合物系列的制備研究中發現Li4Ti5O12的尖晶石結構可耐受的最高焙燒溫度為(1 015±5)℃。超過這個溫度,它就會分解為Li2TiO3和Li2Ti3O7的混合相。
在高溫固相反應中,反應溫度、反應時間、原料比例以及混料工藝均是影響Li4Ti5O12材料性能的重要因素。高玲等[9]以LiOH和TiO2粉體為原料,分別在600、700、800、900℃下加熱12 h制備得到了鈦酸鋰。經分析發現,600℃時反應不完全,產物中含有大量TiO2;700℃以上時反應比較完全,產物為Li4Ti5O12,XRD分析與標準圖譜有很好的對應性。因此,高溫固相法合成鈦酸鋰的溫度應在700℃以上。通常,為了保證產物結晶性和反應較快地進行,反應溫度一般控制在800~1 000℃之間。Li等[10]將LiOH和TiO2的混合物在800℃下加熱2 h合成了Li4Ti5O12,然后考察后續熱處理不同時間對產物性能的影響。研究發現,雖然經600℃熱處理不同時間(0、2、8、12 h)后產物的晶體結構未發生明顯的變化,但其電化學性能有較大的改變。測試表明,8 h的熱處理可以很好地改善鈦酸鋰材料的形貌、動力學過程和鋰離子擴散系數,從而提高了倍率性能。高溫固相反應中使用的原料通常是固體粉末,一般按照化學計量比[11](Li與Ti摩爾比為4∶5)稱取一定質量的反應物混合后經過高溫反應得到Li4Ti5O12,產物具有較好的電化學性能。但考慮到鋰鹽在高溫下容易揮發,阮艷莉等[12]將鋰鹽過量8%,然后經高溫固相反應制備出晶型很好的鈦酸鹽產物。楊建文等[13]經過研究認為,當鋰鈦摩爾比為0.84時產物具有最優性能。Li等[10]在研究中也采用這一比例制備了Li4Ti5O12。混料工藝可以影響原料均勻程度,從而影響產物的純度和電化學性能。目前,混料工藝一般分為三種:普通混合[10]、研磨混合[12]和球磨混合[9]。高劍等[11]研究了研磨和球磨方式混合反應物對產物性能的影響,結果表明,球磨混合原料的方法制備出的Li4Ti5O12顆粒更均勻,具有更好的電化學性能。阮艷莉等[12]在研究中發現,以研磨方式混合原料時加入適量的溶劑,可以很好地分散混合反應物,提高固相反應速率,在較短的時間內合成純相的Li4Ti5O12。
高溫固相反應工藝簡單,易于實現工業化生產,但缺點也是顯而易見的。如:粉體原料需要長時間的研磨混合,混合均勻程度有限,擴散過程難以順利進行;要求較高的熱處理溫度和較長的熱處理時間,能耗大;產物非常堅硬,很難將其磨成制作電極需要的粉末;材料電化學性能不易控制,等等。
2.2 溶膠-凝膠法
由于固相反應受到合成條件的影響,可能導致材料不均勻,粒徑分布過寬,性能不易控制等弊病,通常可采用溶膠-凝膠法避免上述情況的發生,提高材料的均勻性。溶膠-凝膠法一般將金屬有機化合物和無機化合物經溶液-溶膠-凝膠過程而固化,再經熱處理得到氧化物和其他化合物,通常采用草酸、酒石酸、丙烯酸、檸檬酸等作為螯合劑,不僅可以使原料在原子級水平均勻混合,而且保持產物粒徑在納米范圍內。經過溶膠-凝膠過程的反應前驅體在較低溫度下焙燒就可得到結晶良好的材料,燒結時間也比固相反應法短,且成分容易控制,適合制備多組分材料,也是制備納米級Li4Ti5O12的主要方法。
溶膠-凝膠法制備Li4Ti5O12的典型步驟如圖1所示[14]。溶膠-凝膠法制備Li4Ti5O12的可能形成過程為:鈦酸丁酯的醇溶液在有水存在時緩慢水解,首先生成Ti(OH)4,然后發生失水縮聚和失醇縮聚形成凝膠;前驅體在高溫加熱時氫氧化鈦發生分解生成TiO2,然后和鋰鹽LiOOCCH3分解得到的Li2O或Li2CO3反應生成Li4Ti5O12。在圖1所示的步驟中,鈦酸丁酯水解形成Ti(OH)4的同時,鋰鹽在溶液中可以和鈦鹽在原子級水平相互分散,所以在前驅體中鋰鈦二者均勻存在,減少了高溫反應中離子遷移,故而可以有效地降低反應的溫度。
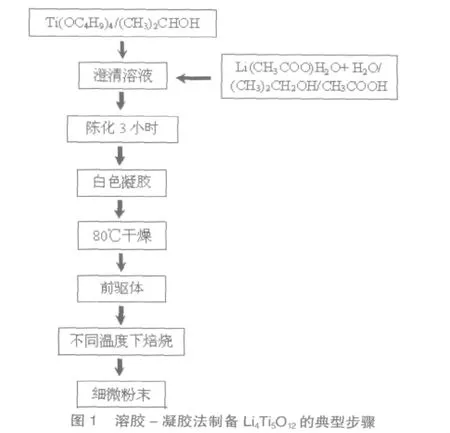
溶膠-凝膠法制備Li4Ti5O12采用的鈦源通常是鈦酸丁酯
Ti(OC4H9)4[15-19]或其他有機鈦鹽[20-21]。高劍等[22]選擇無機鈦鹽TiCl4作為鈦源,發展了一種新穎的油包水體系的溶膠-凝膠技術,形成了球形前驅體,使最終得到的產物為球形,具有較高的振實密度和良好的電化學性能。Hao等采用草酸[17]、檸檬酸[18]和三乙醇胺[19]作為螯合劑通過溶膠-凝膠法制備了納米Li4Ti5O12。研究發現,這樣制備的Li4Ti5O12材料形貌規則,粒徑分布較窄,平均粒徑分別為200 nm[17]和500 nm[18],三乙醇胺的加入量不同時,粒徑在223~105 nm[19]之間變化。同時,材料具有很好的電化學性能,初始放電容量高達167~171mAh/g。王斌等[15]專門研究了溶膠-凝膠法后續處理中焙燒溫度對材料性能的影響。他以鈦酸丁酯和醋酸鋰為原料,考察了600、700、800、900℃處理得到的材料的性能。研究發現:隨著焙燒溫度的增加,Li4Ti5O12晶粒的尺寸不斷長大,電極材料的電化學循環性能趨于平穩,但是比容量卻不斷下降。800℃焙燒的樣品比容量最高,且表現出良好的循環性能。隨著焙燒溫度的升高,晶粒尺寸的長大及分布變寬,可能是導致其容量下降的原因。賀慧等[16]的研究表明,合成溫度低于650℃時會有雜質TiO2存在,而在800℃以上時則可得到單相Li4Ti5O12,與王斌的結論相符。Hao[17,19]和高劍等[22]亦得到相似的結果。所以,溶膠-凝膠法制備Li4Ti5O12時的焙燒溫度一般在800℃以下,比高溫固相法所需溫度低,且反應迅速完全。除了常規的溶膠-凝膠法研究外,Jiang等[21]將溶膠-凝膠過程和模板方法相結合,將含有鈦鋰的前驅體凝膠包覆在碳微球表面,然后經過高溫處理,成功地制備了Li4Ti5O12材料。這樣制備的Li4Ti5O12具有空心球結構,比粉體材料具有更高的比容量和更好的倍率性能,這是因為空心球的薄壁結構減少了鋰離子的遷移距離,增加了和電解液的接觸面積,從而提高了放電性能。Kim等[20]采用溶膠-凝膠法,在850℃下制備了Li4Ti5O12,然后使用高能球磨工藝處理產物。最終產物是晶型很好的納米微晶,循環性能良好,初始放電容量高達173mAh/g。
2.3 水熱合成法(溶劑熱合成法)
水熱合成法也是制備電極材料較常見的濕法合成法,但水熱法合成Li4Ti5O12的研究卻少有報道。一般來說,水熱合成法具有以下優點:(1)在相對較低的溫度下合成具有晶體結構的材料;(2)反應條件多變可調;(3)產物組成均勻,物相和微結構一致,粒徑分布較窄;(4)設備比較簡單,操作不復雜。
Li等采用超聲-水熱法成功地在強堿溶液中制備了鈦酸納米管前驅體[23],經過離子交換和低溫焙燒制備了形狀可控、電化學性能優良的Li4Ti5O12納米管/納米線[24]。首先,將銳鈦礦TiO2分散在高濃度NaOH溶液中,超聲波處理一定時間后將分散液轉移到水熱反應釜中,在120~170℃下反應24 h至數天,然后洗滌沉淀并進行酸處理得到鈦酸納米管,再將鈦酸納米管和LiOH溶液進行水熱處理以進行鋰離子交換,產物進一步低溫焙燒后得到最終產物Li4Ti5O12納米管/納米線。反應溫度、pH值等離子交換條件和焙燒溫度與時間會影響產物的形貌和性能,研究結果表明水熱合成法制備的材料在電荷轉移阻抗及動力學數據方面比傳統高溫固相法制得的材料有一定程度的改善。另外,Li等[25]將LiOH和四丁基鈦酸酯分散在乙醇中在140℃下反應24 h,通過溶劑熱法合成了鈦酸鋰。XRD研究發現產物的結晶度不高,主要晶型為Li4Ti5O12和Li2Ti3O7。結論表明,原料中鋰鈦摩爾比會影響產物的顆粒大小和結晶度,穩定的晶體結構將有助于材料保持良好的循環性能。
2.4 高能球磨法
高能球磨法是新近發展起來的一種化學合成方法,可以提高原料混合的效率,產物結晶度高。作為一種新技術,它具有明顯降低反應活化能、細化晶粒、極大提高粉末活性和改善顆粒分布均勻性的特點,同時可以促進固態離子擴散,誘發低溫化學反應。因此,高能球磨法是一種節能、高效的材料制備技術,也被應用到合成Li4Ti5O12的研究中。
Yu等[26]以化學計量比的銳鈦礦TiO2和Li2CO3為原料,添加一定質量的酚醛樹脂,通過高能球磨法制備分散均勻的前驅體,然后經高溫處理可以制得Li4Ti5O12。Kim等[20]以鈦酸異丁酯和LiOH為原料,通過溶膠-凝膠方法制備前驅體,并噴霧干燥經高溫處理得到Li4Ti5O12。然后,將所得產物經過高能球磨,研究發現,無論XRD譜線的強度還是尖銳程度,在高能球磨處理之后都變強了,說明產物經過高能球磨處理后,結晶度有一定程度的提高。
2.5 微波法
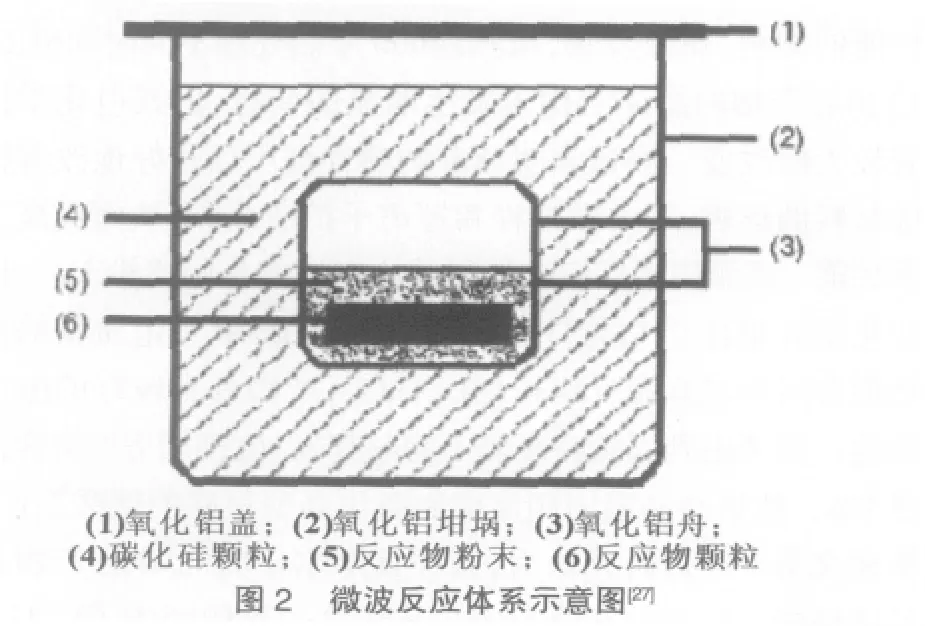
微波技術用于制備電極材料從本質上也是高溫固相反應,但與傳統的高溫固相反應相比,微波加熱具有節約能源、合成速度快、加熱均勻等特點,因此越來越受到人們的重視。微波法已被廣泛用于制備正極材料,可以快速有效地使固相反應進行并且降低反應溫度。現在,微波法也被用于制備鈦酸鋰負極材料。Yang等[27]利用微波法首次合成了一系列鋰鈦氧化合物,如 Li4Ti5O12、Li2Ti3O7、Li2TiO3和 LiTiO2。產物 Li4Ti5O12具有很好的性能,初始放電容量為150mAh/g,放電平臺為1.56 V。按照化學計量比混合原料Li2CO3和TiO2,置于氧化鋁坩堝,用碳化硅作為微波吸收材料,并將熱量轉移至原料發生化學反應,生成Li4Ti5O12。因為反應有CO2氣體放出,所以要控制微波加熱功率,以保證最終產物的形貌特征。典型的微波反應體系如圖2所示。
2.6 噴霧干燥法
噴霧干燥法將原料溶液霧化,然后在高溫干燥氣流中迅速失水得到產物,常用于制備具有一定形貌的細微粒子,它的優點是產物形貌均一,粒徑分布窄。噴霧干燥法也可用于制備Li4Ti5O12負極材料。KiyoshiNakahara等[28]將LiOH和TiO2的混合物經噴霧干燥處理,得到分散性良好的細微粒子,再經高溫處理即得到Li4Ti5O12,平均粒徑僅有0.7μm。產物具有優良的倍率放電性能和循環特性,1C循環100次放電容量保持了99%,即使10C下也能保持86%。如果在50℃下10C循環100次,放電容量保持率為96%。Wen等[29]采用噴霧干燥法得到了多孔球形Li4Ti5O12。他們將Li2CO3、TiO2和一定量PVB用乙醇混合,球磨得到漿液,然后噴霧干燥得到球形前驅體。經過高溫處理,則得到多孔球形Li4Ti5O12。
2.7 燃燒法
燃燒法是一種制備Li4Ti5O12的新方法,它的優點在于經濟性高,產物粒徑可以小至納米級別。Raja等[30]將一定量的Ti(OCH3)4溶解在70%的HNO3溶液里,然后將其和LiNO3溶液150℃下在熱板上混合,并在混合物中加入適量L-丙氨酸,最終得到凝膠。將所得凝膠燃燒,并經800℃高溫處理得到最終產物。研究發現,在凝膠燃燒過程中,丙氨酸將成為合成Li4Ti5O12所需的能量來源,即463℃以上可能發生了Li4Ti5O12合成反應。用這種方法合成的Li4Ti5O12平均粒徑為40~80 nm。結論表明,燃燒法不僅比較經濟,而且可以得到納米級產物。
2.8 其他合成方法
除了以上合成方法,研究者也采用了其他一些方法合成Li4Ti5O12。比如,電合成法[31]采用鈦金屬制備納米鈦酸鋰前驅體,簡單易行,等等。
3 結束語
作為一種“零應變”電極材料,Li4Ti5O12受到越來越多的重視,是鋰離子電池負極材料的研究熱點之一。它具有優良的電化學性能,尤其是循環性能使其在動力電源方面的應用空間十分廣泛,可滿足電動汽車或混合動力汽車對電源的一些特殊要求。
[1]OHZUKU T,HIRAL T.Thermal gravimetric studies ofmanganese dioxide[J].Electrochim ica Acta,1982,27:1049-1053.
[2]OKADA S,SAWA S,EGASHIRA M,et al.Cathode properties of phospho-olivine LiMPO4for lithium secondary batteries[J].Journal of Power Sources,2001,97-98:430-432.
[3]RAVET N,CHOUNINARD Y,MAGNAN JF,et al.Electroactivity of natural and synthetic triphylite[J].Journal of Power Sources,2001,97-98:503-550.
[4]OHZUKU T,UEDA A,YAMAMOTO N.Zero-strain insertionmaterial of Li[Li1/3Ti5/3]O4for rechargeable lithium cells[J].Journal of the Electrochem ical Society,1995,142:1431-1435.
[5]吳宇平,戴曉兵,馬軍旗,等.鋰離子電池——應用與實踐[M].北京:化學工業出版社,2004:120-124.
[6]唐致遠,武鵬,楊景雁,等.電極材料Li4Ti5O12的研究進展[J].電池,2007,37(1):73-75.
[7]唐致遠,薛建軍,劉春燕,等.鋰離子在石墨負極材料中擴散系數的測定[J].物理化學學報,2001,17(5):285-288.
[8]IZQUIERDO G,WEST A R.Phase equilibria in the system Li2OTiO2[J].Materials Research Bulletin,1980,15(11):1655-1660.
[9]高玲,仇衛華,趙海雷.合成溫度對Li4Ti5O12電化學性能的影響[J].電池,2004,34(5):351-352.
[10]LIY,ZHAO H L,TIAN Z H,et al.Heat treatment effect on electrochemicalpropertiesof spinel Li4Ti5O12[J].Rare Metals,2008,27(2):165-169.
[11]高劍,姜長印,應皆榮,等.Li4Ti5O12的合成及性能研究[J].電源技術,2006,130(5):362-365.
[12]阮艷莉,唐致遠,彭慶文.尖晶石型Li4Ti5O12電極材料的合成與電化學性能研究[J].無機材料學報,2006,21(4):873-879.
[13]楊建文,鐘暉,鐘海云,等.Li4Ti5O12的合成及其影響因素[J].中南大學學報:自然科學版,2005,36(1):55-59.
[14]SHEN C,ZHANG X,ZHOU Y,etal.Preparation and characterization of nanocrystalline Li4Ti5O12by sol-gelmethod[J].Materials Chem istry and Physics,2002,78:437-441.
[15]王斌,瞿美臻,林浩強,等.煅燒溫度對Li4Ti5O12的電化學性能的影響[J].合成化學,2006,14(6):631-633.
[16]賀慧,程璇,張穎.鋰離子電池負極材料Li4Ti5O12的結構和性能[J].材料研究學報,2007,21(1):82-86.
[17]HAO Y J,LAIQ Y,LU JZ,etal.Synthesisand characterization of spinel Li4Ti5O12anode material by oxalic acid-assisted sol-gel method[J].Journalof Power Sources,2006,158:1358-1364.
[18]HAO Y J,LAIQ Y,LIU D Q,etal.Synthesisby citric acid sol-gel method and electrochem ical properties of Li4Ti5O12anodematerial for lithium-ion battery[J].Materials Chemistry and Physics,2005,94:382-387.
[19]HAO Y J,LAIQ Y,XU Z H,et al.Synthesis by TEA sol-gel method and electrochem ical properties of Li4Ti5O12anodematerial for lithium-ion battery[J].Solid State Ionics,2005,176:1201-1206.
[20]KIMH J,OHLMH,SONW K,etal.A novel synthesismethod and electrochem ical characteristics of lithium titanium oxide as anode material for high power device[J].IEEE Conference Proceeding,2006(6):464-467.
[21]JIANG CH,YONG Z,HONMA I,etal.Preparation and rate capability of Li4Ti5O12hollow-sphere anode materia[J].Journal of Power Sources,2007,166:514-518.
[22]高劍,姜長印,應皆榮,等.鋰離子電池負極材料球形Li4Ti5O12的合成及性能研究[J].無機材料學報,2007,22(1):176-1780.
[23]LIJR,TANG Z L,ZHANG Z G.H-titanate nanotube:a novel lithium intercalation hostwith large capacity and high rate capability[J].Electrochem istry Communications,2005,7:62-67.
[24]LIJR,TANG Z L,ZHANG ZG.Controllable formation and electrochemical properties of one-dimensional nanostructured spinel Li4Ti5O12[J].Electrochem istry Communications,2005,7:894-899.
[25]LIY,ZHAOH L,TIAN ZH,etal.Solvothermal synthesis and electrochem ical characterization of amorphous lithium titanate materials[J].Journalof Alloysand Compounds,2008,455:471-474.
[26]YU H Y,ZHANG X F,JALBOUT A F,etal.High-rate characteristics of novel anode Li4Ti5O12-polyacene materials for Li-ion secondary batteries[J].Electrochimica Acta,2008,53:4200-4204.
[27]YANG L H,DONG C,GUO J.Hybrid microwave synthesis and characterization of the compounds in the Li-Ti-O system[J].Journalof Power Sources,2008,175:575-580.
[28]KIYOSHIN,RYOSUKE N,TOMOKO M,et al.Preparation of particulate Li4Ti5O12having excellent characteristics as an electrode active material for power storage cells[J].Journal of Power Sources,2003,117:131-136.
[29]WEN Z Y,GU Z H,HUANG SH,et al.Research on spray-dried lithium titanate as electrodematerials for lithium ion batteries[J].Journalof Power Sources,2005,146:670-673.
[30]RAJA MW,MAHANTY S,KUNDU M,et al.Synthesis of nanocrystalline Li4Ti5O12by a novel aqueous combustion technique[J].Journalof A lloy and Compounds,2009,468:258-262.
[31]朱傳高,朱其永,魏亦軍,等.納米Li4Ti5O12前驅體的電合成及其溶膠-凝膠過程[J].化學世界,2005,8:453-457.

