卵巢漿液性囊腺癌彩色多普勒血流顯像與微血管密度及 COX-2表達的相關性研究
王 健,鄭春梅,曹 霞,黃雪蘭,楊 欣
(佳木斯大學附屬第一醫院物理診斷科,黑龍江 佳木斯 154003)
卵巢惡性腫瘤發病隱匿的特點使許多患者就診時已處于晚期,因此,高敏感性、高特異性的診斷手段是早期診斷卵巢癌的關鍵。我們應用彩色多普勒超聲診斷技術檢查了42例卵巢腫瘤的患者,觀察其形態結構特征和血流供應特點。應用免疫組化法對手術切除的12例卵巢良性腫瘤和30例卵巢漿液性囊腺癌標本檢測其組織中 COX-2表達,探討彩色多普勒血流顯像應用的血管病理學基礎,卵巢癌的微血管密度 (microvessel density,MV D)與 COX-2在卵巢癌中的表達的相關性研究,評價其應用價值。
1 資料與方法
1.1 標本來源
回顧性分析佳木斯大學第一附屬醫院 2008—06~2009— 07手術切除的卵巢腫瘤組織標本 42例,30例卵巢漿液性囊腺癌,卵巢良性腫瘤12例,(其中2例良性畸胎瘤、5例漿液性囊腺瘤及 5例卵巢纖維瘤)。所有患者術前均未接受任何治療,患者年齡 28~ 75歲,平均 (53.26±13.33)歲。所有標本經10%福爾馬林固定,石蠟包埋,連續5μm切片。
1.2 研究方法
使用 ATL-HDI3500GE LOGIQ9、腹部探頭頻率3.5MHz;陰道探頭頻率5/7.5M Hz,觀察卵巢腫瘤患者病灶的特征和腫瘤血供情況并記錄 ,并3次提取 RI值,取平均值。
1.3 主要試劑
兔抗人 COX-2單克隆抗體、SP試劑盒、濃縮型 DAB酶底物顯色試劑盒和 EDT A抗原修復液及鼠抗人 CD34單克隆抗體工作液由福州邁新技術開發公司提供。
1.4 免疫組化染色
全部標本均經10%的福爾馬林液固定,石蠟包埋切片。COX-2和 CD34免疫組織化學染色按 SP染色試劑盒(福州邁新公司)說明操作,所購抗體均為即用型抗體,染色時均需用 EDTA抗原修復液進行微波修復抗原。切片加一抗前胃蛋白酶37℃消化 1h,采用已知的陽性片作陽性對照,PBS代替一抗作為陰性對照,每一批實驗均設有陽性對照和陰性對照。
1.5 結果判定
組織 COX-2表達程度的判斷標準:以胞漿內出現棕黃色顆粒視為 COX-2表達陽性細胞;取 5個高倍視野,每個高倍視野計數100個細胞,組織中 COX-2表達陽性細胞百分率<5%則視為組織 COX-2表達陰性(-),依此類推,5%~25%為弱陽性(+),25%~ 50%為中等強度陽性(++),> 50%以上為強陽(+++)。MVD定量方法:按 Weider[1]推薦的方法,首先在低倍鏡下掃查整個切片,以染成棕黃色的單個內皮細胞或內皮細胞簇作為一個血管計數,尋找微血管密度最高的腫瘤區域,然后在高倍光鏡下,隨機計數5個視野內微血管數,取平均值。MVD結果用± s)表示。
1.6 統計學方法
采用 SPSS 13.0統計學軟件對各組間差異進行方差分析和兩變量間相關分析。P<0.05為有統計學意義。
2 結果
2.1 各組觀察指標比較
①卵巢漿液性囊腺癌的血流頻譜呈低阻特征 RI(0.32±0.10),良性腫瘤的血流頻譜呈高阻特征 RI(0.61±0.12),兩組比較差異,有統計學意義 (P<0.05)。② COX-2在良惡性腫瘤表達進行比較,COX-2在卵巢漿液性囊腺癌的陽性表達率明顯高于良性腫瘤組具有統計學意義 (P<0.05)。③卵巢良惡性腫瘤 MVD之間比較差異,具有統計學意義(P <0.01)。各組觀察指標比較見表1。
2.2 免疫組化檢測結果分析
卵巢漿液性囊腺癌 MVD于 COX-2有相關性(r= 0.490,P<0.01),有統計學意義。卵巢漿液性囊腺癌MVD及 COX-2的表達分別見圖1及圖2。
表1 卵巢漿液性囊腺癌與良性腫瘤觀察指標比較(±s)

表1 卵巢漿液性囊腺癌與良性腫瘤觀察指標比較(±s)
與卵巢漿液性囊腺癌組比較*P <0.05,△P<0.01,有差異。
觀察指標 卵巢漿液性囊腺癌組 良性腫瘤組COX-2 (++ )~ (+++ ) (一)~ (+ )*RI 0.32± 0.100.61± 0.12*MVD 38.73± 9.2014.33± 5.90△

圖1 在卵巢漿液性囊腺癌微血管的染色(×400)
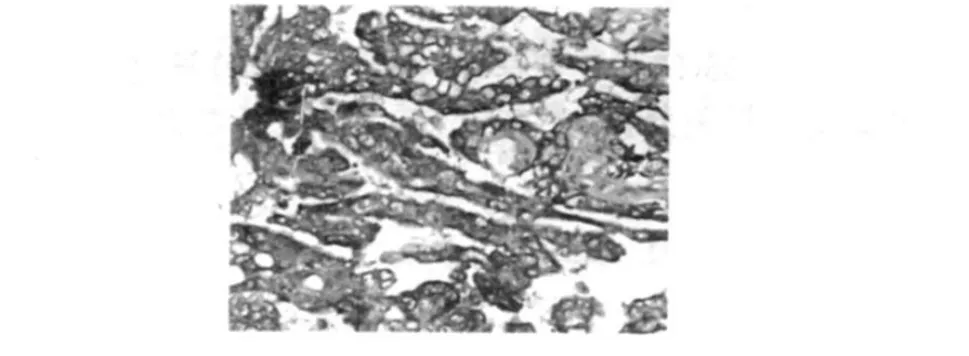
圖2 COX-2在卵巢漿液性囊腺癌中的陽性表達(×400)
3 討論
MVD作為腫瘤血管形成的指標,是目前常用的評價腫瘤血管生成情況的方法。腫瘤的生長與擴散取決于血管生成,癌腫因生長迅速、代謝旺盛,需要充足的血流和能量供應,當腫瘤長到3mm時,進一步生長需要新的血管生成,血管生成使腫瘤得以獲得足夠的營養物質而持續生長,如果沒有血管生成,腫瘤的生長將受到限制,原發性腫瘤一般 <1~2mm[2]。新生的血管不僅向腫瘤提供充足的營養,導致腫瘤的惡性生長與轉移,腫瘤生長階段血管期的開始標志著腫瘤開始快速生長、局部浸潤,最后導致轉移的發生[3]。本研究結果表明良惡性腫瘤的生物學基礎不同,這為研究良惡性腫瘤提供了理論依據。還發現卵巢漿液性囊腺癌的 MVD(38.73± 9.20)明顯高于卵巢良性腫瘤的 MVD(14.33±5.90)(P<0.01),有著明顯差異,但是 MV D的測定只能在術后病理組織檢測,不能術前觀察腫瘤的血管生成情況,因此彩色多普勒血流顯像對卵巢腫瘤術前檢測與術后 MVD檢測兩者相結合,為臨床術式預案、判斷惡性程度以及抗血管生成治療方面提供更多有價值的信息。環氧合酶-2(cyclooxygenase2,COX-2)是花生四烯酸轉化成前列腺素過程中重要的限速酶,Li等[4]發現 COX-2在轉移癌中比正常卵巢組織和原位癌中表達更高,而且 COX-2在腫瘤侵襲的周圍和新的轉移灶中更易被發現,提示 COX-2可能有促進卵巢癌轉移的作用。本研究發現 COX-2在卵巢漿液性囊腺癌中的表達明顯高于卵巢良性腫瘤 (P<0.01),在不同組織分級的卵巢腫瘤組織中,COX-2陽性表達率不同,隨著腫瘤的浸潤和淋巴結轉移的發生,COX-2陽性表達率明顯增高,說明 COX-2是在卵巢漿液性囊腺癌的生長過程中有著重要的地位,也表明了 COX-2的陽性表達率的升高可能與卵巢癌變和腫瘤發展密切相關。有浸潤或腫瘤向外生長時,腫塊輪廓不清,邊緣不整齊,惡性腫瘤可能是自病變中央開始新生血管形成的,且新生血管常缺乏平滑肌成分,導致這些血管內血流的低阻力[5],彩色血流在腫瘤的光帶分隔或不規則突起上可見血流信號分布。本研究發現卵巢良性腫瘤血流阻力指標 RI明顯高于卵巢漿液性囊腺癌,其中有‘乳頭樣’的結構的 RI值明顯減低,我們可以認為,乳頭生成可作為惡性程度的危險因素之一,而 RI作為獨立預測良惡性腫瘤的指標具有一定的可靠性及可信度。綜上表明彩色多普勒應用于卵巢腫瘤的診斷,可以無創、重復地檢測卵巢腫瘤新生血管,評價腫瘤血管的特征,與術后病理相對照,更細致地了解其組織病理學基礎,為鑒別腫塊的良惡性及有效地預測病情的發展起著極其重要的作用。
[1] Weidner.Ncurrent pathologic methodsn for measuring intra-tumoralmicrovessel density with breast carcinoma and othersolid tumors[J].Breast Cancer Res Treat,1999,(2):169-180
[2] Dalal S,Berry AM.Cullina Ewing’s sarcoma family[J].Clin Cancer Res,2005,11(6):2364-2378
[3] Folkman J.Vascular endothelial growth factor:a therapeutic target for tumors of the tumors are angiogenesis dependent[J].Journal of the National Cancer Institute,1990,82:(1):4-6
[4] Li S,M iner K,Fannin R,et al.Cycloox ygenase-1and-2innormal and malignan thumanovarian epithelium[J].Gynecol Onco,2004,92(2):622-627
[5] Jonathan R,Carter M L,Jeffrey M F,et al.Blood flow characteristics of ovar-ian tumors:implications for ovarian cancer screening[J].AmJ Obstet Gy-necol,1995,172(3):901-907

