抗癌活性肽-S誘導肝癌細胞凋亡及對細胞周期的調控
王朝陽,楊成旺,歐陽曉暉,蘇秀蘭
(內蒙古醫學院附屬醫院,內蒙古呼和浩特 010050)
抗癌活性肽-S誘導肝癌細胞凋亡及對細胞周期的調控
王朝陽,楊成旺,歐陽曉暉,蘇秀蘭*
(內蒙古醫學院附屬醫院,內蒙古呼和浩特 010050)
目的探討抗癌活性肽-S對荷肝癌小鼠腫瘤的抑制作用及其可能機制。方法建立荷肝癌小鼠皮下種植瘤模型,隨機分三組,分別給5-Fu,20 mg/Kg,抗癌活性肽-S 0.4 ml/只,對照組給同體積的生理鹽水,尾靜脈注射,隔日給藥連續10天。10天后處死小鼠,計算重量抑瘤率;取瘤組織制備石蠟切片,原位雜交法檢測瘤細胞VEGFmRNA表達情況并計算瘤組織微血管密度(MVD),免疫組化法檢測瘤組織中Ki67的表達情況;流式細胞儀檢測細胞周期及凋亡。結果抗癌活性肽-S具有較好地抑制肝癌細胞增殖生長及血管生成作用,抑制率為49.43%,且對VEGF m R NA及Ki67表達有較顯著的抑制作用(P<0.01);流式細胞儀分析顯示,抗癌活性肽-S可以阻滯腫瘤細胞停止于S期,促進瘤細胞凋亡。結論抗癌活性肽-S具有抑制肝癌細胞生長增殖的作用,其抗肝癌細胞增殖作用機制為誘導腫瘤細胞凋亡,調控細胞周期。
抗癌活性肽-S;抑瘤作用;肝腫瘤;細胞凋亡
(Chin J Lab Diagn,2010,14:0001)
隨著現代分子生物學,免疫生物學和腫瘤免疫學的飛速發展,生物治療逐漸被人們所重視,已被公認為“腫瘤的第四大治療模式”[1],抗癌活性肽-S(anti-cancer bioactive peptide-S,ACBP-S)來源于動物臟器,是經過對羊誘導后產生的小分子物質。本實驗建立了小鼠荷人肝癌皮下種植模型,采用常規組織病理切片、HE染色、流式細胞術、、原位雜交、免疫組化等技術,分析了抗癌活性肽-S對肝癌細胞增殖的影響及其對腫瘤細胞周期及凋亡的調控作用,以期探討抗癌活性肽-S對荷肝癌小鼠的抑瘤作用及可能的機制。
1 材料與方法
1.1 實驗材料
1.1.1 實驗藥物 抗癌活性肽-S由內蒙古醫學院附屬醫院臨床醫學研究中心分離提取,4℃保存。5-氟尿嘧啶(Fluorouracilum,5-Fu):規格,0.25 g/10 ml,南通制藥總廠生產。
1.1.2 細胞株 肝癌細胞H 22由北京大學腫瘤研究柯楊教授饋贈。
1.1.3 實驗動物 昆明白鼠30只,內蒙古大學動物試驗中心購買。鼠齡為4-5 wk,體重18-22 g,雌雄各半,分籠飼養。
1.2 實驗方法
1.2.1 荷肝癌H-22小白鼠皮下種植瘤模型的建立
復蘇肝癌細胞H-22,離心,收集細胞放入1 ml生理鹽水中混勻,等分兩份,二只昆白鼠腹腔注射,飼養一周后取小鼠腹水制備模型。無菌條件下取小鼠腹水約10 ml,按1∶2稀釋成細胞懸液,每份0.4 ml,細胞計數約在1.9×108細胞/ml,按0.4 ml/只接種于小鼠右腋皮下,建立肝癌模型。接種腫瘤細胞4 h后,將昆白鼠隨機分三組,雌雄各半,按組分為①5-Fu組,20 mg/Kg?d,②ACBP-S 組,0.4 ml/只?天;③生理鹽水對照組,0.4 ml/只?天,以小鼠尾靜脈注射方式給藥。接種瘤細胞12 h后開始給藥,隔日給藥一次,共給藥五次。
1.2.2 標本采集及相關分析 (1)計算荷瘤小白鼠抑瘤率。抑瘤率=[(NS組平均瘤重-治療組平均瘤重)/NS組平均瘤重]×100%。(2)處死荷瘤鼠后30 min內取瘤組織,10%中性甲醛固定后,常規石蠟包埋,切5 μ m切片,HE染色,光學顯微鏡下低倍、高倍觀察。(3)瘤細胞VEGFmRNA表達檢測:采用VEGF原位雜交試劑盒(博士德公司生產)檢測瘤組織VEGF mRNA表達。按試劑盒說明書進行操作。胞漿棕黃色染色為陽性,高倍鏡下計數,陽性細胞百分率作為mRNA表達水平。(4)瘤組織Ki-67抗原表達檢測:按照免疫組化試劑盒說明書進行操作。Ki-67染色信號定位于細胞核,胞核出現深棕色為陽性標記。(5)流式細胞儀檢測瘤組織的細胞周期及細胞凋亡。①細胞周期檢測:經消化、離心、上機,輕輕搖勻上樣管,B.D公司標準Beads校準流式細胞儀,cell quest獲取細胞10 000個,觀察不同組別細胞周期變化。ModFit軟件分析。②Annexin-V-FITC試劑盒檢測凋亡:樣本制備同細胞周期的測定。制備100 μ l細胞懸液分別加入4個5 ml試管中。加熒光染料,輕輕混勻,PI避光,孵育15 min,各管中加400 μ l 1×Binding Buffer,1 h內上機。
1.3 統計學處理 實驗數據應用SPSS 13.0軟件統計,根據實驗資料的要求采用單因素方差分析法統計數據。
2 實驗結果
2.1 抗癌活性肽-S組對H-22荷肝癌小白鼠皮下種植瘤的抑制作用
小鼠尾靜脈注射5-Fu、抗癌活性肽-S均可明顯抑制腫瘤生長,抑瘤率分別是5-Fu組61%,抗癌活性肽-S組49.43%(見表1)。
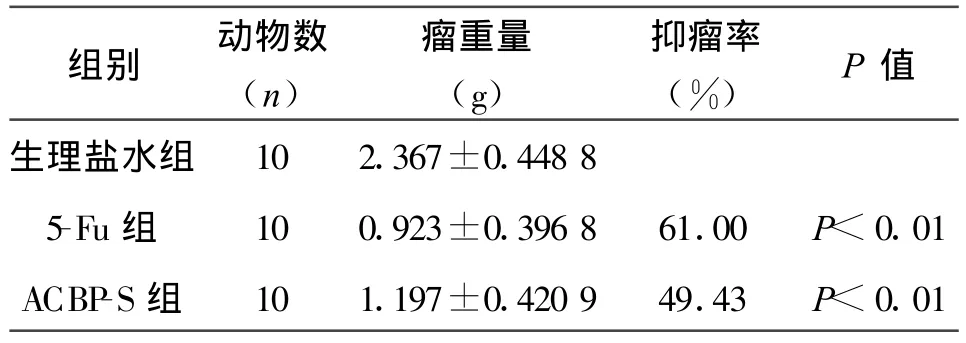
表1 ACBP-S對小鼠H22種植瘤的生長抑制作用
2.2 瘤組織切片光鏡觀察
生理鹽水組細胞呈異質性,核分裂相多,可見較多的血管。抗癌活性肽-S組可見大量壞死細胞,以及灶狀淋巴細胞浸潤,也可見有炎細胞浸潤,并可見較多的核固縮、體積縮小的細胞。
2.3 原位雜交法檢測瘤細胞VEGF mRNA的表達及微血管數分析
實驗中用PBS水代替原位雜交探針做陰性對照實驗,結果表明瘤細胞中無陽性表達,提示本實驗檢測VEGF mRNA是特異性表達。圖像分析系統對各組瘤細胞VEGF mRNA表達進行平均光密度數值統計。顯示其表達以NS組最高,依次是抗癌活性肽-S組、5Fu組(見表2及圖1)。分析結果表明NS組表達最強,而給予抗癌活性肽-S治療后可以使肝癌細胞中VEGFmRNA的表達減弱。

圖1 各實驗組VEGFmRNA表達
各組瘤組織微血管數(MVD)計算。MVD記數參照Maeda[2]方法,計算5個視野內微血管數,取其平均數作為MVD值。結果顯示NS組MVD值最高,5-Fu組及抗癌活性肽-S組明顯低于NS組,有顯著性差異,各組瘤組織MVD平均值見表2。
2.4 免疫組化法檢測瘤組織Ki67表達
計數采用Ki67指數[3],指每個標本低倍鏡(×100)下觀察并確定有代表性的Ki67染色陽性視野,選擇5個視野,即高倍鏡(×400)下每個視野數200個腫瘤細胞,計算其陽性細胞總數。Ki67定位于細胞核,陽性細胞可見細胞核染色為棕褐色或棕黃色,與被蘇木素襯染成藍色的陰性胞核區別明顯。Ki67指數值以NS組、抗癌活性肽-S組、5-Fu組的順序下降。治療組與NS組比較Ki67值均有顯著型差異(見圖 2,表 2)。
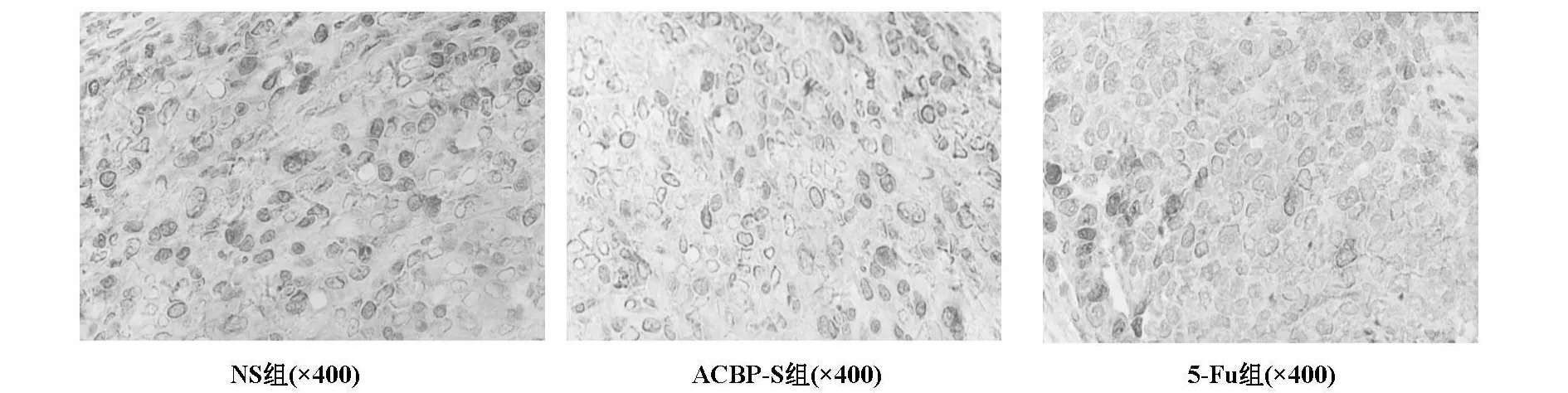
圖2 各實驗組Ki67表達

表2 ACBP-S對 VEGF mRNA、MVD、Ki67表達的影響
2.5 流式細胞術檢測腫瘤細胞周期及凋亡細胞數的變化
抗癌活性肽-S作用后S期比例為40.89%,較NS組14.18%明顯增加;凋亡率抗癌活性肽-S組為8.96%,較NS組2.37%明顯增加。5-Fu組S期比例38.36%也明顯高于NS組,凋亡率是6.95%(見圖3)。凋亡細胞數統計,抗癌活性肽-S組明顯高于NS組,略高于5-Fu組(見圖3及表3、4)。
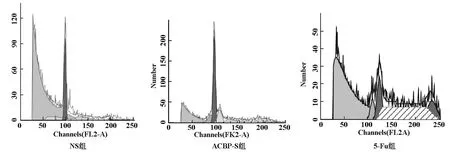
圖3 ACBP-S對細胞周期和凋亡率的影響
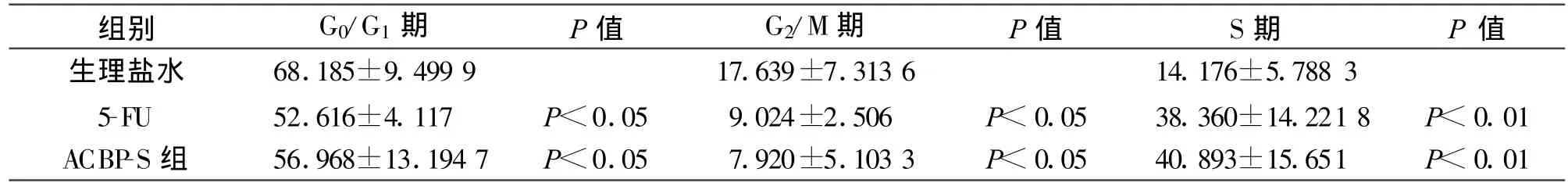
表3 各治療組細胞周期的比較

表4 各組凋亡率及凋亡細胞數比較
3 討論
抗癌生物活性肽-S(已獲得國家發明專利,專利號:ZL96122223610),它來源于經過誘導的動物臟器,是一種新型抗癌生物制劑。前期蘇秀蘭等[4-6]以大量體外細胞實驗和動物體內實驗證明,ACBP-S能夠抑制胃癌、白血病、卵巢癌、膽囊癌等多種腫瘤細胞的DNA合成,誘導腫瘤細胞凋亡和分化,降低腫瘤病人機體血液黏稠度,改善微循環,調節患癌機體無氧糖酵解代謝,提高機體免疫力。ACBP-S對BGC-823細胞的生長有明顯的抑制作用,并可誘導細胞凋亡,其抑癌機制可能與其調控細胞周期有關,使p27mRNA重獲表達,從而發揮抗BGC-823細胞增殖的作用。王玉芳等[7]通過ACBP-S作用于荷胃癌裸鼠后,發現ACBP-S組胃癌移植瘤中PCNA陽性細胞數顯著低于對照組,提示ACBP-S能降低胃癌移植瘤細胞的增殖活性,使之生長速度減慢。而ACBP-S組的腫瘤中caspase-8的表達均升高,提示ACBP-S可能通過促進或誘導caspase-8的活化而激活整個凋亡通路。
肝癌是惡性程度最高的腫瘤之一,高復發且預后差。國內外研究表明肝細胞癌的預后與某些分子指標有關,其中血管內皮生長因子(VEGF)是近年研究的熱點之一[8-12]。在本實驗研究結果中,通過原位雜交法檢測VEGF的表達,統計各實驗組瘤細胞中VEGF表達的平均光密度的值,結果顯示VEGF的表達強弱不同,生理鹽水組最強,各給藥組按肝肽、脾肽、5-Fu的順序減弱。說明5-Fu及活性肽可以抑制腫瘤細胞中VEGF的生成,血管生成的環節受到抑制,抑制腫瘤組織血管的生成,阻斷腫瘤生長所需營養,致使腫瘤細胞緩慢生長,最終抑制腫瘤細胞生長、侵襲、轉移。同時也發現5-Fu存在明顯的毒副作用。5-Fu是現今公認的有效的抗腫瘤藥物,它可以明顯抑制腫瘤細胞生長,其毒副作用導致荷瘤小鼠免疫功能下降,攝入量減少,后期出現體重下降,毛色差等反應。而兩個活性肽給藥組的小鼠一般狀態較5-Fu組好,攝入飲食量無改變,小鼠體重始終在增加,毛色也較好,提示活性肽具有改善荷瘤機體生活質量的作用。
MVD被認為是能反映腫瘤血管生成的一個指標[13],近年來研究證實,許多惡性腫瘤組織中的MVD計數都顯著增高,MVD計數高者易發生轉移和復發,且往往和惡性腫瘤差的預后相關,是一個僅次于淋巴結轉移的獨立預后評估因子。它與腫瘤細胞的營養和供氧有關,是一個反映淋巴結轉移的獨立預后評估因子[14]。本試驗通過原位雜交法檢測腫瘤組織中微血管表達,在腫瘤組織中微血管呈棕色表達,計算微血管數,結果顯示治療組明顯少于生理鹽水組的微血管數,與腫瘤生長呈正相關,說明活性肽可以抑制腫瘤細胞產生VEGF,減少了腫瘤組織中微血管生成,通過血管供給組織的營養減少,抑制腫瘤組織的生長,最終達到抑制腫瘤組織的目的。
Ki-67抗原為細胞核內與細胞分裂增殖相關的蛋白,在細胞周期 S、G1、G2、M 期均有表達,G0 期缺如。由于其半衰期短,有絲分裂后迅速降解,故常作為檢測腫瘤細胞增殖活性可靠的標記[15]。Ki-67反應細胞的增殖活性,其標記指數與有絲分裂指數顯著相關,在肝癌中最高陽性表達率可達95%[16]。本實驗通過圖像分析系統對各組瘤組織中Ki67表達的陽性細胞數統計,結果顯示生理鹽水組瘤組織Ki67指數值最高,治療組按肝肽組、脾肽組、5-Fu組的順序下降。說明生理鹽水組未給予任何抗癌藥物,瘤組織增殖旺盛,增殖細胞較多。抗癌活性肽及5-Fu的作用使瘤組織增殖受到抑制,組織中增殖細胞減少,出現一些凋亡及壞死細胞。兩組活性肽抑制瘤組織增殖的作用較5-Fu組略弱,但Ki67指數與生理鹽水組比較有顯著性差異,提示活性肽抗癌機制之一是通過抑制腫瘤細胞增殖,誘導細胞凋亡及壞死,達到抗腫瘤的治療效果。
Ki67的表達主要受細胞營養供應的影響,而營養供應又與組織的位置和血管生成情況密切相關,淺表部位的MVD常常較高,越靠近瘤體中心的部位的MVD值越低,表現出異質性。實驗中觀察病理切片也看到位于腫瘤邊緣的微血管較多,這可能與建立模型后血管是從周圍組織中長入瘤組織有關。而且檢測Ki67的表達與VEGF mRNA的表達強弱的趨勢是相同的,這也說明瘤組織中血管增生旺盛,通過血管為腫瘤組織提供較多的營養,促進腫瘤細胞增殖旺盛,促進腫瘤組織的發展。當血管生成因子受到抗癌藥物的抑制后,腫瘤細胞營養供應差,瘤細胞的增殖受到抑制,最終起到抑制腫瘤的作用。
現代醫學研究認為,腫瘤的發生發展與細胞的增殖、分化和凋亡失衡有密切關系[17-18]。腫瘤的發生不僅是與細胞增殖速度有關。還與細胞凋亡速度有關。細胞增殖是細胞生命活動的基本表現之一,是一種受到嚴格調控的精確有序過程,腫瘤細胞則表現為調控失常,不受節制地無限繁殖通過影響或調節細胞周期可以抑制腫瘤細胞的增殖,誘導細胞分化或導致細胞死亡。現有的一些抗腫瘤藥物就是通過影響細胞周期而發揮作用的[19-22]。另外,在腫瘤治療過程中,促進腫瘤細胞壞死(對瘤細胞的直接細胞毒作用)和誘導腫瘤細胞凋亡、分化也是藥物治療腫瘤的基本出發點。本實驗結果顯示活性肽組瘤細胞的核分裂相明顯較生理鹽水組減少,腫瘤組織的壞死灶數目增多。并且,抗癌活性肽在促進腫瘤細胞壞死和誘導腫瘤細胞凋亡、分化兩方面同時發揮了抑瘤作用,這一點參照流式細胞儀分析結果得以證實。流式細胞儀細胞周期的測定可以看出,活性肽組S期細胞比例較生理鹽水組明顯增高,G0/G1、G2/M期細胞比例明顯下降,與生理鹽水組比較均有統計學意義,且活性肽組的細胞凋亡率也明顯高于生理鹽水組,凋亡細胞數統計明顯較生理鹽水組高。提示活性肽有阻滯腫瘤細胞停止于S期作用,G0/G1期細胞不斷進入S期,腫瘤細胞阻滯于S期后S期細胞增加,而G0/G1期、G2/M 期細胞減少,并促進腫瘤細胞凋亡。這個結果與實驗中免疫組化Ki67的結果相同,活性肽使G2/M期的瘤細胞減少,分裂增殖的細胞減少,Ki67指數下降,表明活性肽可以阻滯瘤細胞的細胞周期,誘導并促進腫瘤細胞凋亡、分化,抑制腫瘤細胞的增殖,最終起到抗腫瘤的作用。而與對照5-Fu組比較,盡管5-Fu組顯示較好的抑瘤作用,S期細胞數增加,G0/G1、G2/M期細胞減少,也有阻滯腫瘤細胞在S期的作用。但是,小鼠的生活質量顯著下降,包括食欲差、消瘦、活動減少。
綜上所述,抗癌活性肽-S是一種較為有效的提高荷肝癌白鼠免疫功能的生物反應調節劑,可以通過提高機體免疫功能,激發體內的免疫活性細胞,促進腫瘤細胞壞死、誘導腫瘤細胞凋亡、抑制腫瘤細胞增殖,實現整體的抗腫瘤效果。隨著分子腫瘤學和細胞分子生物學技術的進步,抗腫瘤生物活性肽的研究與開發將逐漸引起人們的重視[23],同時將在腫瘤的綜合治療中顯示其較好的應用前景。
[1]嚴律南,主編.肝臟外科[M].北京:人民衛生出版社,2002:448.
[2]Maeda K,Chung YS,Ogawa Y,et al.Prognostic value of vascular endothelial growth factor expression in gastric carcinoma[J].Cancer,1996,77(5):858.
[3]Nolte M,Werner M,Nasarek A,et al.Expression of proliferation associated antigens and detection of numerical chromosome aberrations in primary human liver tumors:relevance to tumor characteristics and prognosis[J].J Clin Pathol,1998,51(1):47.
[4]趙媛媛,彭詩東,蘇秀蘭.抗癌活性肽對鼻咽癌細胞周期的影響[J].中華耳鼻咽喉頭頸外科雜志,2006,41(8):607.
[5]蘇秀蘭,歐陽曉暉,徐桂華,等.抗癌生物活性肽-S對胃癌細胞周期和凋亡的影響[J].中華腫瘤雜志,2008,30(6):422.
[6]徐桂華,蘇秀蘭,申 杰,等.抗癌活性肽對人胃癌BCG-823細胞周期的調控[J].腫瘤防治雜志,2007;14(18):1361.
[7]王玉芳,閆美榮,賈淑芹,等.抗癌生物活性肽對實驗性胃癌PCNA、caspase-8基因表達的影響[J].內蒙古醫學院學報,2009;31(1):6.
[8]羅榮城,韓煥興.腫瘤生物治療學[M].北京:人民衛生出版社,2006:477.
[9]Ferrara N.Vascular endothelial growth factor:basic science and clinical progress[J].Endocr Rev,2004,25(4):581.
[10]Tian X,Cong M,Zhou W,et al.Relationship between protein expression of VEGF-C,MMP-2 and lymph node metastasis in papillary thyroid cancer[J].J Int Med Res,2008,36(4):699.
[11]Chao Y,Li CP,Chau GY,et al.Prognostic significance of vascular endothelial growth factor,basic fibroblast growth factor,and angiogenin in patients with respectable hepatocellular carcinoma after surgery[J].Ann Sung Oncol,2003,10(4):355.
[12]陸 健,卞建民,樊克武,等.肝癌中骨橋蛋白和血管內皮生長因子的表達及臨床意義[J].江蘇醫藥,2006,32(5):418.
[13]Hasan J,Byers R,Jayson GC.Intra-tumoural microvessel density in human solid tumours[J].Br J Cancer 2002;86(10):1566.
[14]Goddard JC,Sutton CD,Furness PN,et al.Microvessel density at presentation predicts subsequent muscle invasion in superficial bladder cancer[J].Clin Cancer Res,2003,9(7):2583.
[15]吳彩虹.Ki67與MMP-9在膽囊癌中的表達[J].世界華人消化雜志,2008,16(14):1585.
[16]Scholzen T,Gerdes J.The Ki-67 protein:from the know and the unknown[J].J Cell Physiol,2000,Mar;182(3):311.
[17]胥 彬,許建華.抗癌藥物與腫瘤化學治療進展[M].北京:科學出版社,2001:98-439.
[18]Su Y,Sun C M,Chuang H H,et al.Studies on the cytotoxic mechanisms of ginkgetin in a human ovarian adenocarcinoma cell line[J].Naunyn Schmiedebergs Arch Pharmacol,2000,362(1):82.
[19]Sausville EA.Cyclin-dependent kinase modulators studied at the NCI:pre-clinical and clinical studies[J].Curr Med Chem Anticancer Agents,2003;3(1):47.
[20]Grant S,Roberts JD.The use of cyclin-dependent kinase inhibitors alone or in combinationwith established cytotoxic drugs in cancer chemotherapy[J].Drug Resist Updat,2003,6(1):15.
[21]Senderowicz AM.Novel direct and indirect cyclin-dependent kinase modulators for the prevention and treatment of human neoplasms[J].Cancer Chemother Pharmacol,2003,52(Suppl 1):S61.
[22]Senderowicz AM.Novel small molecule cyclin-dependent kinases modulators in human clinical trials[J].Cancer Biol Ther,2003,2(4 Suppl 1):S84.
[23]蘇秀蘭.生物活性肽的研究進展[J].內蒙古醫學院學報,2006,28(5):471.
Anti-cancer bioactive peptide-S induced apoptosis of hepatoma cells and cell cycle regulation
WANG Chao-yang,YANG Cheng-wang,OUYANG Xiao-hui,et al.(Clinical Research Center of Affiliated Hospital,Inner Mongolia Medical College,Hohhot010050,China)
ObjectiveTo study the inhibitory effect of anti-cancer bioactive peptide-S(ACBP-S)on the tumor of liver cancer loadedmouse and the possible mechanisim.MethodsEstablished liver cancer loaded mouse mode and divided mice into three groups randomly and gave drugs through tail intravenous injection,the drugs were 5-Fu(20 mg/kg)and ACBP-S 0.4ml per mouse.NS was given to the control group at the same dosed and in the same way.Every other day for 10 days.Then,executed mice after 10 days and calculated weight inhibitory rate.Tumor tissueswere embedded with paraffinwax and made into slices.Detected the expression of VEGFmRNA and calculatedMVD of tumor tissues and the expression of Ki67 proteinwith immune histochemistry,also detecded cell cycle distribution and cell apoptosis rate.ResultsThe ACBP-S could inhibit tumor growth and angiogenesis.The inhibitory rate were individually 49.43%.The expression of VEGF mR NA and ki67 were decreased in ACBP-S groups(P<0.01).ACBP-S could arrest tumor cells atS phase andinduce tumor cellsinto apoptosis.ConclusionACBP-S may obviously inhibit the proliferation of liver cancer cells and induce tumor cells into apoptosis.
ACBP-S;tumor inhibitory effect;liver tumor;cell apoptosis
R735.7
A
1007-4287(2010)01-0001-06
國家自然科學基金(30860327)
*通訊作者,E-mail:xlsu@hotmail.com
2009-08-14)

