60Coγ照射加深低溫保存對大鼠同種帶瓣主肺動脈免疫原性的作用
袁茂昆,黃永高,徐克勁
(泰州市人民醫院心臟外科,江蘇泰州 225300)
60Coγ照射加深低溫保存對大鼠同種帶瓣主肺動脈免疫原性的作用
袁茂昆,黃永高,徐克勁
(泰州市人民醫院心臟外科,江蘇泰州 225300)
目的本實驗應用60Co γ射線照射加液氮深低溫保存大鼠同種帶瓣主肺動脈(Valved pulmonary homograft conduit,VPHC),并建立大鼠VPHC頸總動脈移植模型,觀察不同照射劑量對同種帶瓣主肺動脈免疫原性的作用,尋找合適照射劑量,為進一步基礎研究及臨床應用提供理論依據。方法1月齡雌性Wistar大鼠50只,作為供體,成年雄性SD大鼠50只,作為受體,隨機分為實驗對照組(單純深低溫保存組)、300Gy照射組、600 Gy照射組、900 Gy照射組和 1 200 Gy照射組,另取10只SD大鼠行頸總動脈切斷吻合術,作為空白對照組。應用流式細胞術對VPHC移植術后1周、2周、3周受體鼠外周血行T細胞及T細胞檢測。結果600 Gy照射組VPHC移植術后1周、2周、3周T細胞、T細胞百分率及/與空白對照組相比無顯著性差異(P>0.05),與實驗對照組相比差異顯著(P<0.01)。結論應用600Gy60Coγ射線對VPHC進行照射在保持VPHC活性的同時明顯降低了其免疫原性。
γ射線;深低溫保存;同種帶瓣主肺動脈;免疫原性
(Chin J Lab Diagn,2010,14:0039)
有活性的同種帶瓣管道(Valved homograft conduit,VHC)的耐久性優于其它生物材料,但其遠期鈣化仍是一大難題。據報道其遠期鈣化與VHC移植術后受體慢性排異反應有直接、重要的關系[1,2]。因VHC為弱免疫原性組織[3,4],移植術后主要表現為慢性排斥反應,故對應用免疫抑制藥物和抗CD3、CD4、CD8、CD28和抗細胞因子(IL-2、TNF)及受體(IL-2R)分子的單克隆抗體(mAb)存在很大爭議[5,6]。射線照射一方面可以造成組織損傷,另一方面恰當地利用照射在不嚴重損傷組織活性的條件下通過改變蛋白的空間構象,減少抗原的表達,可望成為一種很有前景的降低移植物免疫原性,進而降低移植術后受體慢性排異反應的有效方法[7,8]。Yokomise等[9]采用60Coγ射線對犬氣管進行照射以減輕其免疫原性,發現經1 000Gy照射加深低溫保存后移植生存狀況優于500 Gy和800Gy的照射劑量,且照射后其組織學僅顯示輕度充血,纖毛上皮及腺體組織未見破壞性改變。本實驗應用60Coγ射線照射及液氮深低溫保存大鼠同種帶瓣主肺動脈,并建立大鼠同種帶瓣主肺動脈頸總動脈移植模型,觀察不同照射劑量對受體鼠外周血及其比值的變化,尋找合適照射劑量,為進一步基礎研究及臨床應用提供依據。
1 材料與方法
1.1 主要實驗儀器
①XTS-4A手術顯微鏡(鎮江光學儀器廠);
②ELITE流式細胞儀(COULTER公司,美國)。
1.2 主要實驗試劑
抗大鼠T細胞亞群單克隆抗體CD系列試劑盒,包括CD4(T輔助/誘導淋巴細胞)、CD8(T抑制/殺傷淋巴細胞)(深圳晶美生物公司)。
1.3 實驗動物及分組
一月齡封閉群Wistar大鼠(吉林大學實驗動物部提供)50只,雌雄不拘,體重80-100克,作為供體鼠,隨機分為5組(n=10),分別為對照組(單純深低溫保存組)、A組(300 Gy照射組)、B組(600Gy照射組)、C組(900 Gy照射組)和D組(1 200 Gy照射組)。成年SD大鼠(中國軍事醫學科學院實驗動物部提供)50只,雄性,體重450-500克,作為受體鼠,隨機分為5組(n=10)。另取10只SD大鼠行頸總動脈切斷吻合術,作為空白對照組(n=10)。
1.4 大鼠VPHC移植模型的建立
參照張晶等[10]的方法。受體鼠應用3%戊巴比妥鈉40 mg/kg腹腔內注射麻醉,仰臥位固定于手術臺板上,頸部剃毛后碘伏消毒。自胸骨上緣至下頜骨下方作頸部正中切口,游離右頸總動脈,經無名靜脈注入肝素2 mg/kg,然后分別在右頸總動脈近端和遠端上血管夾,間隔約10 mm,從中間切斷,取制備好的VPHC,在臺式手術顯微鏡下吻合,均采用等弧度吻合法,所用縫線為9/0無創線。吻合完成后,先去除遠端血管夾,讓血管充盈排氣并觀察有無出血。如有明顯漏血,則需重新上血管夾,加針縫合。如僅為少量滲血,壓迫3-5 min即可止住。間置的VPHC均通暢,止血后切口間斷縫合。
1.5 流式細胞術(Flow cytometry,FCM)
本研究采用美國COULTER公司生產的ELITE流式細胞儀,激光光源為15MW氬離子激光,波長480 nm,用Multi cycle軟件分析處理數據。
應用FCM 檢測CD4、CD8細胞亞群工作流程為:①100 μ l EDTA-2Na抗凝血加入 CD4或CD8mAb 20 μ l,混勻后室溫下避光30 min;②加入10 ml溶血劑,混勻后避光下作用10 min,離心1 000轉/min,棄上清;③沉淀物加入 PBS液,離心 1 500轉/min,棄上清;④沉淀物加入0.6 ml PBS液,待上機檢測。
1.6 統計學方法
實驗結果用SPSS軟件包(9.0版)進行統計學處理,所得數據以均數±標準差(±s)表示,組間比較采用t檢驗。
2 結果
表1 VPHC移植術后受體鼠外周血T細胞百分率(±s,n=10)
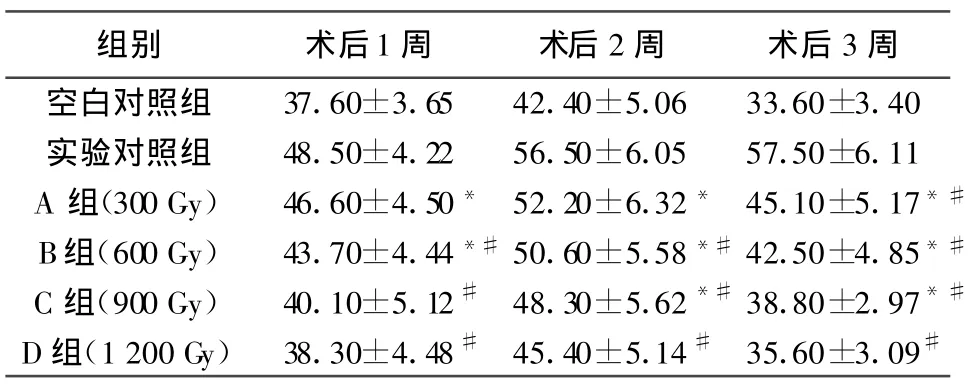
表1 VPHC移植術后受體鼠外周血T細胞百分率(±s,n=10)
注:*與空白對照組相比 P<0.05,#與實驗對照組相比 P<0.05
組別 術后1周 術后2周 術后3周空白對照組 37.60±3.65 42.40±5.06 33.60±3.40實驗對照組 48.50±4.22 56.50±6.05 57.50±6.11 A 組(300 Gy) 46.60±4.50* 52.20±6.32* 45.10±5.17*#B組(600 Gy) 43.70±4.44*#50.60±5.58*#42.50±4.85*#C組(900 Gy) 40.10±5.12# 48.30±5.62*#38.80±2.97*#D組(1 200 Gy) 38.30±4.48# 45.40±5.14# 35.60±3.09#
表2 移植術后受體鼠外周血結果(±s,n=10)
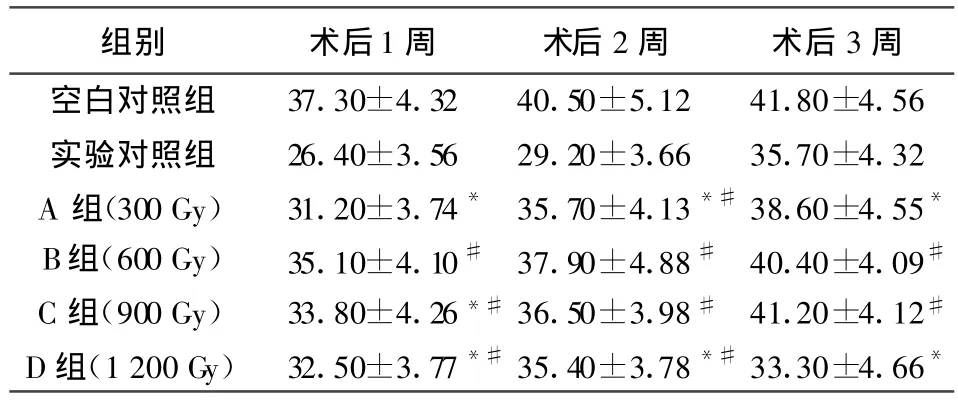
表2 移植術后受體鼠外周血結果(±s,n=10)
注:*與空白對照組相比 P<0.05,#與實驗對照組相比 P<0.05
組別 術后1周 術后2周 術后3周空白對照組 37.30±4.32 40.50±5.12 41.80±4.56實驗對照組 26.40±3.56 29.20±3.66 35.70±4.32 A 組(300 Gy) 31.20±3.74* 35.70±4.13*#38.60±4.55*B組(600 Gy) 35.10±4.10# 37.90±4.88# 40.40±4.09#C組(900 Gy) 33.80±4.26*#36.50±3.98# 41.20±4.12#D組(1 200 Gy) 32.50±3.77*#35.40±3.78*#33.30±4.66*
表3 移植術后受體鼠外周血/CD8+結果(±s,n=10)
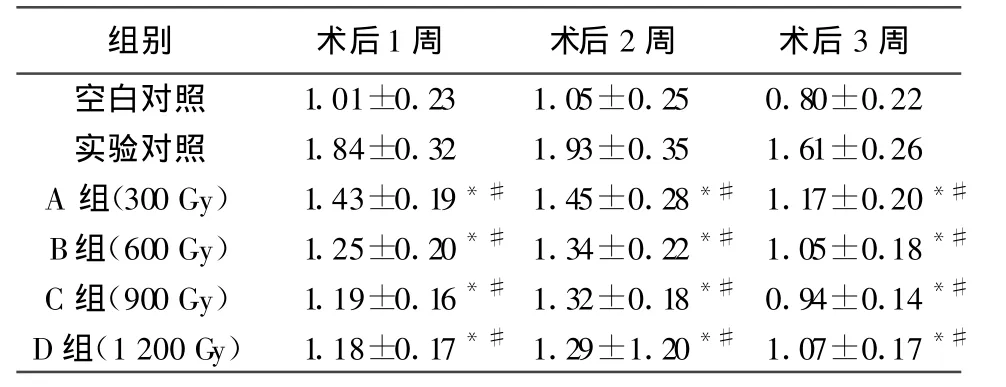
表3 移植術后受體鼠外周血/CD8+結果(±s,n=10)
注:*與空白對照組相比 P<0.01,#與實驗對照組相比 P<0.01
組別 術后1周 術后2周 術后3周空白對照 1.01±0.23 1.05±0.25 0.80±0.22實驗對照 1.84±0.32 1.93±0.35 1.61±0.26 A 組(300 Gy) 1.43±0.19*#1.45±0.28*#1.17±0.20*#B組(600 Gy) 1.25±0.20*#1.34±0.22*#1.05±0.18*#C組(900 Gy) 1.19±0.16*#1.32±0.18*#0.94±0.14*#D組(1 200 Gy) 1.18±0.17*#1.29±1.20*#1.07±0.17*#
3 討論
同種帶瓣管道植入后的退行性變與免疫排斥的關系越來越為人們所關注。近年來許多作者的實驗都有力地證實,同種帶瓣管道移植后出現免疫排斥反應[11,12]。多數學者認為,同種帶瓣管道的退行性變與免疫有直接、重要的關系[13,14]。在同種異體器官移植的研究中普遍認為細胞介導的移植排斥反應是由于移植物HLAⅡ類抗原刺激受體T細胞,使其激活、增殖、分化并分泌許多細胞因子[15]。臨床研究證明,VHC移植術后激發宿主產生免疫反應,外來抗原激活宿主T淋巴細胞使其增殖、分化,并產生IL-2和干擾素(IFN)γ等細胞因子而激活的CD8+T淋巴細胞積聚于移植物局部對移植物具有殺傷性作用,使得T淋巴細胞在血中所占比例減少,CD4+/CD8+比值增高[16]。因而通過檢測受體血CD4+和CD8+及二者比值的動態變化對判斷VHC移植術后排斥反應的強度有重要意義。本研究結果顯示,隨著照射劑量的增加外周血T淋巴細胞百分率明顯減少,B、C、D組與實驗對照組相比有顯著性差異(P<0.05);而外周血T淋巴細胞百分率明顯增加,A、B、C、D組與實驗對照組相比均有顯著性差異(P<0.05);/比值A、B、C、D組與實驗對照組相比均有顯著性差異(P<0.01)。可見60Coγ照射可能通過減弱MHC抗原的表達,抑制宿主T淋巴細胞增殖、分化和產生IL-2、IFN-γ等細胞因子,有效地降低VPHC移植術后宿主產生免疫排斥反應,隨著照射劑量的增加,同種帶瓣主肺動脈抗原表達量減少,因而受體鼠外周血CD4+T淋巴細胞百分率逐漸減少,而外周血T淋巴細胞百分率逐漸增加。結合我們前期實驗結果[17],可以推斷600 Gy60Coγ照射在不嚴重損傷VPHC活性的同時明顯地降低了VPHC移植術后免疫排斥反應的發生,可作為參考劑量用于降低VPHC免疫原性的研究。
[1]O'Brien FM,Stafford EG,GardnerMA,et al.A comparison of aortic valve replacement with viable cryopreserved and fresh allograft valves,with a note on chromosomal studies[J].J Thorac Cardiovasc Surg,1987,94(6):812.
[2]Shaddy RE,Huter DD,Osbor KA,et al.Prospective analysis of HLA immunologicity of cryopreserved valved allografts used in pediatric heart surgery[J].Circulation,1996,94(5):1064.
[3]Gonzalez-Lavin L,Bianchi J,Graf D,et al.Degenerative changes in fresh aortic root homografts in a canine model:evidence of an immunological influence[J].Transplant Proc,1998,20(suppl):819.
[4]Hoekstra F,KnoopC,Vaessen L,et al.Donor-specific cellular immune response against human cardiac valve allografts[J].J Thorac Cardiovasc Surg,1996,112(2):281.
[5]陳 艱,楊長勇,于建華,等.同種帶瓣主肺動脈移植應用免疫抑制治療的實驗研究[J].中華胸心血管外科雜志,2001,17(4):232.
[6]陳 艱,于建華,李守先.雷公藤在大鼠同種異體帶瓣主動脈移植中的免疫移植作用[J].山東中醫藥大學學報,2000,24(3):223.
[7]Azuma H,Ikebuchi K,Yamaguchi M,et al.Comparison of sensitivity to ultraviolet B irradiattion between human lymphocytes and hematopoietic stem cells[J].Blood,2000,96(7):2632.
[8]Murase N,Ye Q,Nalesnik MA,et al.Immunomodulation for intestinal transplantation by allograft irradiation,adjunct donor bone marrow infusion,or both[J].Transplantation,2000,70(11):1632.
[9]Yokomise H,Inui K,Wada H,et al.High-dose irradiation prevents rejection of canine tracheal allografts[J].J Thorac Cardiovasc Surg,1994,107(6):1391.
[10]張 晶,劉迎龍.兔頸動脈移植同種主動脈帶瓣血管模型的建立[J].中華實驗外科雜志,2000,17(6):268.
[11]Motomura N,Jmakita M,Yutani C,et al.Histologic modification by cryopreservation in rat aortic allograft[J].Ann Thorac Surg,1995,60:s168.
[12]Shapma OM,Fonger JD,Reardon K,et al.Unexplained fever after aortic valve replacement with cryopreserved homografts[J].Ann Thorac Surg,1995,60:s127.
[13]Smith JD,Ogino H,Hunt D,et al.Humoral immune response to human aortic valve homografts[J].Ann Thorac Surg,1995,60:s127.
[14]Shady RE,Huter DD,Osber KA,et al.Propective analysis of HLA immunologicity of cryopreserved valved allografts used in prdiatric heart surgery[J].Circulation,1996,94:1064.
[15]Lechler RI Batchelor JR.Restoration of immunogenicity to passenger cell-depleted kidney allografts by the addition of donorstrain dendritic cells[J].J Exp Med,1982,155(1):31.
[16]薛 蓮,張培華.大鼠同種異體股動脈移植后的免疫學研究[J].中華實驗外科雜志,1996,13(5):300.
[17]袁茂昆,趙洪序,張秀和.大劑量60Coγ照射加液氮深低溫保存對大鼠同種帶瓣主肺動脈活性的影響[J].中國實驗診斷學,2003,7(2):123.
Immunogenicity in Rat Conduit Pulmonary Valved Homograft with60Co Gamma Irradiation and Cryopreservation
YUAN Mao-kun,HUANG Yong-gao,XU Ke-jin.(Department of Cardiac Surgery,Taizhou Peoples Hospital,Jiangsu,Taizhou063000,China)
ObjectiveTo determine the suitable dosage of60Co γray to be used prior to cryopreservationin order to reduce the immunogenicity of CPVH.Methodsfifty one-month old female Wistar ratswere used as donors andwere divided into five groups(n=10).Fifty SD adult ratswere used as recipients andwere divided into five groups respectively(n=10).Four experimental groups were irradiatedwith60Coγray of different dosages prior to cryopreservation;300 Gy group,600 Gy group,900 Gy group,1 200 Gy group.The experimental control group
cryopreservation only.And tenSD rats underwent right carotid artery end-to-end anastomosiswere used as a control group.Flow Cytometry was used to test,T-cells in peripheral blood of recipient rats at weekly interval of 1,2,3 weeks postoperatively.ResultsThere was no significant difference between 600 Gy group and the control group in percentages of,T-cells.ConclusionThe dosage of 600 Gy60Coγray irradiation prior to cryopreservation would be the optimal dosage for reducing immunogenicity of the VPHC in rats.
γray;Cryopreservation;Valved pulmonary homograft conduit;Immunogenicity
R543;R815.5
A
1007-4287(2010)01-0039-03
袁茂昆(1965-),男,博士,科主任,主任醫師,研究方向:同種帶瓣管道。
2009-06-19)

