鄰苯二甲酸酯對淺層含水層沉積物微生物多樣性的影響
吳 瓊,劉 慧,張 丹,施霞珍 (中國地質大學(武漢),生物地質與環境地質教育部重點實驗室,湖北 武漢430074)
鄰苯二甲酸酯對淺層含水層沉積物微生物多樣性的影響
吳 瓊,劉 慧*,張 丹,施霞珍 (中國地質大學(武漢),生物地質與環境地質教育部重點實驗室,湖北 武漢430074)
在模擬淺層地下水低溫、缺氧的環境條件下,利用BIOLOG ECO微平板法研究了經不同濃度鄰苯二甲酸正丁酯(DBP)處理的江漢平原淺層含水層沉積物中微生物的數量、整體活性、多樣性指數以及代謝功能多樣性.結果表明,微生物的數量、整體活性隨DBP濃度不同有差異;豐富度指數、Shannon指數與對照相比差異均不顯著,而Simpson指數和McIntosh指數差異顯著.低濃度DBP(<400mg/kg)可以抑制部分微生物的生長,而促進與DBP代謝有關的微生物活性;高濃度DBP(796mg/kg)則抑制了微生物數量,破壞物種的均一度,最終導致沉積物中微生物功能多樣性發生改變而產生代謝變異性.
鄰苯二甲酸正丁酯(DBP);淺層含水層;微生物多樣性;BIOLOG
Abstract:Impact of di-n-butyl phthalate (DBP), an endocrine-disrupting chemical, on microbial community diversities and activities in shallow aquifer sediments in Jianghan plain were investigated in batch cultures via BIOLOGECO microplates. Sediments were amended with different concentrations of DBP varied from 0 to 796mg/kg and incubated under a condition of hypothermia-hypoxia which was commonly found in subsurface aquifer. Average well colour development (AWCD) was measured with mircosation biolog periodically. It was observed that the microbial populations and activities varied with DBP concentrations. With the variation of DBP concentrations no obvious difference was detected among the richness (R) and Shannon’s index (H), while remarkable differences was found among the Simpson’s indices and McIntosh’s indices of the control and sediments amended with DBP (P<0.05). The microbial activity which might potentially related to DBP degradation was enhanced by DBP with low concentration (<400mg/kg). However, with higher concentrations, (≥796mg/kg), DBP grossly inhibited microbial growth and metabolism as manifested by the reduction in microbial count, and destabilized the natural balance of microbial communities.
Key words:di-n-butyl phthalate (DBP);shallow aquifer;microbial diversity;BIOLOG
地下水通常溫度較低,營養物質缺乏,微生物種類和數量少[1].鄰苯二甲酸酯類化合物(PAEs)是一類環境內分泌干擾物.研究表明,PAEs廣泛存在于地下水中[2-5].然而,關于PAEs在地下水環境中能否被微生物降解以及其對地下水環境介質中的微生物多樣性有何影響至今還缺乏足夠的研究.本研究以江漢平原第四系淺層含水層沉積物為研究對象,在模擬淺層地下水低溫缺氧的環境條件下采用BIOLOG ECO微平板法測定了該沉積物中微生物種群對鄰苯二甲酸正丁酯(DBP)污染的響應,旨在揭示DBP在淺層含水層環境中對微生物生長及多樣性的影響,為地下水的保護和污染修復提供理論依據.
1 材料與方法
1.1材料
供試的含水層沉積物樣品取自武漢市蔡甸區奓山鎮檀樹村(30°28′19″N/113°59′13″E),采樣點深度為地下2.2m,樣品顏色為灰褐色,有較軟結塊.樣品pH值為6.80,含水率22.17%,有機碳含量5.9g/kg.采集的沉積物樣品盛裝于不銹鋼鍋中,密封,置于4℃冰箱中保存,一周內開展實驗.
DBP購于天津市恒興試劑制造有限公司,分析純.
1.2實驗設計
稱取5份相當于25g 烘干樣品的新鮮沉積物樣品于100mL小口玻璃瓶中,分別加入0,2.4,5, 10,19mg DBP和25mL無菌去離子水,使沉積物樣品中DBP含量分別為0,96,200,400,796mg/kg.聚四氟乙烯材料封口后在18℃下振蕩8h (200r/min),然后在供氧受限條件下(圖1)18℃避光靜置培養,并在不同時間內取樣測定微生物數量及其多樣性的變化.
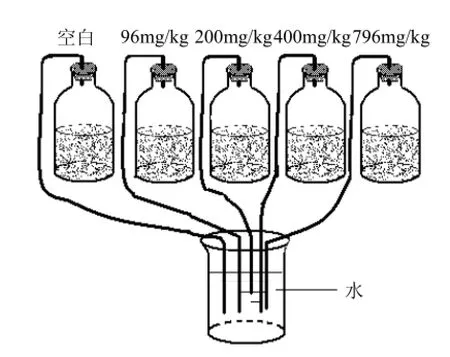
圖1 微生物富集培養示意Fig.1 The schematic diagram of microbial enrichment
1.3微生物的計數
培養13d后,將樣品瓶從恒溫培養箱中取出,在18℃下搖30min(200r/min).靜置2min后分別取上層1mL,用無菌磷酸緩沖液(0.145mol/L, pH7.0)稀釋,搖勻,冰浴1min得到1:10的提取液,同理逐級稀釋得到1:100、1:1000的提取液.分別將提取液涂布于牛肉膏蛋白胨培養基平板,在(30±1)℃下培養18h,紀錄并計算微生物的數量.
1.4BIOLOG測試
將BIOLOG ECO板(Biolog Inc., Hayward, CA, USA)從4℃的冰箱中取出,預熱到25℃.將1:1000提取液接種到ECO板上,接種量為150 μL,每樣一板(3次重復),將接種好的ECO板加蓋在供氧受限條件下(堿性焦性沒食子酸法[6]) (30± 1)℃下培養21d,并分別于0,24,48,72,96,120,144, 168,192,240,312,384,456,504h在Microstation-Biolog板讀數儀(BIO-TEK Instruments INC,USA)上測定吸光度,測定波長分別為590,750nm.測試在生物地質與環境地質教育部重點實驗室地微生物實驗室完成.
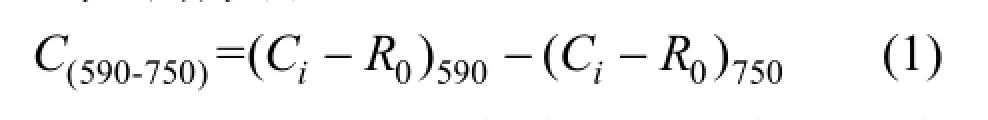
ECO板的96個單孔顏色值計算采用Classen等[7]的方法.式中: Ci為BIOLOG ECO板各反應孔在相應波下的光密度值(OD);R0為對照孔的在相應波長下的OD,其中數值小于0.06時按0處理[7];
平均吸光值(AWCD)的計算按照Garland等的方法[8].式中: 31為BIOLOG ECO板上供試碳源的種類數.
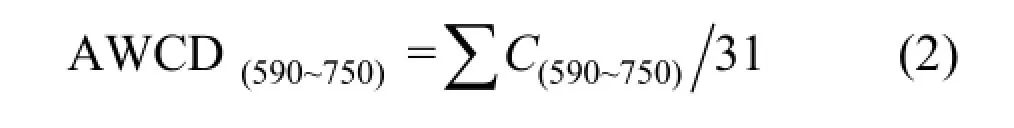
1.5多樣性指數應用模型
根據數據篩選原則[9-11],本實驗采用培養時間為312h時的數據來評價微生物多樣性.根據相關文獻[12-13]計算Shannon指數、Simpson指數 和McIntosh指數.其中在計算Simpson指數時,數據擴大了1000倍以防止出現負數.
1.6數據處理方法
所有數據采用Microsoft Excel 2003、Origin 8.0處理.
2 結果與討論
2.1DBP對含水層沉積物中微生物數量的影響
方差分析表明,不同濃度DBP處理的沉積物樣品中微生物數量彼此之間差異極顯著(P<0.01).由圖2可見,低濃度(96,200mg/kg)和高濃度(796mg/kg)的DBP使沉積物中微生物數量均低于對照,而400mg/kg的DBP使微生物數量增加.該結果表明,DBP的加入可能抑制了沉積物中某些微生物的活性,但促進了另外一些與DBP代謝有關的微生物活性,如以DBP為碳源的微生物和與其產生共代謝過程的微生物.在一定濃度范圍內(96~400mg/kg)該類微生物隨著DBP濃度的增加數量增多,在400mg/kg時達最大值.當DBP濃度高達796mg/kg時,DBP對該類或其中部分微生物產生毒副作用,致使微生物數量急劇下降[14].
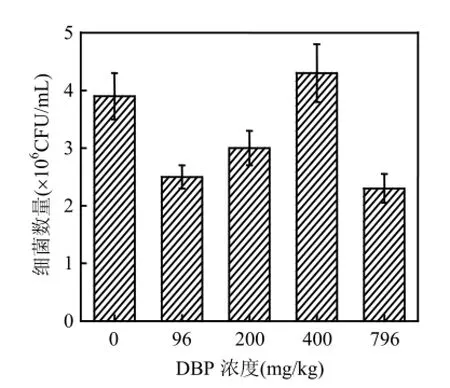
圖2 培養13d后不同DBP濃度處理下淺層含水層沉積物中細菌數量Fig.2 Bacterial counts of shallow aquifer sediments amended with different concentrations of DBP after 13 d incubation
2.2DBP對微生物整體活性的影響
由圖3可知,不同濃度DBP處理的淺層含水層沉積物中微生物群落AWCD值在整個培養期間差異比較明顯.在0~196h之間,DBP處理過的沉積物中微生物的AWCD均高于對照.196h至培養結束(504h),796 mg/kg DBP處理的微生物的AWCD均最低,其他3個濃度下AWCD值隨濃度增大而增大,且依次高于對照.該結果表明,一定濃度范圍內的DBP(≤400mg/kg)使沉積物整體微生物的活性增強,而高濃度的DBP (796mg/kg)則抑制了整體微生物的活性.
Garland等[8,15]認為土壤微生物群落ELISA速度和最終能達到的程度與群落能利用單一碳底物的微生物數目和種類有關,因此對照和不同濃度DBP處理的沉積物中微生物群落組成上可能是不同的.陳中云等[16]研究了多種內分泌干擾物如多菌靈、丁草胺、呋喃丹等對土壤微生物的活性影響,結果表明同一種內分泌干擾物在低濃度時刺激了某種微生物的活性,濃度過高時則對該微生物具有明顯的抑制作用.
本研究中低濃度的DBP(96,200mg/kg)雖減少了整體微生物的數量,但卻增強了整體微生物的活性,說明DBP刺激了其中某些微生物的活性,而高濃度的DBP(796mg/kg)則抑制了該類微生物的活性.
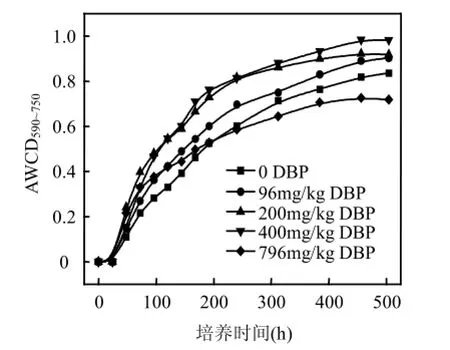
圖3 淺層含水層沉積物中微生物群落溫育過程中AWCD的變化Fig.3 AWCD changes of microbial communities in shallow aquifer sediments with incubation time
2.3DBP對微生物群落多樣性指數的影響
2.3.1豐富度和Shannon指數 顏色變化的孔數即微生物對BIOLOG ECO板上31種底物碳源利用數(S)通常被作為土壤微生物群落功能多樣性的豐富度(R)[10,15,17],用于表征微生物群落對底物利用的廣泛性和差異性.Shannon指數、Simpson指數和McIntosh指數分別反應微生物群落功能多樣性的不同側面.Shannon指數是研究群落內部物種數量、個體數量和分布均勻程度的綜合指標,受群落物種豐富度影響較大, Simpson指數較多反映了群落中最常見的物種[13].McIntosh指數則是群落物種均一性的度量[18].
在整個實驗過程中,不同濃度DBP對沉積物中微生物的R值和Shannon指數影響都不顯著,但均存在先增后減的趨勢,最高點處在200mg/kg (圖4).該結果表明,沉積物中微生物種類在200~400mg/kg時最豐富.
2.3.2Simpson指數和McIntosh指數 方差分析得出不同濃度DBP對沉積物中微生物Simpson指數和McIntosh指數造成了顯著的影響(圖5).200mg/kg DBP作用下,微生物群落的Simpson指數較對照顯著增高(P<0.05),之后隨DBP濃度的增強該指數下降,表明沉積物中最常見的微生物種類隨DBP濃度的增加有先增加后減少的趨勢,DBP為200mg/kg時種類最多. McIntosh指數衡量的主要是物種的均一程度.隨著DBP濃度的增加,McIntosh指數也呈現先增加后降低的趨勢,而最高點為DBP濃度為400mg/kg時.
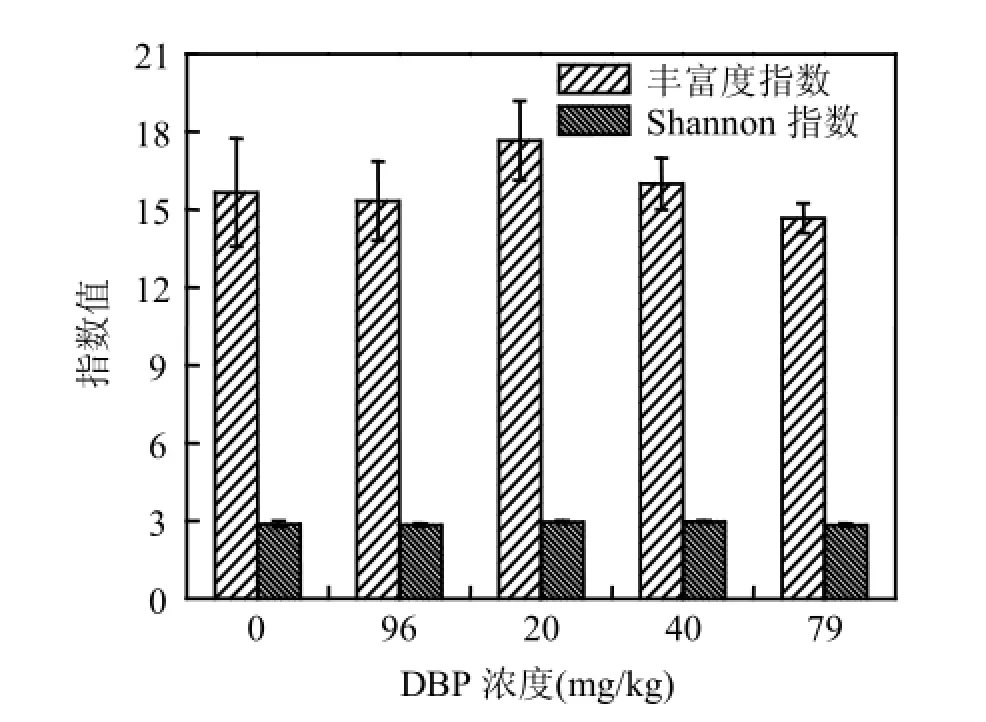
圖4 溫育312h后不同濃度DBP處理的淺層含水層沉積物中微生物群落豐富度指數和Shannon指數Fig.4 Richness indices and Shannon’s indices of microbial communities in the shallow aquifer sediments amended with different concentrations of DBP after 312h incubation
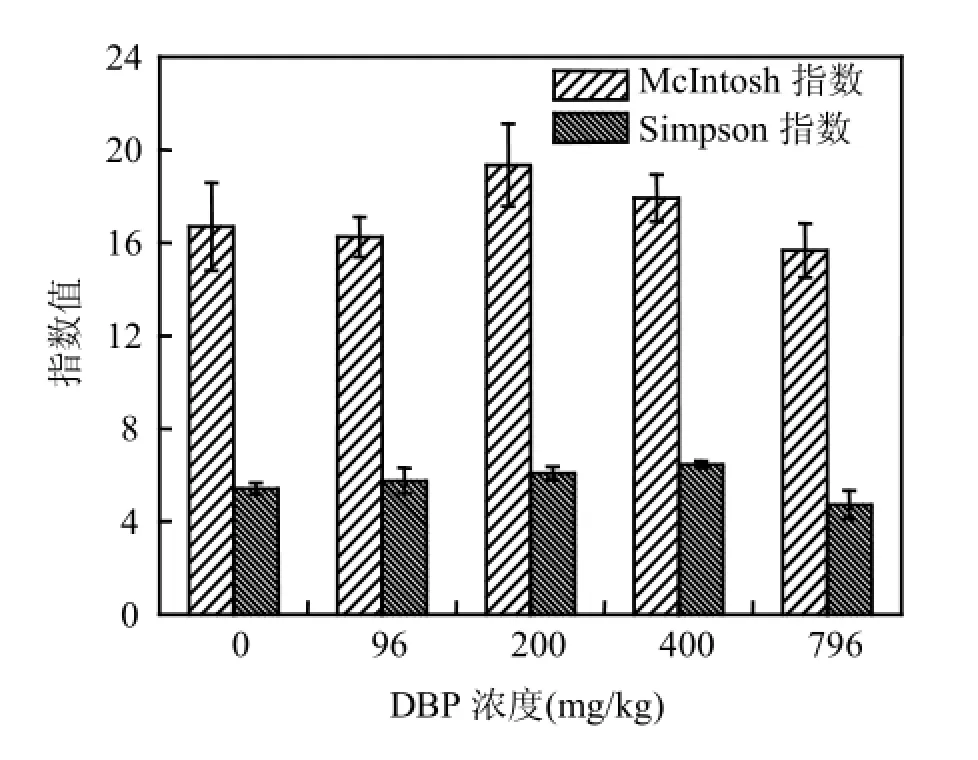
圖5 溫育312h后不同濃度DBP處理的淺層含水層沉積物中微生物群落Simpson指數和McIntosh指數Fig.5 Simpson’s indices and McIntosh’s indices of the microbial communities in shallow aquifer sediments amended with different concentrations of DBP after 312h incubation
綜上所述,在低濃度的DBP范圍內(0~200mg/kg),沉積物中最常見微生物的種類隨著DBP濃度的增加而增多,至DBP 200mg/kg時最常見物種數目達到最多.之后,微生物的種類隨DBP濃度的增加而減少.同時,與DBP代謝有關的微生物活性隨著DBP濃度的增加而增強,致使群落的均一程度在DBP濃度達400mg/kg時開始下降,至濃度為796mg/kg時沉積物中與DBP代謝有關的微生物所占比例最大.
2.4DBP對微生物群落功能代謝多樣性的影響在研究微生物群落功能多樣性上,BIOLOG技術是一個很有效的方法[19].BIOLOG ECO微平板上含有31種碳源,其中聚合物類4種,碳水化合物類7種,羧酸類9種,氨基酸類6種,胺類2種,其它化合物類3種[12,20].圖6為育溫312h后不同處理沉積物中微生物對六大類碳源的相對利用率.
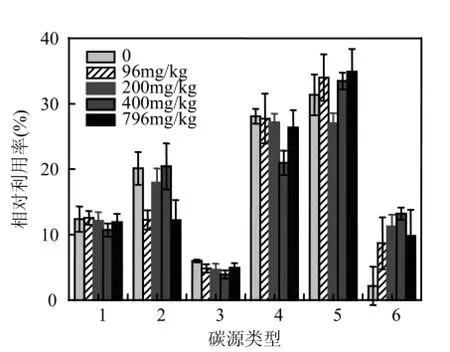
圖6 不同濃度DBP處理的淺層含水層沉積物中微生物群落對BIOLOG ECO板中六類碳源的相對利用率Fig.6 Relative utilization efficiencies of 6 kinds of carbon sources in BIOLOG ECO micro plate by the microbial communities in shallow aquifer sediment amendedwith different concentrations of DBP
由圖6可知,不同處理樣品中的微生物對羧酸類和氨基酸類的利用程度均較高,對其他化合物的利用程度較低.外源DBP對微生物利用聚合物的影響較小,但顯著促進了微生物對胺類的利用(促進倍數n>4).在400mg/kg DBP處理下,微生物對氨基酸類的利用程度最大,對羧酸類利用程度明顯下降.該結果表明,外源DBP導致沉積物中微生物群落代謝功能產生了變化.
相關研究表明,土壤微生物群落組成及其多樣性受一系列因素的影響,如有機碳質含量、養分輸入、土壤類型、污染物等環境擾動因子[21-25].
土壤有機質含量直接影響土壤中能利用復雜有機質為營養物質的微生物種群數量及其代謝活性,有機質含量高,土壤微生物的種群和數量相對較高.由于供試含水層沉積物樣品中有機質含量低,微生物較表層土壤數量小,一定量DBP的加入一方面為某些可以利用DBP的微生物提供了碳源,參與微生物的呼吸作用;另一方面,也會影響到與該類微生物產生共代謝作用的微生物的數量.因此,DBP會影響微生物的功能多樣性.
3 結論
3.1DBP抑制了沉積物中某些微生物的生長繁殖,使其數量與活性下降,同時也促進了與DBP代謝有關的微生物的生長與活性,這類微生物在400mg/kg DBP時活性最強,當濃度更高時會對其產生毒副作用并導致其數量急劇下降.
3.2沉積物中微生物的豐富度、最常見微生物的種類和數量、物種的均一度均隨DBP濃度的增加出現先增加后降低的趨勢,DBP濃度為200~400mg/kg時微生物種類最豐富.
3.3在濃度96~796mg/kg,DBP導致微生物群落代謝功能產生了變化.
[1] Haveman S A, Pedersen K. Distribution of culturable microorganisms in Fennoscandian Shield groundwater [J]. FEMS Microbiology Ecology, 2002,39:129-137.
[2] Zeng F, Cui K, Xie Z, et al. Distribution of phthalate esters in urban soils of subtropical city, Guangzhou, China [J]. Journal of Hazardous Materials, 2009,164:1171-1178.
[3] Bauer M J, Herrmann R, Martin A, et al. Chemodynamics, transport behaviour and treatment of phthalic acid esters in municipal landfill leachates [J]. Water Science and Technology, 1998,38:185-192.
[4] Zhang D, Liu H, Liang Y, et al. Distribution of phthalate esters in the groundwater of Jianghan plain, Hubei, China [J]. Frontiers of Earth Science in China, 2009,3:73-79.
[5] Zheng Z, He P-J, Shao L-M, et al. Phthalic acid esters in dissolved fractions of landfill leachates [J]. Water Research, 2007, 41:4696-4702.
[6] 沈 萍,范秀榮,李廣武.微生物學實驗 [M]. 北京:高等教育出版社, 2006:77-79.
[7] Classen A T, Boyle S I, Haskins K E, et al. Community-level physiological profiles of bacteria and fungi: Plate type and incubation temperature influences on contrasting soils [J]. Microbiology ecology, 2003,44:319-328.
[8] Garland J L, Mills A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization [J]. Applied and Environmental Microbiology, 1991,57:2351-2359.
[9] O'Connell S, Lawson R D, Watwood M E, et al. BASIC program for reduction of data from community-level physiological profiling using Biolog microplates: rationale and critical interpretation of data [J]. Journal of Microbiological Methods, 2000,40:213-220.
[10] Zak J C, Willig M R, Moorhead D L, et al. Functional diversity of microbial communities: A quantitative approach [J]. Soil Biology and Biochemistry, 1994,26:1101-1108.
[11] 楊永華,姚 健,華曉梅.農藥污染對土壤微生物群落功能多樣性的影響 [J]. 微生物學雜志, 2000,20:23-25.
[12] Wang G H, Liu J J, Qi X N, et al. Effects of fertilization on bacterial community structure and function in a black soil of Dehui region estimated by Biolog and PCR-DGGE methods [J]. Acta Ecologica Sinica, 2008,28:220-226.
[13] Magurran A E. Ecological diversity and its measurement [M]. Princeton: Princeton University Press, 1988:141-162.
[14] Chao W L, Lin C M, Shiung I I, et al. Degradation of di-butyl-phthalate by soil bacteria [J]. Chemosphere, 2006,63: 1377-1383.
[15] Garland J L. Analysis and interpretation of community-level physiological profiles in microbial ecology [J]. FEMS Microbiology Ecology, 1997,24:289-300.
[16] 陳中云,閔 航,張夫道,等.農藥污染對水稻田土壤硫酸鹽還原菌種群數量及其活性影響的研究 [J]. 土壤學報, 2004,41: 97-102.
[17] Harch B D, Correll R L, Meech W, et al. Using the Gini coefficient with BIOLOG substrate utilisation data to provide an alternative quantitative measure for comparing bacterial soil communities [J]. Journal of Microbiological Methods, 1997, 30:91-101.
[18] Atlas R M. Diversity of microbial community [J]. Advanced Microbiology Ecology, 1984,7:19-47.
[19] Xue D, Yao H-Y, Ge D-Y, et al. Soil microbial community structure in diverse land use systems: a comparative study using Biolog, DGGE, and PLFA analyses [J]. Pedosphere, 2008,18: 653-663.
[20] Preston-Mafham J, Boddy L, Randerson P F. Analysis of microbial community functional diversity using sole-carbonsource utilisation profiles - a critique [J]. FEMS Microbiology Ecology, 2002,42:1-14.
[21] Kong W-D, Zhu Y-G, Fu B-J, et al. Effect of long-term application of chemical fertilizers on microbial biomass and functional diversity of a black soil [J]. Pedosphere, 2008,18:801-808.
[22] He J-Z. Molecular bacterial diversity of a forest soil under residue management regimes in subtropical Australia [J]. FEMS Microbiology Ecology, 2006,55:38-47.
[23] Bending G D, Turner M K, Jones J E. Interactions between crop residue and soil organic matter quality and the functional diversity of soil microbial communities [J]. Soil Biology and Biochemistry, 2002,34:1073-1082.
[24] Renella G, Mench M, van der Lelie D, et al. Hydrolase activity, microbial biomass and community structure in long-term Cd-contaminated soils [J]. Soil Biology and Biochemistry, 2004, 36:443-451.
[25] Johnson M J, Lee K Y, Scow K M. DNA fingerprinting reveals links among agricultural crops, soil properties, and the composition of soil microbial communities [J]. Geoderma, 2003, 114:279-303.
致謝:在本研究論文撰寫過程中,得到了地微生物實驗室王紅梅教授的悉心指導;另外在實驗測試過程中,得到了環境學院研究生趙銳同學的幫助,在此一并表示感謝.
Effect of di-n-butyl phthalate (DBP) on the microbial diversity in shallow aquifer sediment.
WU Qiong, LIU Hui*, ZHANG Dan, SHI Xia-zhen (Key Laboratory of Biogeology and Environmental Geology, Ministry of Education, China University of Geosciences, Wuhan 430074, China). China Environmental Science, 2010,30(5):671~676
X172
A
1000-6923(2010)05-0671-06
吳 瓊(1987-),女,湖北十堰人,中國地質大學(武漢)生物地質與環境地質教育部重點實驗室碩士研究生,從事有機污染化學及微生物學研究.
2009-09-25
國家自然科學基金資助項目(40602038,40811120027)
* 責任作者, 副教授, zliuhui@hotmail.com

