鋯-氚反應熱力學特性
黃 剛龍興貴 彭述明 梁建華 楊本福
(中國工程物理研究院核物理與化學研究所,綿陽 621900)
鋯-氚反應熱力學特性
黃 剛*龍興貴 彭述明 梁建華 楊本福
(中國工程物理研究院核物理與化學研究所,綿陽 621900)
鋯;氚;p-c-T曲線;熱力學參數
利用金屬氫化物可以方便地對氫同位素氕、氘、氚進行泵輸、轉移、固態吸附貯存、功能薄膜制造等。目前應用較成熟的有鈾[1]、鈦[2]、鋯鈷合金[3]等材料。鋯與鈦是屬于同一族的金屬元素,也是一種吸氫密度很高的功能材料,目前國內外已有較多關于氫在鋯中固溶[4]、擴散[5-6]等方面的報道,但有關鋯吸氚性能方面的報道較少。為了將鋯應用于貯存氘和氚,有必要研究鋯與氘和氚作用的各種物理化學特性。在鋯-氘反應性能研究[7]的基礎上,本工作進行了鋯吸、放氚的實驗,對其熱力學特性進行了研究。
1 實驗部分
1.1 實驗裝置
實驗裝置為無油高真空金屬測試系統[7]。該系統由真空系統 (系統的極限真空為10-6Pa)、加熱系統(電阻絲電爐和控溫裝置(控溫精度為±1℃))、氣體引入系統 (1只貯氘鈾床、1只貯氚鈾床和1只回收廢氚用鈾床)和測量系統(電離真空計(量程為10-8~10-1Pa)、薄膜壓力測量儀(量程為 0~133 kPa))等組成。
1.2 實驗方法
1.2.1 試樣準備
(1)將純度為99.99%的鋯經機加工成 Φ 10 mm×1 mm的小圓片,質量約為400 mg。未經處理的鋯樣品表面呈現暗灰色。實驗用氚純度為98%,貯存于金屬鈾床中。
(2)將樣品放入氫氧化鈉溶液中煮沸約15 min,邊煮邊攪拌以防止暴沸。該流程重復2次以保證表面油污清洗完全,清洗完畢后用自來水沖洗,再放入氫氟酸稀溶液中反應,以除去表面的氧化層,可以看到,樣品表面很快變成黑色,這時需要往溶液中滴入少量的硝酸和硫酸溶液,樣品表面的黑色覆層才能被反應溶解,樣品表面逐漸變成明亮的銀白色。反應完全的樣品用蒸餾水清洗干凈,晾干后放入真空室貯存待用。
(3)將鋯樣品裝入系統的樣品室中,進行系統抽真空。分步啟動機械泵、分子泵抽真空,當真空度達到5 mPa后加熱升溫,電爐加熱電壓為30 V,升溫溫度設定為700℃。當樣品溫度升至700℃后,將溫度保持在在此溫度約1 h,待系統的真空度達到1 mPa后停止加熱,將樣品冷卻至室溫。
(4)樣品除氣后,加熱氚化鈾床放出一定量氚氣,加熱樣品使之升溫吸氣;吸收一定量氚氣后,將樣品加熱到700℃以上,使氚解吸,用鈾床回收解吸的氣體。如此反復數次,使鋯樣品在室溫即能快速吸氣即可。
1.2.2 吸氚壓力-組成等溫線(p-c-T 曲線)測定
將樣品恒溫在某個預定溫度,采用分步吸氣平衡法[7]放出一定量氚氣讓鋯吸收,記錄相應的壓力數據,由公式(1)計算每次氚的增量:
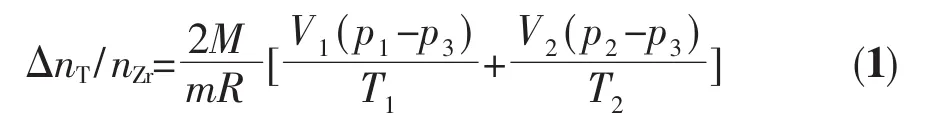
式中:ΔnT/nZr為吸氣增量與鋯金屬的原子比;M為鋯的相對原子質量;m為樣品的質量,g;R為氣體常數,8.314 J·mol-1·K-1;p1,p,p3為管道初始壓力、樣品室初始壓力和反應平衡壓力,Pa;V1為管道體積,554 mL;V2為樣品室體積,219 mL;T1為管道溫度,為室溫,K;T2為樣品室溫度,K。
將第i次計算所得值ΔnT/nZri與前幾次計算值累加,并與對應的平衡壓力p3在p-c-T曲線上可作得第i個點,將所有的點連接起來,即可得鋯在某一溫度的p-c-T曲線。
1.2.3 鋯解吸氚p-c-T曲線測定
將接近飽和的樣品溫度恒定,記錄吸氚平衡壓力。關閉樣品室閥門,用鈾床回收管道里的氣體后抽真空,然后再打開樣品室閥門,讓鋯解吸氚,記錄平衡壓力,計算鋯氚原子比。如此循環,即可測得鋯解吸氚p-c-T曲線。
2 結果與討論
2.1 活化性能
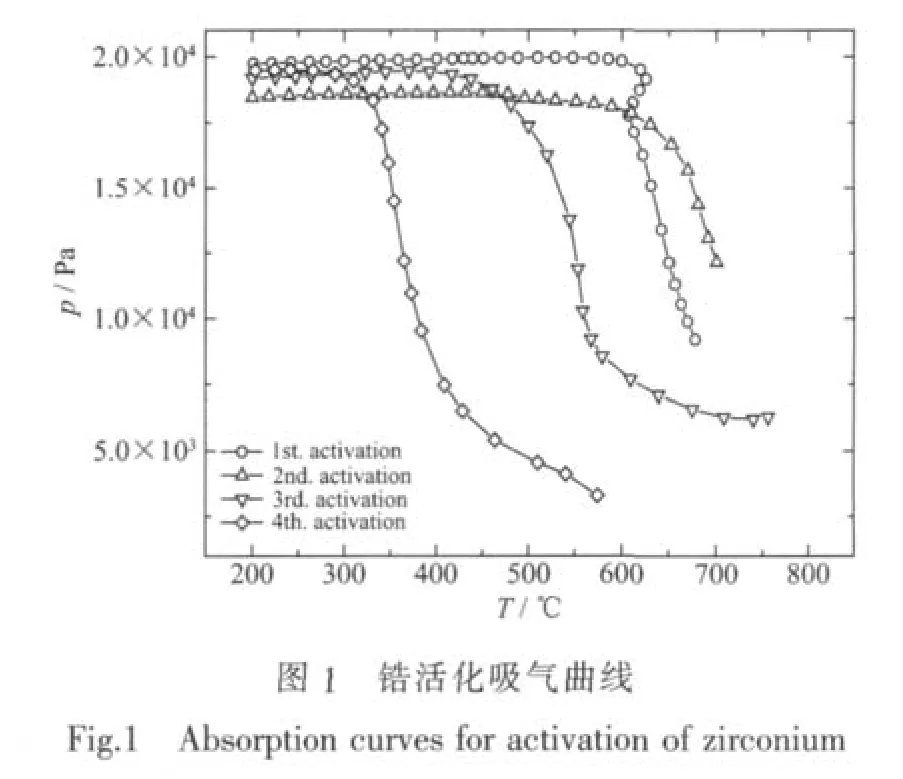
從圖1的曲線可以看出,鋯在第1次吸氣活化時,直到540℃才開始緩慢吸氣,到650℃時才出現明顯的吸氣過程;第2次活化時,雖然在460℃時就出現緩慢吸氣過程,但也是在600℃左右才出現明顯吸氣;第3次活化時,吸氣溫度明顯降低,350℃開始吸氣,速度也明顯比前兩次加快;到第4次活化時,270℃已能快速吸氣。可見,鋯金屬較易活化,吸氣時速度也很快。
2.2 鋯吸氚的p-c-T曲線
鋯吸氚的p-c-T曲線結果示于圖2。由圖2可知:鋯在低于500℃的溫度范圍內,其吸氚p-c-T曲線只存在一個平臺,且平衡壓較低。由氫鋯體系相圖[8]可知,在450~500℃的溫度區間,氫化鋯在氫濃度較低范圍內時為六方密堆積(hcp結構)的α金屬相區,隨著氫濃度增加,α相逐漸轉變為δ相,當氫鋯原子比達到1.5左右以后完全形成面心立方的單一δ相,圖2中450~500℃的p-c-T曲線僅有的一個平臺就對應于鋯氚化物的α+δ雙相區。

在圖2中600~700℃的高溫區域,鋯的吸氚曲線出現了2個平臺,把曲線粗略分成了5個區域,如圖2中數字所示,表明在此溫度范圍內,鋯氫相平衡變得較復雜,隨著氫濃度的增加,鋯由最初的α相轉變為β相,β相又逐漸轉變為δ相,在這個相變過程中,鋯氫化物物相共存在五種不同的組合形式,分別是α 相、α+β 相、β相、β+δ相和 δ相,圖 2 中的5個區域,分別對應于上述5個相區,其中平臺區是相轉變過程中的雙相共存區。從圖可以看出,600~700℃時鋯吸氚p-c-T曲線的第一平臺的坪區很窄,從氚鋯原子比約0.1開始,僅有約0.1原子比的寬度,且平臺有一定的斜率,表明鋯在吸收少量的氚達到臨界值之后,鋯晶格原子發生重排,從hcp結構的α相快速轉變為bcc結構的β相。曲線的第二平臺較為平坦,且隨著溫度的升高向高原子比方向移動,但其坪區寬度基本不變。
2.3 鋯吸氚容量
由圖2中鋯在475℃吸氚的p-c-T曲線可知,氚化鋯在原子比接近1.3的時候其平臺區基本結束,相結構轉化為單一的δ相,鋯吸氚平衡壓開始快速上升,鋯的吸氚容量達到了1.89,加上用氚活化時鋯本身對氚的滯留量,其吸氚總量非常接近于鋯吸氫的理論值2.0,所以,鋯對氚的容留能力與鈦相似,且在相同溫度下其平衡壓力比鈦更低,很適合用作貯氚材料。
2.4 吸氚平衡壓與溫度的關系
在平臺區,鋯吸氚的吸氣平衡壓與溫度的關系示于圖3。圖3所示結果表明:在平臺區,lnp與1/T呈良好的線性關系,對圖中實驗點進行線性擬合就可根據范德荷夫方程計算鋯吸氚在不同物相時的熱力學參數ΔH?、ΔS?,結果列于表1。由表1可知,鋯吸氚在形成不同的相組成時有不同的標準焓變和標準熵變。
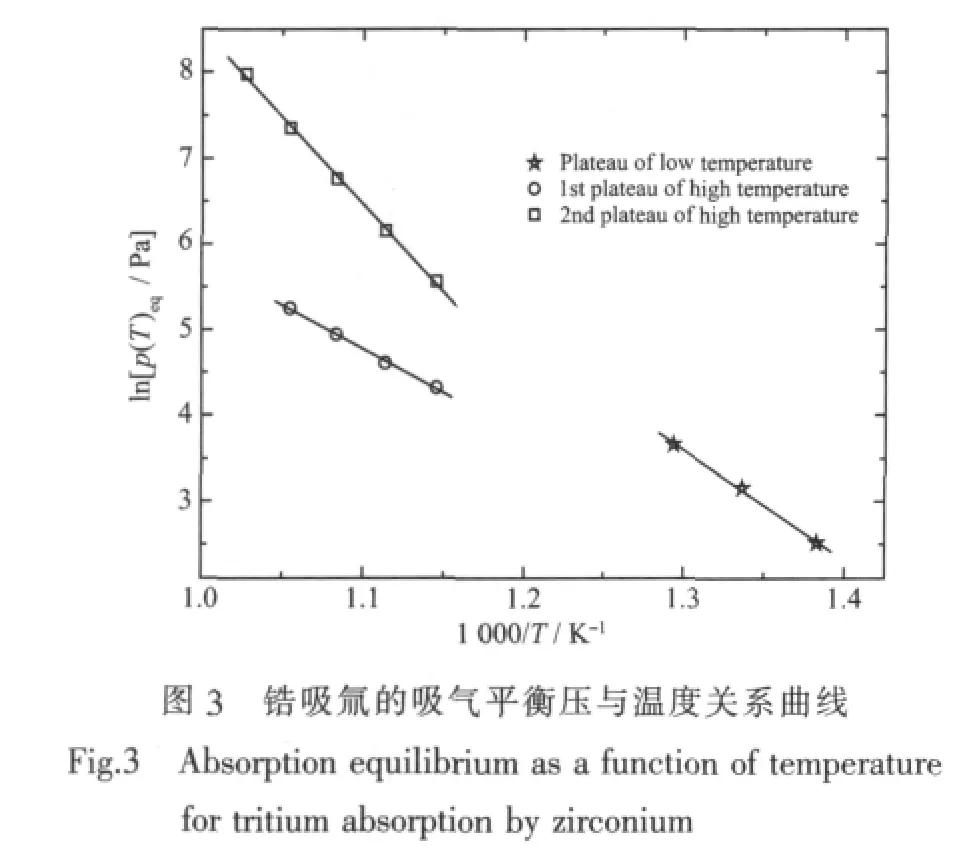
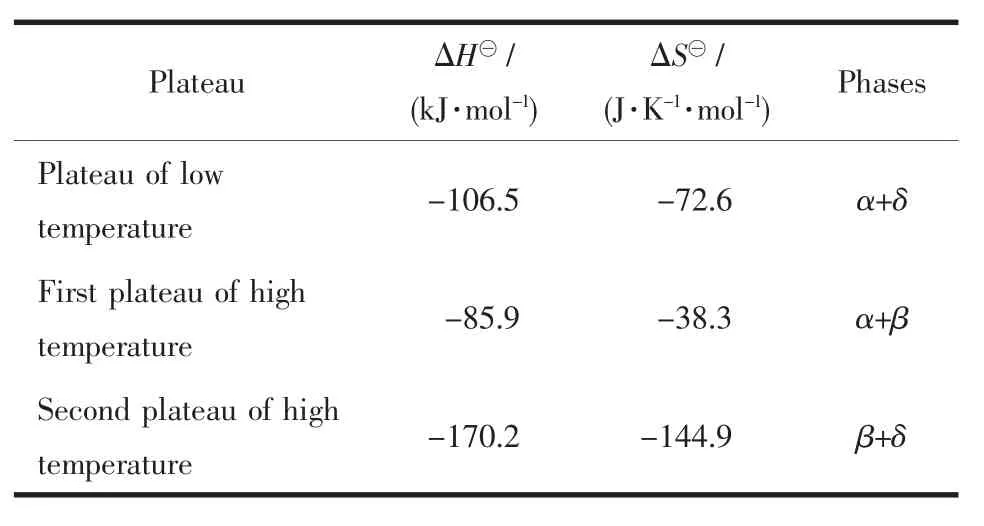
表1 鋯吸氚氚化反應的熱力學參數Table 1 Thermodynamic parameters of zirconium tritide
鋯氫平衡相圖顯示,在溫度低于500℃的區域范圍內,氚化鋯基本上都處于α+δ雙相區,升降溫過程不會引起物相結構和熱力學性能的變化,所以,由范德荷夫方程和表1中低溫平臺的熱力學參數計算得到鋯在20℃的吸氚平衡壓力約為1.0×10-10Pa,由此可見,鋯在吸收氚氣冷卻至室溫以后,其平衡壓非常低,很適合用作特種真空器件的氚貯存材料。
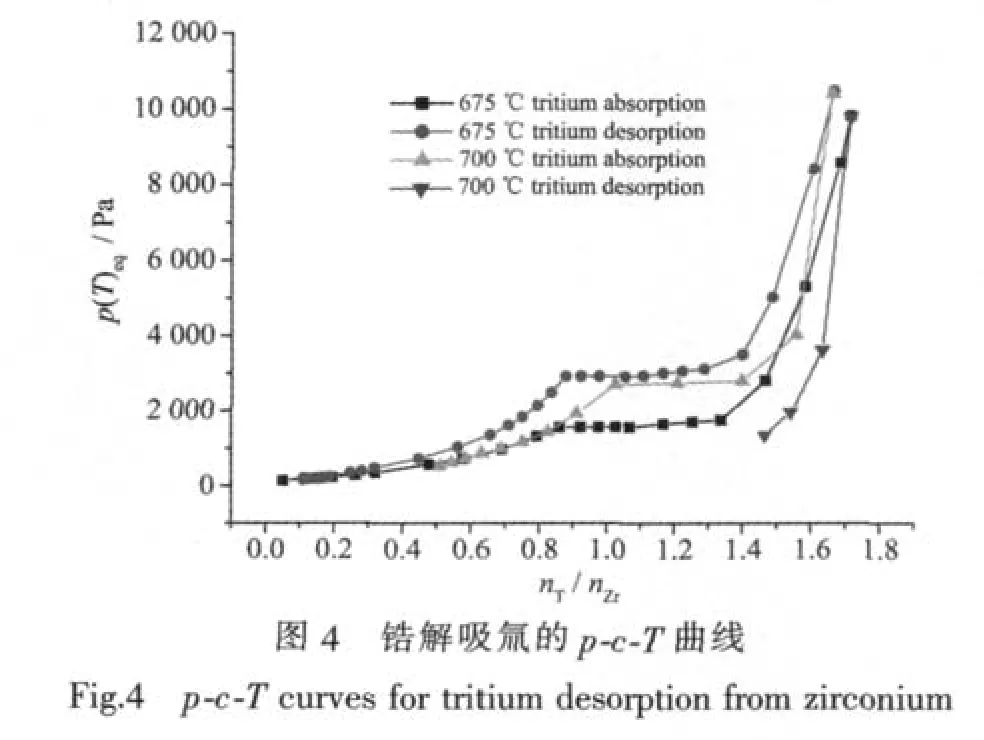
2.5 鋯解吸氚p-c-T曲線與滯后效應
鋯在675和700℃解吸氚的p-c-T曲線示于圖4。為了便于比較,將其吸氣曲線也一并放在其中。由圖4可以看出:鋯解吸氚的p-c-T曲線與吸氣pc-T曲線的趨勢基本一致,也有相應的平臺,但在相同的T/Zr原子比時,解吸平衡壓力比吸氣平衡壓力低,吸、放氚這一逆過程中存在明顯的滯后效應,說明鋯吸氚以后很穩定,不易釋放出氚氣來。
[1]Li R,Sun Y,Wei Y J,et al.Fusion Eng.Des.,2006,81:859-862
[2]Daigo S,Junji M,Hiroaki M,et al.J.Alloy Compd.,2004,381:215-220
[3]Masanori H,Toshio O,Katsunori M,et al.Fusion Eng.Des.,2000,49-50:831-838
[4]Shinsuke Y,Daigo S,Hiroaki M,et al.J.Alloys Compd.,2004,372:129-135
[5]Wipf H,Kappesser B,Werner R.J.Alloys Compd.,2000,310:190-195
[6]Pletnev R N,Kupryazhkin A Y,Dmitriev A V,et al.J.Struct.Chem.,2002,43(3):445-448
[7]HUANG Gang(黃 剛),LONG Xing-Gui(龍興貴),YANG Ben-Fu(楊本福),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2008,24(12):2056-2059
[8]Thaddeus B,Hiroaki O,Subramanian P R,et al.Binary Alloy Phase Diagrams.2nd Ed.Ohio:ASM International,1992.
Thermodynamic Characteristics of Zirconium-Tritium Reaction
HUANG Gang*LONG Xing-GuiPENG Shu-Ming LIANG Jian-HuaYANG Ben-Fu
(Institute of Nuclear Physics and Chemistry,China Academy of Engineering Physics,Mianyang,Sichuan 621900)
The p-c-T curves and the relation between equilibrium pressure and temperature of tritium absorption and desorption from zirconium were measured in the temperature range of 450~700 ℃.There are different changes of enthalpy and entropy when zirconium changes to different phases.The change of enthalpy in the phase of α plus δ is-106.5 kJ·mol-1in the temperature range of 450~500 ℃,the changes of enthalpy in the first and second plateau are-85.9 and-170.2 kJ·mol-1,respectively,in the temperature range of 600~700 ℃.The corresponding changes of entropy are-72.6,-38.3 and-144.9 J·K-1·mol-1,respectively.There are obvious lagging effects when zirconium desorbs tritium.
zirconium;tritium;p-c-T curve;thermodynamic parameters
O614.41+2;O613.1;O642.1
A
1001-4861(2010)09-1707-04
2010-04-26。收修改稿日期:2010-06-23。
國家自然科學基金(No.50871106)資助項目。
*通訊聯系人。E-mail:yunerfei80@yahoo.com.cn
黃 剛,男,30歲,碩士,助研;研究方向:氚化學與氚工藝。

