成肌細胞移植改善心肌梗死大鼠心功能的機制
馬牧欣 哈爾濱醫科大學附屬第一醫院心內四科 150001
成肌細胞移植改善心肌梗死大鼠心功能的機制
馬牧欣 哈爾濱醫科大學附屬第一醫院心內四科 150001
目的:研究心肌梗死大鼠骨骼肌成肌細胞移植后心功能變化情況,同時觀察移植后的成肌細胞的存活及P2X1受體的表達情況。探討骨骼肌成肌細胞移植對大鼠心肌梗死后心功能的改善作用的機制。方法:以同種系Wister大鼠為研究對象,取其股四頭肌肌組織,采用膠原酶、鏈酶蛋白酶兩步消化法獲取大鼠骨骼肌成肌細胞進行體外培養。取同種系Wister大鼠30只隨機分為2組(對照組和移植組)采用結扎冠狀動脈的方法制造心梗模型,模型建立一周后再次開胸分別以分點注射法于心臟梗死區輸入細胞培養液(對照組)或成肌細胞懸液(移植組)。于建模前、成肌細胞移植術前及移植術后第一、二周行超聲心動檢測。處死動物后,進行普通HE染色,抗myosin、抗P2X1受體免疫組化染色。結果:超聲顯示骨骼肌成肌細胞移植后二周,大鼠心臟功能較移植前有明顯改善,其中射血分數由(40.3±2.5)%增加到(52.1± 2.3)%且與對照組相比有顯著差異(P﹤0.05)。普通HE染色發現,移植組的心梗區域可見紅色的條索狀團塊。抗myosin染色證實有移植的細胞存在。抗P2X1受體染色陽性。結論:骨骼肌成肌細胞移植后能在大鼠體內存活,移植二周后對心肌梗死后心功能降低即有明顯的改善作用,這可能與P2X1受體對細胞間連接的調節及其介導的正性肌力作用有關。
骨骼肌成肌細胞;心肌梗死;細胞移植;P2X1受體;縫隙連接
骨骼肌成肌細胞(skeletal myoblast)是一種位于肌纖維的肌膜與基底膜之間的組織干細胞,在適當條件下可分化成有收縮能力的肌細胞。自上個世紀九十年代起,科學家們就開始了成肌細胞移植治療心肌梗死的研究,證實處于心臟微環境中的成肌細胞趨向于向心肌細胞分化,減緩心梗后心臟射血分數的降低,增強疤痕區的收縮功能。Dowell[1]等進一步的研究也證明盡管缺乏成肌細胞和心肌細胞間形成有效連接的證據,但移植對左心收縮功能的改善是明顯而持續的,且與移植細胞的數量呈正相關。那么,移植的骨骼肌成肌細胞到底是通過什么機制改善心功能的,它和心肌細胞間究竟能否形成有效的電生理連接,二者之間的矛盾使電機械偶聯的研究又成為近來的熱點,其中以心室肌細胞縫隙連接的主要連接蛋白43(connexin 43)的研究居多。
心肌細胞之間的縫隙連接傳導可通過ATP與connexin之間的特異性配體-受體相互作用進行調節。近來有報道P2X1受體(ATP受體的亞型之一)與Cx43密切相關[2]。本試驗主要研究成肌細胞移植入大鼠心肌梗死區后心功能的改善情況及是否有P2X1受體的表達,初步探討P2X1受體在成肌細胞移植改善心梗后左心功能中的可能機制。
一、材料與方法
1 大鼠骨骼肌成肌細胞的提取、純化、培養及鑒定
選用成年Wistar大鼠,體重150~180g雌雄不限,無菌條件下切取股四頭肌1g,PBS沖洗后剔除脂肪組織,剪成1~2mm3的小塊后PBS漂洗2次,37℃水浴搖床中酶解30~50min(膠原酶IA,1.0mg/ml),加PBS終止消化,漂洗2次,1000r/min離心5min,棄上清,繼之加入1%鏈酶蛋白酶于37℃水浴箱中消化20~30min,加培養液終止消化,400目不銹鋼篩網過濾,1000r/min,5min離心,棄上清后加2ml細胞增殖培養液(含20% FBS的Ham’s F10)制成細胞懸液,緩緩加入含20%/60%percoll的10ml離心管中,800r/min離心15分鐘。吸取中層液面入10ml離心管中,PBS漂洗3次,沉淀用4ml增殖培養液重懸,吸入T25塑料培養瓶,放入細胞培養箱中培養(37℃,5%CO2)。接種密度為1~3×105/ml。
2 大鼠心梗模型的建立
取成年wistar大鼠,體重200~230g,雌雄不限,隨機分為2組(實驗組及對照組),每組15只。10%水合氯醛麻醉(3ml/ kg,ip)后,16G靜脈留置針直視下氣管插管,確認進入氣管后,右側臥位,接呼吸機(參數:volum模式,呼吸頻率50/ min,潮氣量10cc/kg)。于心臟搏動最強處,多為第4肋間開胸,暴露心臟后用開胸器撐開肋骨良好顯露術野。用5/0帶線縫合針在左心耳與肺動脈圓錐之間平左心耳下緣迅速縫扎左前降支近端,結扎即刻見左室前降支供血區域變白即為結扎確切。膨肺后關胸,縫合皮膚。縫合前傷口局部撒硫酸慶大霉素預防感染。手術后大鼠約30min完全清醒。
3 骨骼肌成肌細胞及培養液的回輸
第二代成肌細胞生長至80%~90%密度時,用0.25%胰酶+0.02%EDTA消化,細胞計數板計數細胞個數,并進行臺盼藍染色計算活細胞占95%以上。Ham’s F10漂洗3次以洗去殘余血清。用Ham’s F10制成濃度為2~3×107/ ml的細胞懸液,放入冰盒內以備移植用。心梗1周后的大鼠,10%水合氯醛麻醉(3ml/kg,ip)后,16G靜脈留置針直視下氣管插管,確認進入氣管后,仰臥位,接呼吸機(參數:volum模式,呼吸頻率50/min,潮氣量10cc/ kg)。取左側胸骨旁縱切口,剪斷第2~4肋骨后,剪開胸膜,暴露心臟后用開胸器撐開切口良好顯露術野。眼科鑷小心剝離心臟與周圍胸壁粘聯組織,暴露心肌梗死區,可見梗死區心肌變白,表面有纖維素附著。吸管吹勻離心管中的細胞懸液,用1mlBD針吸取100微升細胞懸液,分5點斜刺入梗死區,每點注入25微升細胞懸液,觀察5min后,膨肺關胸,縫合皮膚。縫合前傷口局部撒硫酸慶大霉素預防感染。手術后大鼠約40min后完全清醒。
4 記錄數據
4.1 超聲心動檢測
以超聲心動儀(HP)檢測大鼠心功能。所有指標均取五個連續心動周期的平均值。試驗鼠的心率、心室射血分數、左室短軸縮短率的測定以鑒定心臟功能狀況,并將各組測量值進行比較。用SPSS10.0統計學軟件進行統計學分析,所有數據均以均數±標準差即 ±s表示,組間比較應用t檢驗,以P﹤0.05作為差異有顯著意義。
4.2 病理檢測
取原代細胞及3代細胞消化后進行細胞爬片,待長至80%~90%密度時用4%多聚甲醛固定,以備免疫組化檢測成肌細胞特異性抗體myosin及desmin之用。
大鼠心梗兩周,采集數據后,將試驗大鼠處死,心肌組織送檢病理,進行常規HE染色,抗myosin、抗P2X1受體免疫組化染色。
二、結果
1 大鼠骨骼肌成肌細胞的培養
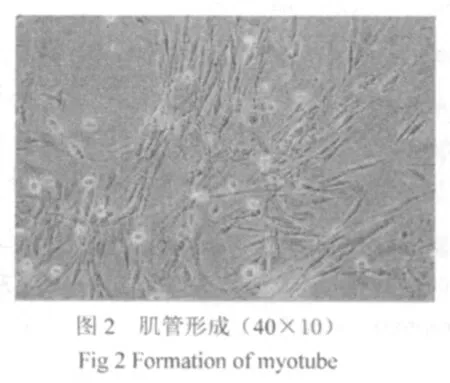
分離的原代骨骼肌成肌細胞成球形,折光性強。培養2小時后細胞開始貼壁,24小時后貼壁完全,細胞逐漸延展成梭形或紡錘形(圖1),隨培養時間的延長,細胞增殖、遷移并逐漸規律性地沿一個方向平行排列。當細胞融合到80%以上后,不需分化培養基即可自發性地相互融合,形成肌管(圖2)。為避免成肌細胞融合形成肌管,待細胞長成80 %密度時即進行傳代。傳代細胞30min即開始貼壁,12小時貼壁完全,增值速度較原代細胞明顯加快,平均7天傳代一次。免疫組織化學染色顯示desmin及myosin在成肌細胞及肌管中均為陽性(圖3、4,未著色的為混雜的成纖維細胞)。



2 大鼠心梗模型的建立及細胞回輸
共2只大鼠死亡,均為實驗組大鼠,死亡率6.6%。死亡原因,一只為術中出現室顫,另一只為二次開胸時組織粘連,胸腔出血。結扎前降支后,肉眼可見結扎遠端心肌顏色變淺,主要局限在左心室,靠近心尖部較為明顯(圖5)。正常和缺血交界處充血,顏色發紺。心梗1周后二次開胸,可見梗死區心肌變白,表面有纖維素附著(圖6)。進一步證實大鼠心肌梗死模型建立成功。



?
3 心功能測定
超聲心動檢測心率、射血分數短軸縮短率等各指標顯示,心梗建立前各組各檢測指標間無明顯差異;心梗建立后1周,細胞及培養液移植前各檢測指標較組內心梗前有明顯差異,組間差異無統計學意義;反映心臟收縮功能的EF%和FS%于移植后2周明顯增高,且移植細胞組明顯高于移植后1周檢測值和對照組檢測值;對照組在移植后不同時間點測量值無顯著性差異(表1)。
4 HE染色及免疫組化
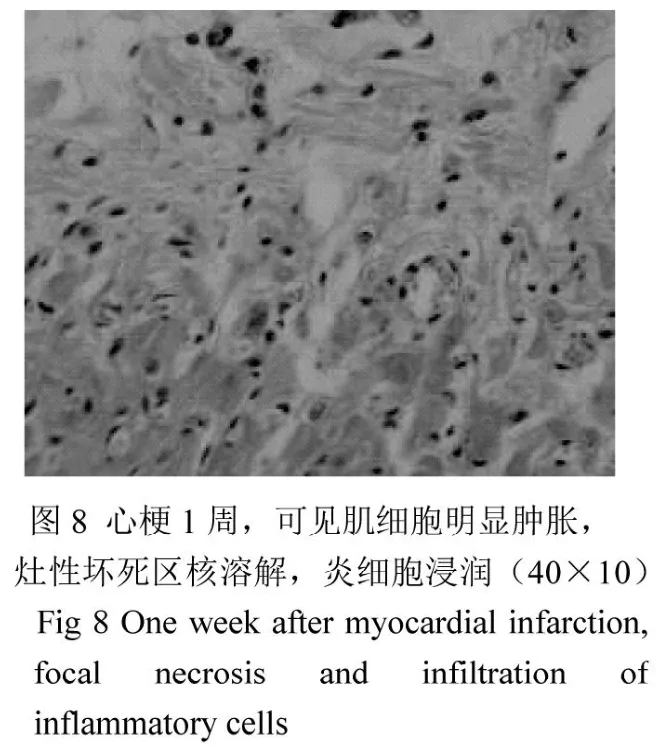
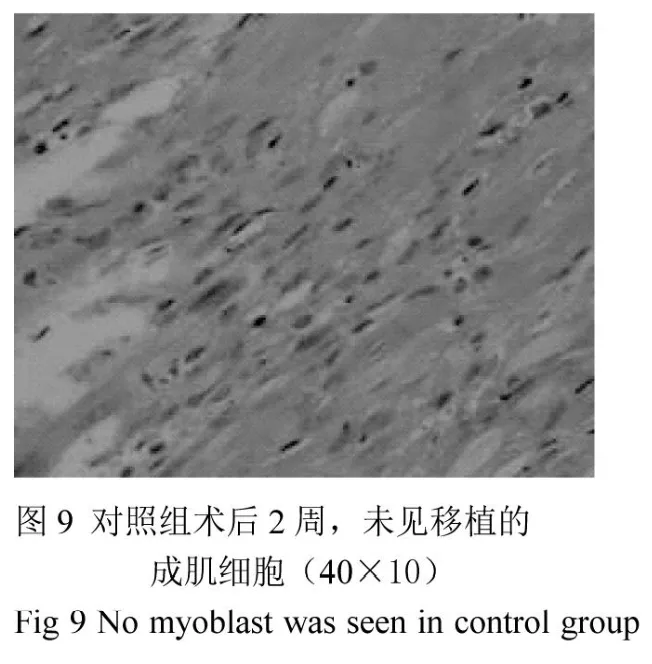
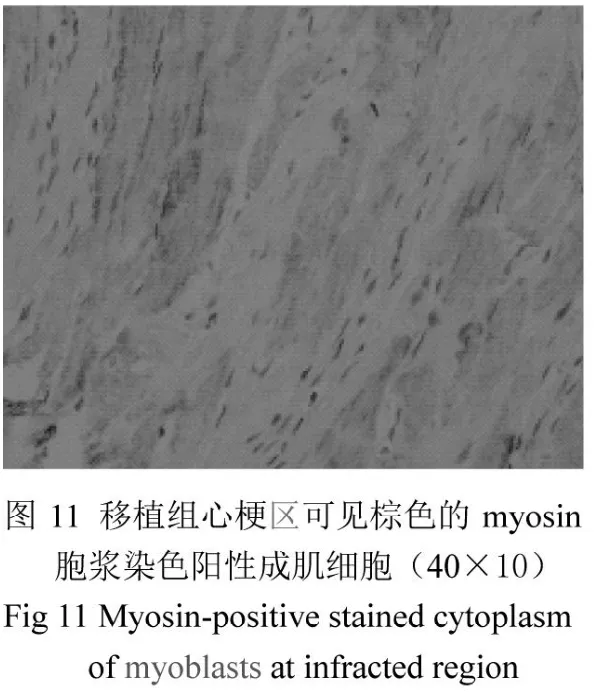
正常心肌組織心肌纖維排列均勻整齊,橫紋清楚,細胞大小均勻一致,細胞質豐富均勻(圖7)。心梗模型建立后1周,心肌組織切片HE染色可見肌細胞明顯腫脹,灶性壞死區核溶解,炎細胞浸潤(圖8)。移植組術后2周心肌內可見細胞核相對較大,紅色條索狀的成團細胞,周圍有炎細胞浸潤(圖10);而對照組未見成肌細胞(圖9)。免疫組化顯示,在移植部位有成肌細胞特異性抗體myosin染色陽性的細胞(圖11,深棕色,胞漿);胞膜可見P2X1受體染色陽性(圖12,深棕色,胞膜)。


三、討論
骨骼肌成肌細胞是源于胚胎中胚層的干細胞,在正常骨骼肌中,它位于基底膜與肌纖維漿膜之間,處于靜止狀態。當受到外界刺激,在應激狀態下可以分裂、增生,形成新的肌纖維,是骨骼肌再生的儲備力量。作為成體干細胞的一種,它具有橫向分化的潛能,多項動物及臨床試驗表明[3-5],骨骼肌成肌細胞移植入心肌梗死區可以存活并改善心梗后心功能。
本實驗應用膠原酶及鏈酶蛋白酶兩部消化法成功培養出成肌細胞,percoll的應用能夠有效的去除部分成纖維細胞及肌碎片,加快原代細胞貼壁時間。細胞生長曲線顯示第6天即可達到對數生長期,增值明顯加快。細胞爬片進行desmin及myosin(肌生成素)染色均為陽性。
細胞的移植時間選擇在心肌梗死模型建立后的第7天,主要依據是[6],心肌梗死后的5天內是炎癥反應期,且最初24小時最為強烈,在此期間植入將導致細胞參與到炎癥的級聯反應中,將影響有效的肌細胞和血管的生成。而心肌梗死后7天時,血管內皮生長因子的濃度能達最高峰,心肌梗死2周,瘢痕組織已經開始形成。因此,細胞移植的理想時間點是心肌梗死發生后的7天至14天之間。
對心肌梗死大鼠實行骨骼肌成肌細胞移植后心功能的檢測,通過與對照組(培養液移植組)相對比發現成肌細胞移植能對心肌梗死大鼠的心功能起到明顯的改善作用。超聲心動檢測心率、射血分數、短軸縮短率等各指標顯示,心肌梗死建立前,各組各檢測指標間無明顯差異;心肌梗死建立后1周,與梗死前比較,兩組心功能均降低,但組間差異無統計學意義;反映心臟收縮功能的EF %和FS%,于移植后2周明顯升高,且明顯高于對照組和移植后1周檢測值;對照組在移植后不同時間點測量值無顯著性差異。說明骨骼肌成肌細胞移植有助于心肌梗死大鼠心臟收縮功能的改善。
雖然骨骼肌成肌細胞始終不能轉化成心肌細胞[7],但以往的動物實驗[8-10]表明骨骼肌成肌細胞在移植入心梗部位后可以成為可成活的肌肉組織,并能改善受損心臟的收縮功能,并且某些表型將變得能與心肌細胞相似,認為雖然移植的成肌細胞不是形成了心肌細胞,但是可分化成能負擔心臟工作的慢收縮細胞。本實驗選擇的myosin抗體是MY-32克隆,可與骨骼肌肌凝蛋白重鏈(myosin heavy chain)反應,但不與平滑肌或心肌的肌凝蛋白反應。第3代成肌細胞爬片的myosin染色陽性,移植后2周的心梗大鼠心肌梗死區域亦可見myosin陽性染色的細胞,形成條索狀纖維,而在對照組未見類似細胞生長,myosin染色亦陰性。這表明移植2周后,成肌細胞可在心肌梗死區域存活。
1972年Burnstock首次提出“嘌呤受體”的概念,描述細胞膜腺苷受體和ATP受體。對胞外腺苷敏感的受體稱Pl,屬G蛋白偶聯受體家族;胞外核苷酸的受體稱為P2,包括P2X和P2Y兩類,其中P2Y屬G蛋白偶聯受體家族,P2X則是配體ATP門控的離子通道,當胞外ATP結合時P2X通道打開,允許陽離子通過。在哺乳動物細胞內,有5個P2Y(P2Yl,P2Y2,P2Y4,P2Y6,P2Y11)和7個P2X(P2Xl~7)受體已被克隆并闡明其藥理學特性。
在心肌中,臨近的心肌細胞是通過閏盤相連接的,閏盤是細胞膜的一個特殊部位,包括縫隙連接、膜表面黏附分子及橋粒。而其中的縫隙連接是一種離子通道,細胞與細胞之間動作電位的快速傳導和化學信號的直接傳遞就是通過縫隙連接實現的。哺乳動物心肌細胞的縫隙連接主要是connexin43,因此connexin43成為研究移植的骨骼肌成肌細胞與心肌細胞之間電-機械偶聯的重要目標。近來的研究[11]發現在體外共同培養的心肌細胞與骨骼肌成肌細胞可形成同步搏動的網絡,甚至在免疫熒光染色后在共聚焦顯微鏡下發現了二者之間可能存在由N-cadherin和Connexin43介導的連接。而動物實驗[12]也發現來自于宿主心肌細胞的電活動可能也能引起骨骼肌細胞的收縮,但該研究者認為電活動是通過細胞膜直接接觸傳導的,而不是通過有效連接快速傳導的。骨骼肌成肌細胞與心肌細胞間存在電-生理偶聯始終沒有直接證據。Lele Jiang 等[2]研究發現,在人的左心室中,P2X1受體的表達與connexin43密切相關,部分P2X1受體與connexin43一樣都在閏盤中表達,主要集中于閏盤的中部。在閏盤表達的P2X1受體的功能目前還不十分清楚。早在1990年,Sugiura等[13]即發現,在心肌細胞中,ATP可通過與特異性的受體結合調節縫隙連接通道蛋白,進而調節縫隙連接的選擇通透性。以往對其它細胞的研究亦表明[14-17],ATP可通過調節connexin43的表達進而促進縫隙連接選擇通透性的形成,而且它可能是一種促進細胞與臨近細胞形成縫隙連接的信號分子。而ATP為P2X1受體的配體,ATP、P2X1受體以及connexin43之間是通過什么通路進行相互作用和調節的目前尚不十分清楚,還有待遇進一步的研究。
P2X1受體表達的另外一項作用可能為其介導的正性肌力作用。當任何一種亞型的P2X受體與胞外ATP結合時,P2X通道打開,允許陽離子通過,如鈉、鉀、鈣離子等(但以鈣離子的通透性為著),從而引起膜電位改變,L型Ca2+通道開放,Ca2+內流促使肌漿網內的鈣池釋放更多的Ca離子,胞內鈣增多,繼而引起細胞收縮力增強[18-19]。免疫組化顯示P2X1受體在血管平滑肌細胞和心肌細胞中表達,在大鼠心肌細胞中表達水平較低,但充血性心力衰竭大鼠左心室的P2X1受體mRNA水平增加了2.7倍[20]。可能與缺氧的心肌細胞能夠釋放ATP[21],使P2X1受體表達上調,發揮P2受體介導的正性肌力作用[22]有關。心肌梗死區域中存活的成肌細胞所表達的P2X1受體可能會發揮其正性肌力作用,加強心肌梗死區的收縮力,從而改善整體的心功能。
總之,在成功移植了成肌細胞并改善心梗大鼠心功能的基礎上,P2X1受體表達陽性,推測與P2X1受體在改善心功能方面的作用主要有以下兩點:1)P2X1受體與縫隙連接蛋白connexin43之間關系密切,可調節connexin43的表達和電信號或化學信號的傳遞,進而完善成肌細胞之間及成肌細胞與心肌細胞之間的同步收縮;2)P2X1受體可通過特異性配體ATP的結合而發揮正性肌力作用,從而加強心肌梗死區的收縮力。
[1]Dowell JD, et al.Myocyte and myogenic stem cell transplantation in the heart.Cardiovasc Res.2003; 58:333-347.
[2]Lele Jiang, et al.P2X1 receptors are closely associated with connexin 43 in human ventricular myocardium.International Journal of Cardiology.2005; 98:291-297.
[3]Taylor DA, et al.Regenerating functional myocardium: improved performance after skeletal myoblast transplantation.[J].Nat Med.1998; 4: 929-933.
[4]Scorsin M, et al.Comparison of the effect of cardiomyocyte and skeletal myoblast transplantation on postinfarction left ventricular function.J Thorac Cardiovasc Surg.2000; 119(6): 1169-1175.
[5]Menasche P, et al.Myoblast transplantation for heart failure.Lancet.2001; 357(9252): 279-280.
[6]Min Nian, et al.Inflammatory Cytokines and Postmyocardial Infarction Remodeling.Circ Res.2004; (94):1543-1553.
[7]Reinecke H, Poppa V, Murry CE.Skeletal muscle stem cells do not transdiff erentiate into cardiomyocytes after cardiac grafting.J Mol Cell Cardiol.2002; 34: 241-9.
[8]Ghostine S, et al.Long-term efficacy of myoblast transplantation on regional structure and function after myocardial infarction.Circulation.2002; 106(supplⅠ): 131-6.
[9]Dib N, Diethrich EB, et al.Endoventricular transplantation of allogenic skeletal myoblasts in a porcine model of myocardial infarction.J Endovasc Ther.2002; 9: 313-19.
[10]Charles E.Murry, et al.Skeletal Myoblast Transplantation for Repair of Myocardial Necrosis.J.Clin.Invest.1996; (98): 2512–2523.
[11]Reinecke H, MacDonald GH, et al.Electromechanical coupling between skeletal and cardiac muscle.Implications for infarct repair.J Cell Biol.2000; 149: 731-40.
[12]Pouzet B , et al.Intramyocardial transplantation of autologous myoblasts: can tissue processing be optimized? Circulation.2000; 102(suppl 3): 210-5.
[13]Sugiura H, Toyama J, et al.ATP directly affects junctional conductance between paired ventricular myocytes isolated from guinea pig heart.Circ Res.1990; 66: 1095-1102.
[14]Goldberg GS, Moreno AP, Lampe PD.Gap junctions between cells expressing connexin 43 or 32 show inverse permselectivity to adenosine and ATP.J Biol Chem.2002; 277: 36725-30.
[15]Webb RJ, et al.Gap-junctional communication in mouse cumulus-oocyte complexes: implications for the mechanism of meiotic maturation.Reproduction.2002; 123: 41-52.
[16]Beyer EC, Steinberg TH.Evidence that the gap junction protein connexin-43 is the ATP-induced pore of mouse macrophages.J Biol Chem.1991; 266: 7971-4.
[17]Saez JC, et al.Gap junction hemichannels in astrocytes of the CNS.Acta Physiol Scand.2003; 179:9-22.
[18]De Young, M.B.and Scarpa, A.(1987) FEBS Lett.223, 53-58.
[19]Scamps, F.and Vassort, G.(1990) Pflugers Arch.417, 309-316.
[20]Hou M, Malmsjo M, et al.Increase in cardiac P2X1-and P2Y2-receptor mRNA levels in congestive heart failure.Life Sci.1999; 65: 1195–206.
[21]Pelleg A, Vassort G, et al.ATP and adenosine signaltransductions in the cardiovascular system.In: Heart Physiology and Pathophysiology (4th ed.), edited by Sperelakis N, Kurachi Y, Terzic A, and Cohen MV, San Diego: Academic.2002; p.633–655.
[22]Podrasky E, Xu D, Liang BT.A novel phospholipase C-and cAMP-independent positive inotropic mechanism via a P2 purinoceptor.Am J Physiol.1997; 273: H2380– 7.
10.3969/j.issn.1001-8972.2010.21.101
馬牧欣,心內科碩士,醫師。
AbstractObjective: Evaluate the effect of rat skeletal myoblast transplantation on heart function of myocardial infraction, the survival in infracted myocardium, and the expression of P2X1 receptors in grafted myoblast.Methods: Thirty male Wister rats were divided at random into transplantation group(n=15) and control group(n=15).Acute myocardial infraction was induced by ligation of left anterior descending coronary artery.Myoblast was draw from tibial muscle of rats, cultured.Myoblast was injected into the infracted region of transplantation group, culture medium was injected into the infracted region of control group at 1 week after infraction.Cardiac function was evaluated before MI, 1 week after MI, 1 and 2 weeks after cell delivery.2 weeks after MI, HE, antimyosin and anti-P2X1 receptors staining were performed.Result: Compared with control group, left ventricular ejection function (LVEF) and fractional shortening (FS) were improved significantly 2 weeks after transplantation.At the infracted region of transplantation group, myosin-positive cells were found, and were positively stained by P2X1 receptors staining.Conclusion: Transepicardial delivery of skeletal myoblast can significantly improve cardiac function and survive at the infracted region.The mechanism of the improvement of cardiac function maybe related with the presence of P2X1 receptors at the infracted region, which suggests their role in the restoration of gap junction between cardiomyocyte and the inotropic effect mediated by P2X1 receptors.
Key wordsskeletal myoblast;myocardial infraction;cell transplantation;P2X1 receptors gap junction

