酶法合成沒食子酸葉黃素酯的研究
楊云裳,許建國,張應鵬*,李春雷
(蘭州理工大學石油化工學院,甘肅 蘭州 730050)
酶法合成沒食子酸葉黃素酯的研究
楊云裳,許建國,張應鵬*,李春雷
(蘭州理工大學石油化工學院,甘肅 蘭州 730050)
以葉黃素和沒食子酸為原料,在脂肪酶Novozym435的催化下,合成沒食子酸葉黃素酯,并用IR對其結構進行表征。研究脂肪酶催化葉黃素與沒食子酸合成沒食子酸葉黃素酯的影響因素,考察酶量、溶劑、體系水分、溫度、時間等因素對酯化反應的影響。結果表明,適宜的工藝條件為酶用量10mg/mL、溶劑為氯仿、初始加水量60mg/g、溫度40℃、反應時間30h,在上述條件下沒食子酸轉化率可達81.8%。
沒食子酸;葉黃素;脂肪酶;酯化反應
葉黃素分子中存在共軛雙鍵,共軛雙鍵對氧是極不穩定的,特別是純的晶體更容易被氧化破壞。許多物理、化學、生物因素都影響到葉黃素的穩定性,例如氧、光輻射、高溫、酸等[1]。據有關文獻報道[2],葉黃素在未避光保存條件下60d后其含量僅占原來樣品中45%,而暴露空氣中的葉黃素在60d后其葉黃素質量占原來樣品中葉黃素質量的9.7%,葉黃素的不穩定性限制了其開發利用,文獻報道,葉黃素酯的生物利用度大于純葉黃素[3]。本實驗把葉黃素與沒食子酸合成沒食子酸葉黃素酯,可以大大提高葉黃素的穩定性,沒食子酸葉黃素酯在人體內水解成葉黃素和沒食子酸,同時滿足人們對沒食子酸的需求。沒食子酸具有廣譜的抗菌、抗病毒、抗腫瘤[4]等藥理作用。
傳統化學方法合成沒食子酸葉黃素酯,存在反應溫度高,不利于葉黃素的穩定,而酶催化法具有反應條件溫和,產物選擇性高等優點。目前,國內外關于脂肪酶催化酯類合成的研究主要應用在山梨醇油酸、蠟酯、VA乳酸酯和風味酯[5]的合成。在合成葉黃素衍生物方面還未見報道。本實驗以沒食子酸、葉黃素作為底物,考察各因素對于酯化反應的影響,對反應條件進行摸索。
1 材料與方法
1.1 材料、試劑與儀器
固定化脂肪酶(Novozym435) 諾維信(中國)生物技術有限公司;沒食子酸、氧化鎂、葉黃素、丙酮、乙醇、甲苯、氯仿、正己烷、石油醚均為分析純;分子篩(4A°) 上海國藥集團化學試劑有限公司;硅膠(100~200目、200~300目) 青島海洋化工有限公司。
THZ-92B氣浴恒溫振蕩器 上海博迅實業有限公司醫療設備廠;AC-400核磁共振波譜儀 中科院武漢波譜公司;Nexus 670FT-IR型傅里葉變換紅外光譜儀 美國Thermo Nicolet公司;RE-52A真空旋轉蒸發儀 上海亞榮生化儀器廠;DZF-6021真空干燥箱 上海中友儀器設備有限公司;FA1004電子分析天平 上海恒平科學儀器有限公司。
1.2 方法
1.2.1 沒食子酸葉黃素酯的合成[6]
準確稱取葉黃素56mg(0.1mmol)和沒食子酸34mg(0.2mmol)(物質的量的比為1:2),置于10mL具塞錐形瓶中,加入1.0mL脫水的氯仿,然后加入10mg脂肪酶(Novozym435),充入氮氣,于40℃氣浴搖床下,避光振蕩反應12h,然后加入15mg活化的4A°分子篩,再繼續反應12h停止。
1.2.2 沒食子酸葉黃素酯的分離純化
在層析柱中裝入一層脫脂棉,并用石油醚潤濕沖實。稱取15g硅膠(200~300目),15g氧化鎂,充分攪拌使兩者混合均勻后加入柱子中,用石油醚反復沖幾遍,使柱子中的硅膠和氧化鎂沖實加固。用移液管小心地將待分離的沒食子酸葉黃素酯移入玻璃皿中,然后稱取2g硅膠(100~200目)將其拌干,再加入柱子中。先用石油醚作為洗脫劑,由于沒食子酸葉黃素酯的極性較小,所以用石油醚就可以將它沖下,當點樣無原料點下來時,換用石油醚:丙酮:甲醇=85:15:1(V/V)的溶劑作為洗脫劑繼續沖洗,點樣直到無點后,換用石油醚:丙酮=7:1的溶劑作為洗脫劑繼續沖洗。最后換用乙酸乙酯作為洗脫劑,直到柱子沖洗干凈后認為沒食子酸葉黃素酯已全被沖下。收集沒食子酸葉黃素酯,濃縮即得。
1.2.3 沒食子酸轉化率的計算
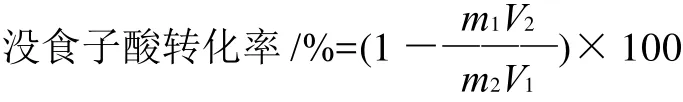
式中:m1、m2為反應前、后的樣品質量/mg;V1、V2為反應前、后滴定所用氫氧化鈉的量/mL。
2 結果與分析
2.1 沒食子酸葉黃素酯的合成及分離純化
在有機介質中,脂肪酶的催化具有專一性和特異性[7],催化沒食子酸分子與葉黃素分子直接進行酯化反應。沒食子酸葉黃素酯得率81%。
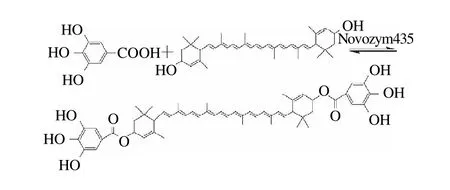
2.2 沒食子酸葉黃素酯的結構表征
2.2.1 沒食子酸葉黃素酯的紅外(IR)分析
對硅膠柱層析分離純化得到的沒食子酸葉黃素酯作紅外分析,結果見圖1。3448cm-1處的強吸收峰為沒食子酸上-OH的吸收峰,1713cm-1處的強吸收峰為酯C=O的伸縮振動峰[8],是酯的特征吸收峰。以上分析說明,沒食子酸和葉黃素在脂肪酶的催化下已經發生酯化反應,生成了沒食子酸葉黃素酯。
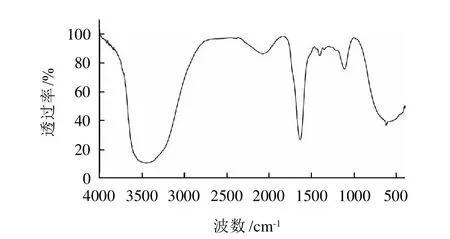
圖1 沒食子酸葉黃素酯的紅外圖譜Fig.1 IR spectrum of gallic acid lutein ester
2.2.2 沒食子酸葉黃素酯的核磁H譜(400MHz,CDCl3)
由產物核磁H譜數據(圖2)可知,產物圖譜中6.968~7.521為沒食子酸苯環氫的化學位移,4.196為葉黃素結構式上-CH=CH2氫的化學位移,證明產物中有沒食子酸和葉黃素結構。
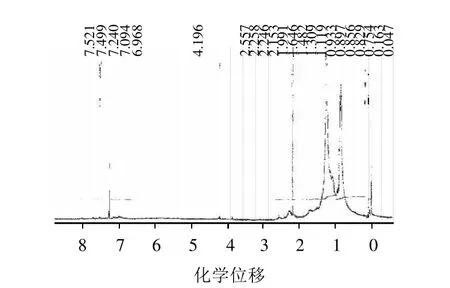
圖2 沒食子酸葉黃素酯的核磁H譜(1HNMR)圖譜Fig.2 1HNMR spectrum of gallic acid lutein ester
2.3 初始加水量對反應的影響
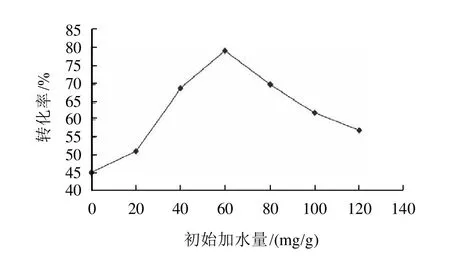
圖3 初始加水量對轉化率的影響Fig.3 Effect of initial water content on conversion rate of gallic acid
水對脂肪酶的影響有兩個方面。一方面,酶需要少量的水以保持活性的三維結構狀態,水可以保持催化部位的整體性,催化部位的極化、蛋白質的穩定。另一方面,水含量過高,酶構象柔性過大,酶構象將向疏水環境下熱力學穩定的狀態變化,引起酶結構的改變和失活,同時又限制了疏水性底物在酶分子附近的溶解性。只有水量適宜時酶表現出最大活力[9]。多次實驗發現,加水量為60mg/g比較合適(圖3)。既保持酶活性的三維結構狀態又促進反應進行。
2.4 有機溶劑對反應的影響
在使用不同的酶或者在不同的反應體系中,最適于使用的有機溶劑也是不同的。有機溶劑影響酶催化的途徑有3種:一是有機溶劑與酶直接發生作用,通過干擾氫鍵和疏水鍵等改變酶的構象,從而導致酶的活性被抑制或酶的失活;二是有機溶劑和能擴散的底物或產物相互作用,影響正常酶催化反應的進行;三是有機溶劑還可以直接和酶所需的必需水相互作用。一般認為在非水介質中添加親水性或和水互溶性的有機溶劑對反應不利,因為它們會奪取酶周圍微環境的必需水,從而使酶失活,所以選擇的有機溶劑疏水性越強越好[10]。由圖4可知,氯仿比較合適。
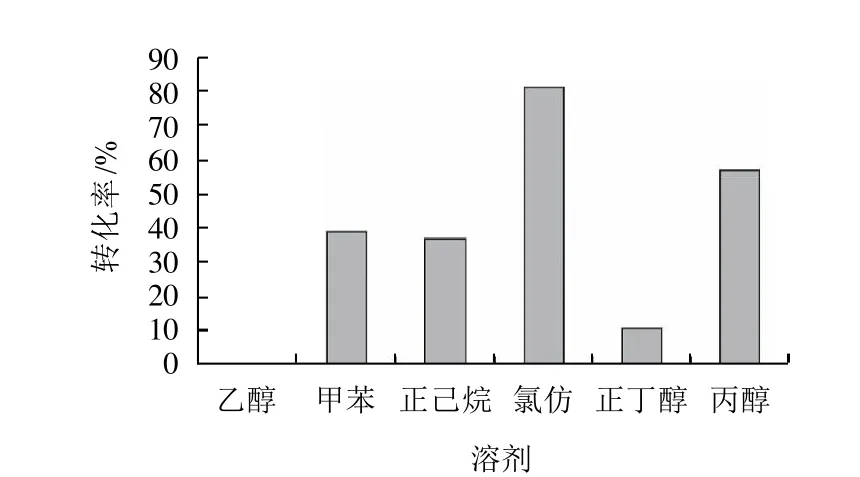
圖4 有機溶劑對轉化率的影響Fig.4 Effect of organic solvent type on conversion rate of gallic acid
2.5 反應溫度對反應的影響
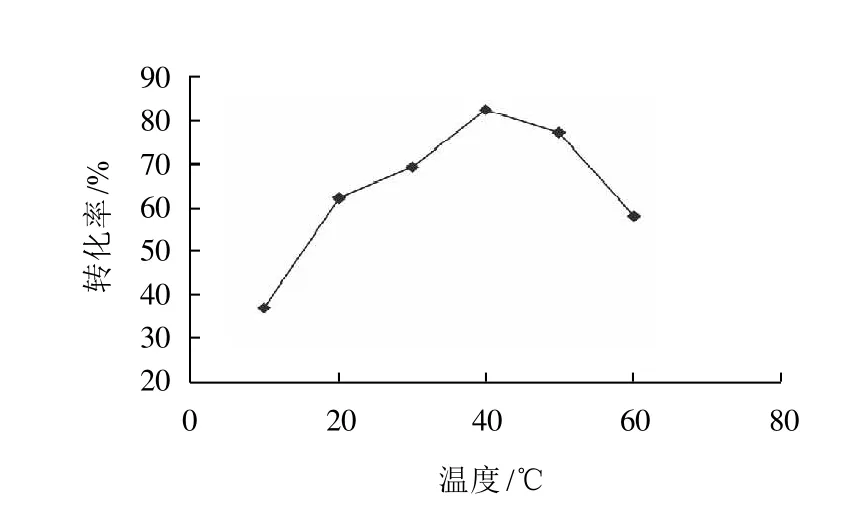
圖5 反應溫度對轉化率的影響Fig.5 Effect of reaction temperature on conversion rate of gallic acid
固定化酶Novozym435在100℃仍保持較高的酶活性。為此,在其他條件不變的情況下,只改變反應溫度觀察對轉化率的影響,具體結果見圖5。結果顯示隨溫度的升高轉化率增加,但溫度過高(>50℃)對葉黃素的穩定不利[2],實驗表明40℃比較合適。
2.6 反應時間對酯化反應的影響
反應時間對酯化反應的影響見圖6,反應的轉化率隨著反應時間的延長而提高,但30h后轉化率的增長趨勢不明顯,可能由于反應時間過長,酶的機械損耗增大,活力喪失,影響酯化反應進行[11]。所以總體時間應控制在30h。

圖6 反應時間對轉化率的影響Fig.6 Effect of reaction time on conversion rate of gallic acid
2.7 酶用量對反應的影響
在葉黃素加量20.1mg、葉黃素與沒食子酸物質的量的比1:2、加入氯仿1.0mL、反應溫度40℃、反應時間24h條件下,考察酶用量對轉化率的影響,結果見圖7。
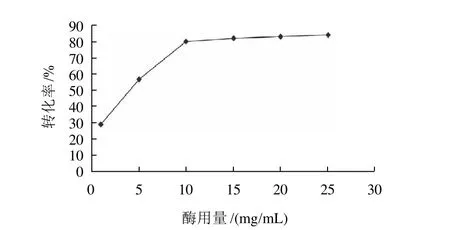
圖7 酶用量對轉化率的影響Fig.7 Effect of enzyme load on conversion rate of gallic acid
由圖7可知,隨著酶用量增加,反應速度加快,酯化率增高。但酶用量達10mg/mL后,酶用量進一步增加,酯化率反而有降低的趨勢,這是由于過多的酶使反應初始生成的副產物水增加,過多的水會使反應向負反應進行,并且可能導致酶失活[12]。所以酶用量為10mg/mL較合適。
3 結 論
本實驗通過酯化反應,利用固定化脂肪酶催化葉黃素與沒食子酸合成沒食子酸葉黃素酯,并對影響此反應的各種因素進行了系統的研究。反應經初步優化得到的條件為酶用量10mg/mL、溶劑為氯仿、初始加水量60mg/g、溫度40℃、反應時間30h,在上述條件下沒食子酸轉化率可達81.8%。
[1] 徐任生. 天然產物化學[M]. 北京: 科學出版社, 2004: 3-23.
[2] 楊云裳, 張海霞, 李春雷, 等. 萬壽菊葉黃素的超聲提取工藝研究[J].食品研究與開發, 2007(1): 97-99.
[3] 張艷, 惠伯棣. 葉黃素單體與酯的生物接近度比較[J]. 中國食品添加劑, 2008(5): 81-86.
[4] 王之德. 重要精細化學品: 沒食子酸[J]. 天然氣化工, 1995, 20(1):34-39.
[5] 劉楚怡, 薛文通, 張惠. 非水介質中脂肪酶催化合成酯類的研究進展[J]. 食品工業科技, 2009(12): 424-426.
[6] 張春鳴, 趙文秀, 陳峰, 等. 單辛酸甘油酯的酶法合成[J]. 食品科學,2007, 28(11): 360-364.
[7] 蔡水根, 陶冠軍, 秦昉 等.L-抗壞血酸月桂酸酯的酶法合成、分離及其性質[J]. 食品工業科技, 2008, 29(10): 211-214.
[8] 吳謀成. 儀器分析[M]. 北京: 科學出版社, 2003.
[9] 石紅旗, 林學政, 繆錦來, 等. 溶劑體系酶催化酸解反應合成富含共軛亞油酸甘油酯的研究[J]. 中國食品學報, 2004(4): 257-265.
[10] 曹淑桂. 有機溶劑中酶催化研究的新進展[J]. 化學通報, 1995(5): 5-11.
[11] GUO Zheng, SUN Yan. Solvent-free production of 1,3-diglyceride of CLA: Strategy consideration and protocol design[J]. Food Chemistry,2007, 100(3): 1076-1084.
[12] SABEDER S, HABULIN M, KNEZ Z. Lipase-catalyzed synthesis of fatty acid fructose esters[J]. Journal of Food Engineering, 2006, 77(4):880-886.
Lipase-catalyzed Synthesis of Gallic Acid Lutein Ester
YANG Yun-shang,XU Jian-guo,ZHANG Ying-peng*,LI Chun-lei
(School of Petrochemical Engineering, Lanzhou University of Technology, Lanzhou 730050, China)
Lutein and gallic acid were used as the raw materials to synthesize gallic acid lutein ester through the catalysis of Lipozyme Novo 435. The structure of the synthesized product was determined by IR. The effects of enzyme load, solvent, and water content, reaction temperature and reaction time on the esterification were investigated. The optimal reaction conditions were determined as follows: enzyme load, 10 mg/mL; water content, 60 mg/g; reaction medium, chloroform; reaction temperature,40 ℃; and reaction time, 30 h. The conversion rate of gallic acid was up to 81.8% under these conditions.
gallic acid;lutein;lipase;esterification
Q814
A
1002-6630(2010)20-0093-04
2010-01-04
楊云裳(1972—),女,副教授,博士,研究方向為生物有機化學。E-mail:yangguang@lut.cn
*通信作者:張應鵬(1970—),男,副教授,博士,研究方向為有機化學。E-mail:yingpengzhang@126.com

