生物法生產3-羥基丁酮的研究概況
徐慧,賈士儒,劉建軍
1(天津科技大學天津市工業微生物重點實驗室,天津,300457)2(山東省食品發酵工程重點實驗室,山東濟南,250013)
生物法生產3-羥基丁酮的研究概況
徐慧1,賈士儒1,劉建軍2
1(天津科技大學天津市工業微生物重點實驗室,天津,300457)2(山東省食品發酵工程重點實驗室,山東濟南,250013)
3-羥基丁酮是一種重要的風味物質和平臺化合物,在食品、化工、醫藥等行業具有廣泛的用途,目前主要以化學合成方法生產。3-羥基丁酮是許多微生物糖代謝的中間產物,以淀粉質原料,生物法生產3-羥基丁酮技術的研究已引起人們的廣泛關注,本文綜述了生物法生產3-羥基丁酮的研究概況,主要包括3-羥基丁酮生產菌株、代謝機理及相關酶類、代謝調節機制及高效積累策略等。
3-羥基丁酮,菌株,發酵,生產
3-羥基丁酮,又名乙偶姻、甲基乙酰甲醇,自然存在于玉米、葡萄、可可、蘋果、香蕉、干酪、肉類等許多食品中,是一種應用廣泛、令人喜愛的食用香料,具有令人愉快的奶油香味,是國際上常用的香料品種,主要用作奶油、乳品、酸奶和草莓型等香料的生產,與啤酒、葡萄糖的風味有關,并且對黃油及奶油發酵制備奶酪過程中香味的產生起關鍵作用,我國標準GB2760-86規定其為允許使用的食品香料,美國食品和萃取協會(FEMA)安全號為2008,其推薦用量如表1。
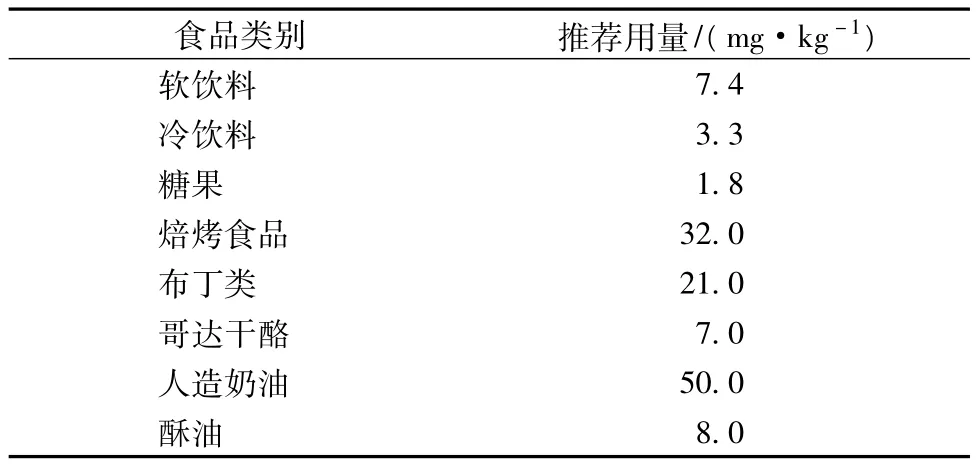
表1 3-羥基丁酮的推薦用量[1]
3-羥基丁酮在食品、化工、醫藥等行業具有廣泛的用途,此外,2004年美國能源部將3-羥基丁酮列為30種優先開發利用的平臺化合物之一,目前主要以化學合成方法生產,開展環境友好、產品可視為純天然的生物法生產3-羥基丁酮的技術研究已引起人們的高度關注[2]。國內外以化學合成法生產3-羥基丁酮主要采用以丁二酮部分加氫還原工藝、2,3-丁二醇選擇性氧化工藝和丁酮氯化水解工藝為主,這3種工藝都普遍存在產品收率和得率較低,環境污染較嚴重等缺點,且產品的質量安全受到質疑。化學合成工藝使用的原料,如丁二酮、2,3-丁二醇等主要是來源于不可再生的化石資源,且這些原料本身也是比較重要的化工產品,石油資源的日益短缺以及石油價格的日益攀升,原料來源受到限制,產品成本將越來越高,已成為限制化學合成法生產3-羥基丁酮大規模發展的主要瓶頸。3-羥基丁酮分子中含有不對稱碳原子,具有2種手性異構體,而目前還不能合成光學純度高以及旋光度一定的產品,采用常規的物理方法(例如分餾、分步結晶等)進行手性拆分是非常困難的,這也限制了化學合成法生產3-羥基丁酮的發展和應用。
隨著生物技術的發展,生物技術在風味物質合成中發揮著越來越重要的作用,化學品或石油化學品合成風味物質逐步被酶法合成或發酵技術生產所代替。眾所周知,生物過程環境友好,此外,許多國家的食品法規已認可天然風物劑可以由生物技術獲得,具有商業價值的天然化合物生物生產技術的研究開發已引起人們的高度關注。近年來關于生物法生產3-羥基丁酮的技術研究已有許多報道,盡管多數研究尚處于實驗室研究階段或小批量生產階段,仍存在諸多技術或經濟性問題,但生物工藝環境友好、產品安全以及原料可以再生等優勢必將成為未來3-羥基丁酮生產的主導方向。
1 酶轉化法生產3-羥基丁酮
酶轉化技術代替傳統的化工工藝已有很多成功的例子,該工藝方法的關鍵是要獲得大量特異性的酶。1992年美國的 Hummel[2]等應用乳酸桿菌或酵母菌菌體中的丁二酮還原酶(雙乙酰還原酶)作為生物催化劑催化丁二酮還原生成3-羥基丁酮。該方法首先是通過培養乳酸桿菌或酵母菌,分離純化獲得菌體細胞內的丁二酮還原酶,在pH5.0、溫度70℃下,由得到的丁二酮還原酶及輔酶NAPH催化還原丁二酮生成3-羥基丁酮,該方法的優點是產率最高達100%,且沒有其它副產物產生,由于生物酶的特異性,因此可以獲得旋光度一定的產品。1996年,Budavari[3]報道可以用山梨糖菌或生膜菌作用于2,3-丁二醇制備3-羥基丁酮,或者通過曲霉菌、青霉菌等真菌作用于甘蔗汁來生產3-羥基丁酮,但這些工藝方法規模化應用仍存在諸多問題。DeFaveri[2]等2003年采用一種吸附了醇脫氫酶的膜式反應器,由漢氏醋桿菌(Acetobacter hansenii)全細胞催化2,3-丁二醇合成3-羥基丁酮考察了溶氧水平、P/O比例對酶催化反應的影響,在最適反應條件下2,3-丁二醇轉化為3-羥基丁酮的最大摩爾轉化率達71.6%,3-羥基丁酮的最高質量濃度達8.93g/L,并建立了轉化過程的物質和能量平衡數學模型。
雖然酶轉化工藝3-羥基丁酮得率較高,副產物較少,且產物具有旋光度,但酶法轉化生產3-羥基丁酮主要是以丁二酮或丁二醇為原料,這一點與化學合成方法相類似,另外,酶的生產成本和性能是該工藝技術的關鍵,要獲得大量特異性的酶存在很大困難。
2 微生物發酵法生產3-羥基丁酮
自20世紀初期發現部分微生物代謝糖類可以分泌3-羥基丁酮以來,它的生物合成與代謝調節等研究一直是人們關注的焦點。但相關報道多數是關于微生物代謝機制和基因調控方面的研究,少數涉及到3-羥基丁酮發酵的研究也主要是作為丁二酮和2,3-丁二醇發酵的副產物被提及到,而關于以糖質原料微生物發酵生產3-羥基丁酮的研究報道較少,且多數尚處于菌株選育等前期研究階段。
2.1 產3-羥基丁酮的微生物菌株
3-羥基丁酮是許多微生物糖代謝的中間產物,普里斯考爾試驗(Voges Proskauer test)就是以診斷菌株是否分泌羥3-基丁酮做為微生物分類的一種標記,其分泌對于微生物本身具有重要的生理意義。自然界可以轉化糖生產3-羥基丁酮的微生物,主要包括腸桿菌屬(Enterobacter)、芽孢桿菌屬(Bacillus)、克雷伯氏菌屬(Klebisella)、沙雷氏菌屬(Serratia)以及乳球菌屬(Lactococcus)等[4]。文獻報道的產3-羥基丁酮菌株、使用的碳源及產率情況見表2。Zeng[6]等1991年報道利用產氣節桿菌(A.aerogenes)發酵得到最終質量濃度為110g/L的2,3-丁二酮和3-羥基丁酮。Hikmet[7]等構建的高效表達血紅蛋白(VHb)基因(vgb)的產氣腸桿菌(Enterobacter aerogenes)工程菌羥基丁酮和丁二醇的產率提高83%。1996年 Hespell[1]報道在考察多粘桿菌(Bacillus polymyxa)發酵底物時發現部分菌株可利用木糖等生成2,3-丁二酮和3-羥基丁酮,以5%葡萄糖和5%的阿拉伯糖為底物,在溫度30℃,pH7.0,250 r/min振蕩培養條件下,3-羥基丁酮的產量達到11.3g/L,2,3-丁二醇的產量為2.3g/L。關于菌株產生2,3-丁二醇的同時產生3-羥基丁酮的報道很多,但多數菌株積累3-羥基丁酮的濃度都較低,做為生產菌株工業化發酵生產3-羥基丁酮是不可能的。Xu[2]等篩選得到1株短小芽孢桿菌 XH195(DSM16187)以葡萄糖或蔗糖為碳源,3-羥基丁酮的產率分別達63.0g/L和58.1g/L。趙祥穎和劉建軍[8-9]等選育獲得了1株高產3-羥基丁酮的枯草芽孢桿菌 SFA-H31(CGMCC1869),3-羥基丁酮的發酵產量達到55.67g/L,且該菌株不產生丁二酮和2,3-丁二醇等副產物。以上2株菌是目前報道的產3-羥基丁酮比較高的菌株,是最有可能應用于發酵技術工業化生產3-羥基丁酮的菌株,尤其是菌株不產或少量積累丁二酮和2,3-丁二醇等副產物的性能,對其應用于3-羥基丁酮發酵生產是至關重要的。
與化學合成法及酶轉化法相比,微生物發酵法生產3-羥基丁酮具有工藝簡單、條件溫和、環境友好,原料來源豐富且可以再生,產品可視為純天然,安全性高等優點,是3-羥基丁酮最經濟可行的生產方法。隨著發酵法生產3-羥基丁酮研究的不斷深入,采用先進的生物技術手段和傳統育種技術相結合,選育、構建產率高、性能優良的生產菌株,同時注重發酵生產3-羥基丁酮的上下游技術的配套研究,是盡快實現生物發酵生產3-羥基丁酮的關鍵。
2.2 3-羥基丁酮的生物合成途徑
早在20世紀40年代就開始研究3-羥基丁酮的形成機制,以后陸續的研究探明了細菌、酵母、植物以及動物肝臟等合成3-羥基丁酮的途徑,在細菌中3-羥基丁酮是僅由丙酮酸開始合成的,在酵母和動物組織中是由丙酮酸和乙醛合成的,而在植物和某些動物組織中僅是由乙醛合成的,不同微生物之間以及植物、動物器官等合成3-羥基丁酮的途徑都存在較大的差異。Juni[10]等以產氣桿菌為研究對象,研究證實能夠由丙酮酸形成羥基丁酮的細菌抽提物可以轉化α-乙酰乳酸形成羥基丁酮,并有產氣桿菌的細胞抽提液中分離出2種酶組分,一種組分作用于丙酮酸形成α-乙酰乳酸,另一種組分催化α-乙酰乳酸脫羧但對丙酮酸沒有效果。后來證實前者為α-乙酰乳酸合酶,后者為α-乙酰乳酸脫羧酶。Harold[11]等研究證實3-羥基丁酮的形成與丙酮酸好氧氧化(進入三羧酸循環)或厭氧代謝(生成乳酸或乙醛)無關,而是存在著另一種途徑形成3-羥基丁酮。

表2 產3-羥基丁酮菌株及產率[4-5]
在微生物3-羥基丁酮代謝相關的部分酶類方面還存在不同的觀點,但到目前為止,大量生化、分子生物學的研究結果已經證實3-羥基丁酮的代謝途徑主要涉及到糖類代謝的糖酵解(EMP)途徑(葡萄糖到丙酮酸)和丙酮酸到3-羥基丁酮的轉化過程,如圖1。在微生物體內,合成3-羥基丁酮的途徑主要有2種途徑:2分子丙酮酸在α-乙酰乳酸合成酶的作用下合成一分子α-乙酰乳酸,α-乙酰乳酸在酸性條件下非酶自然氧化脫羧生成2,3-丁二酮,2,3-丁二酮在丁二酮還原酶或2,3-丁二醇脫氫酶的作用下還原生產3-羥基丁酮;另一條途徑是2分子丙酮酸在α-乙酰乳酸合成酶的作用下合成1分子α-乙酰乳酸,α-乙酰乳酸經α-乙酰乳酸脫羧酶作用生成3-羥基丁酮。

圖1 3-羥基丁酮的合成途徑
由葡萄糖轉化為3-羥基丁酮的反應過程如下:
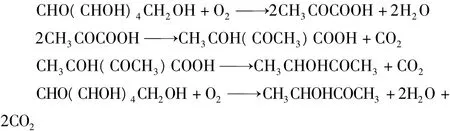
由此計算的葡萄糖到3-羥基丁酮的理論轉化率為:(88÷180)×100%=48.89%
隨著生物及相關技術的發展,有關3-羥基丁酮代謝的相關酶類的分離與純化,以及有關酶在離體情況下的催化行為的研究,進一步揭示了3-羥基丁酮在生物體內的合成代謝途徑,為在基因水平上逐步揭示3-羥基丁酮代謝調控機制奠定了基礎。
2.3 3-羥基丁酮的分解途徑
正常情況下3-羥基丁酮在微生物體內是不會積累的,3-羥基丁酮即使微生物為了抵御不良環境而做為儲存能源積累時,在葡萄糖等易同化碳源耗盡后也會被繼續消耗來維持自身的生命活動,這充分表明微生物體內存在3-羥基丁酮的分解代謝體系。盡管早在20世紀20年代就開始研究3-羥基丁酮的分解代謝,但關于3-羥基丁酮的分解代謝仍存在不同的觀點[4]。早期的研究認為3-羥基丁酮的降解是通過一個環形途徑(2,3-丁二醇環)實現的。Juni[12]等對細菌代謝2,3-丁二醇、羥基丁酮和雙乙酰的途徑進行了詳細研究,提出了能夠以2,3-丁二醇或3-羥基丁酮做為唯一碳源生長的細菌體內存在一個環形途徑轉化這些化合物生產乙酸,并闡明了環形途徑的構成及相關物質之間的轉化過程,環形途徑除了2,3-丁二醇、羥基丁酮和雙乙酰以外主要涉及到2種新的中間產物 3-乙酰基-3-羥基丁酮和 3-乙酰基-2,3-丁二醇,在環形途徑中雙乙酰通過焦磷酸硫胺素催化的酮醇縮合反應被轉化成3-乙酰基-3-羥基丁酮和乙酸,3-乙酰基-3-羥基丁酮被還原為3-乙酰基-2,3-丁二醇,依次被水解為2,3-丁二醇和乙酸,環形途徑運行一個周期的效果就是一分子的3-羥基丁酮形成兩分子的乙酸,乙酸是一種微生物可以迅速氧化的化合物,從而到達微生物利用2,3-丁二醇、羥基丁酮做為生長和能源底物的目的。以后又有許多學者對該途徑進行了研究并陸續提出了不同的觀點。Lopez[13]等研究提出枯草芽孢桿菌能夠降解2,3-丁二醇環中所有的中間產物,但降解羥基丁酮并不需要一個完整的環,阻斷環中兩步反應的突變株可以和標準菌株一樣代謝羥基丁酮。后來Lopez[14]等又研究了枯草芽孢桿菌中3-羥基丁酮以直接氧化裂解方式降解的過程,在枯草桿菌細胞抽提物中能夠檢測到羥基丁酮的直接氧化分解產物是乙酸和乙醛,在反應體系中沒有檢測到雙乙酰并且證實缺失3-羥基丁酮裂解能力的突變株不能夠利用葡糖糖耗盡后積累的羥基丁酮,催化由雙乙酰生成3-乙酰基-3-羥基丁酮的3-乙酰基-3-羥基丁酮合酶可能與催化羥基丁酮裂解的酶是一致的。枯草桿菌直接裂解羥基丁酮生成兩分子的乙醛,其中一分子的乙醛是一種活化形式被進一步氧化成為乙酸,這一結論顯然與Juni[12]等提出的3-羥基丁酮通過2,3-丁二醇環形途徑降解是不一致的。近20年來,關于3-羥基丁酮分解代謝的基因調控機制的研究已有很多報道,如Grundy[15]等研究提出了枯草芽孢桿菌的分解代謝產物乙酸和羥基丁酮利用基因由CcpA(球形調節蛋白)調節。Huang等[16]研究提出了3-羥基丁酮的分解與菌株acoA基因(編碼依賴于焦磷酸硫胺素的羥基丁酮脫氫酶的α-亞單位)缺失有關,并認為早期關于3-羥基丁酮通過2,3-丁二醇環進行的降解的觀點是一個錯誤的。越來越多的研究表明,在細菌中3-羥基丁酮通過3-羥基丁酮脫氫酶系(AoDH ES)直接氧化裂解途徑降解更為普遍[17]。歸納起來,3-羥基丁酮在生物體內的降解途徑如圖2。
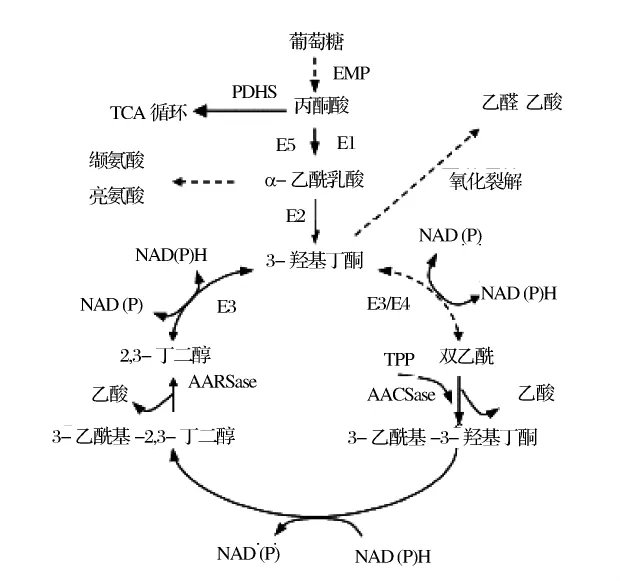
圖2 3-羥基丁酮的分解代謝相關途徑
2.4 3-羥基丁酮代謝相關的酶類
根據圖1和圖2,與3-羥基丁酮代謝有關的酶類主要涉及到催化丙酮酸到α-乙酰乳酸的α-乙酰乳酸合成酶(E1)、催化α-乙酰乳酸生成3-羥基丁酮的α-乙酰乳酸脫羧酶(E2)、催化2,3-丁二醇和3-羥基丁酮相互轉化的2,3-丁二醇脫氫酶(E3)以及催化雙乙酰到3-羥基丁酮的2,3-丁二醇脫氫酶(E3)和丁二酮還原酶(E4)。隨著生化分離純化技術的發展,關于3-羥基丁酮代謝相關酶類的研究很多,許多微生物中3-羥基丁酮代謝相關的酶類已經被分離純化并研究了其性質[16-17]。
Juni[12]等研究發現以 2,3-丁二醇和礦物質培養基培養的細菌2,3-丁二醇脫氫酶失去底物特異性,可以催化2,3-丁二醇異化過程中的幾個反應。由葡萄糖培養的幾種微生物的2,3-丁二醇脫氫酶具有不同的底物特異性以及不同的底物親和力,當產氣桿菌生長在葡萄糖和3-羥基丁酮為碳源的培養基中時,形成不同的2,3-丁二醇脫氫酶。Klaus[18]等純化了產氣桿菌中催化雙乙酰還原的酶(E4)和羥基丁酮和2,3-丁二醇可逆反應的酶(E3)到同質,純化過程中兩種酶的比率E3/E4是保持不變的,并推斷兩種反應由同一種酶催化,并建議命名該酶為雙乙酰(羥基丁酮)還原酶。Oyvind[19]等研究了產氣桿菌中雙乙酰(羥基丁酮)還原酶的多樣性,證實產氣桿菌的雙乙酰(羥基丁酮)還原酶純酶至少由12種不同的蛋白組分組成,所有這些組分都有酶活性。Liv[20]等研究了產氣桿菌雙乙酰(羥基丁酮)還原酶催化雙乙酰到羥基丁酮還原反應的的動力學,證實雙乙酰(羥基丁酮)還原酶催化羥基丁酮到2,3-丁二醇的反應以及可逆反應和雙乙酰到羥基丁酮的反應,這種酶是一種四聚體,是由4個相同大小的亞單位組成,2,3-丁二醇到羥基丁酮的反應受乙酸鹽的抑制,并且發現在pH 5.8、乙酸緩沖液體系比其它緩沖液體系對應2,3-丁二醇的Km值增加了10倍。Zahler[21]等證實在枯草芽孢桿菌中存在2種可以催化α-乙酰乳酸合成的酶,一種是與支鏈氨基酸合成有關,催化一分子活性乙醛與一分子的丙酮酸縮合生成α-乙酰乳酸(支鏈氨基酸的前體),另外一種α-乙酰乳酸合成酶催化兩分子的丙酮酸縮合生成α-乙酰乳酸,與枯草芽孢桿菌穩定期3-羥基丁酮的產生有關。目前已經證實3-羥基丁酮的合成與支鏈氨基酸的合成共享一個前體物α-乙酰乳酸,兩種催化α-乙酰乳酸形成的酶的存在也已經證實,與支鏈氨基酸合成有關的稱為合成代謝α-乙酰乳酸形成酶或 α-乙酰羥酸合酶(α-acetohydroxy acid synthase,AHAS,E5),與 3-羥基丁酮形成有關的稱為分解代謝α-乙酰乳酸形成酶或α-乙酰乳酸合酶( α-acetolactatesynthase,ALS)[4]。 Holtzclaw[22]等對枯草芽孢桿菌降解性乙酰乳酸合酶進行了純化并研究了酶的性質。3-羥基丁酮合成與分解酶類及其調節機制的深入研究,為定向改造3-羥基丁酮生產菌株,實現產物的高效積累提供了理論基礎。有關3-羥基丁酮代謝仍由部分問題還不能定論,比如2,3-丁二醇脫氫酶或雙乙酰還原酶催化的由雙乙酰到3-羥基丁酮的反應是否是可逆的等問題仍有待進一步研究證實。
2.5 3-羥基丁酮代謝調節與積累機制
3-羥基丁酮是許多原核和真核微生物新陳代謝的產物,微生物代謝糖類分泌3-羥基丁酮對微生物本身具有重要的生理意義,比較公認的意義在于抵御環境的酸化、參與NAD/NADH比率的調節和做為儲存碳源[4]。深入認識羥基丁酮的分解代謝源于對細菌3-羥基丁酮利用的多樣性研究,如 Pelobacter carbinolicus,Clostridium magnum,Klebsiella pneumoniae,Bacillus subtilis,Alcaligenes eutrophus和 Pseudomonas putida,在這些細菌中發現3-羥基丁酮的分解代謝是由羥基丁酮脫氫酶酶系(AoDH ES)催化完成的,包括:依賴于焦磷酸硫胺素的羥基丁酮脫氫酶(AoDH E1)、二氫硫辛酰胺乙酰(基)轉移酶(AoDH E2)和二氫硫辛酰胺脫氫酶(AoDH E3),并且AoDH E的結構基因acoA(編碼AoDH E1的 α-亞單位)、acoB(編碼 AoDH E1的 β-亞單位)和 acoC(編碼AoDH E2)在染色體上呈線性依次排列。在P.carbinolicus,C.magnum和K.pneumoniae中,acoL基因(編碼AoDH E3)也做為aco基因簇的一個部分[16-18]。Renna[23]等對枯草芽孢桿菌的乙酰乳酸合成酶基因(alsS)、乙酰乳酸脫羧酶基因(alsD)和調節基因alsR進行了克隆和測序,并發現alsS和alsD同屬一個操縱子,該操縱子的轉錄受alsR基因產物的調節,如果alsR遭到破壞,alsS就不能夠表達。羥基丁酮做為額外的碳源儲存物質在菌株對數生長期被儲存和分泌,在穩定生長期以一種仍然不明確的途徑被利用,在孢子形成期間發揮作用[16]。Grundy[15]等研究提出枯草芽胞桿菌利用乙酸和3-羥基丁酮基因由CcpA蛋白調節,并分離鑒定了ccpA基因下游的acu基因簇,并證實如果將acuA基因敲除,菌株利用3-羥基丁酮或2,3-丁二醇為碳源生長以及芽胞的形成均受到影響。Huang[16]等研究報道了枯草芽胞桿菌3-羥基丁酮分解代謝的生物化學和分子特征,提出了不同的觀點,認為枯草芽孢桿菌分解代謝羥基丁酮的酶是由acu基因簇編碼的,則完全不同于以前在所有其他能夠利用羥基丁酮做為碳源生長的細菌菌株中發現的由aco基因簇編碼的多組分構成的羥基丁酮脫氫酶酶系(AoDH ES),以大梭菌(Clostridium magnum)含有AoDH ES的acoA、acoB基因片段為探針,與枯草芽孢桿菌基因組雜交,分離得到acoA、acoB、acoC、acoL和acoR等同源基因,并研究發現如果將acoA基因(編碼AoDH E1的α-亞單位)敲除,細胞則不能利用培養基中的3-羥基丁酮或以3-羥基丁酮為唯一碳源生長,表明枯草芽孢桿菌利用3-羥基丁酮也是由aco基因簇控制的。根據3-羥基丁酮代謝分子調節機制分析,alsR基因突變可以使alsSD操縱子轉錄受阻,alsS基因缺失突變則細胞不積累3-羥基丁酮,acoA基因缺失突變細胞不能利用3-羥基丁酮為唯一碳源生長[16]。這一系列理論研究成果為采用基因工程手段構建3-羥基丁酮高產菌株奠定了基礎。
2.6 3-羥基丁酮高產菌株構建策略
從高效積累3-羥基丁酮角度,菌株應具備E1、E2高活性而E3、E4缺失或低水平的特點。從代謝工程角度,切斷分支代謝途徑或降低分支代謝流也是非常有效的策略。Hikmet[7]等將帶有編碼透明顫菌屬(Vitreoscilla)(細菌)血紅蛋白(VHb)基因(vgb)的pUC8質粒克隆到產氣腸桿菌(Enterobacter aerogenes)中,血紅蛋白(VHb)基因(vgb)的表達增加了羥基丁酮/丁二醇代謝途徑的代謝流,使菌株發酵產物羥基丁酮和丁二醇的產率提高83%。Zahler[21]等通過剔除合成代謝α-乙酰乳酸形成酶(E5)等手段獲得一支分解代謝α-乙酰乳酸形成酶(E1)組成型突變株,該突變株在對數生長前期就開始產生3-羥基丁酮。為了獲得高產3-羥基丁酮生產菌株一方面可以對現有的高產丁二酮或 2,3-丁二醇的菌株進行遺傳改造,敲除acoA基因等編碼E3、E4酶的相關基因或降低其基因轉錄水平;另一方面可以通過自然選育E1、E2活性高、E3、E4、E5酶水平低的3-羥基丁酮生產菌株。采用傳統誘變與基因工程、代謝工程改造等先進育種技術相結合的手段,抑制丙酮酸、支鏈氨基酸代謝支路,改造、構建高產3-羥基丁酮生產菌株,突破微生物自身代謝調節機制,從而提高菌株生物合成3-羥基丁酮的能力,是實現3-羥基丁酮高效積累的關鍵。
2.7 3-羥基丁酮發酵
以3-羥基丁酮做為發酵目的產物的研究較少,3-羥基丁酮做為微生物代謝產物多數是關于奶制品發酵產生的風味物質或做為丁二酮和2,3-丁二醇發酵的副產物被提及到。韓麗[1]等通過常規誘變處理B.subtillis SFs-4獲得1株高產3-羥基丁酮突變株F-d31,并對突變株生產3-羥基丁酮的發酵培養基和發酵條件進行了優化,以130g/L葡萄糖為主要原料,搖瓶發酵羥基丁酮發酵產率達到48.6g/L,采用16 L、50 L自動發酵罐對突變株F-d31 3-羥基丁酮發酵條件進行了初步研究,轉速300 r/min,pH值6.0左右,3-羥基丁酮最高產率達55.7g/L,對糖轉化率42.73%。Xiao[23]等采用響應面試驗設計優化了Bacillus subtilis CICC 10025培養基,重點考察了糖蜜和豆餅水解液兩種成分對3-羥基丁酮的影響,在搖瓶發酵中,3-羥基丁酮的產率為37.9g/L,糖蜜和豆餅水解液的最佳濃度分別是22.0%(v/v)和27.8%(v/v),在5 L發酵罐中發酵56.4 h羥基丁酮的產率為35.4g/L。劉建軍[9]等利用 Bacillus subtilis SFA-H31(CGMCC1869)以葡萄糖為主要原料,在50 L發酵罐中發酵培養52 h,轉化率達到48.26%,3-羥基丁酮發酵產率達55.67g/L,并證實該菌株不產生副產物丁二酮和2,3-丁二醇。Xu[2]等篩選得到1株短小芽孢桿菌XH195(DSM16187),以葡萄糖或蔗糖為碳源,37℃發酵60 h,3-羥基丁酮的產率分別達63.0g/L或58.1g/L。Teixeira[5]等2002年報道采用實驗設計對高里有孢漢生假絲酵母(Hanseniaspora guilliermondii)3-羥基丁酮發酵進行了優化,其最初糖濃度6.8%,溫度28℃,pH4~6時,3-羥基丁酮的產量最高可達0.36g/L。LEY[24]研究了多株醋酸菌以乳酸為主要底物生產3-羥基丁酮的情況,考察了底物濃度和通風對3-羥基丁酮的影響,底物的最大轉化率達到理論轉化率的74%,并提取獲得了3-羥基丁酮的樣品。李元芳[25]等研究了中間代謝產物與副產物對乙偶姻合成代謝的影響,認為3-羥基丁酮的發酵過程同時生成3-羥基丁酮與混合酸,葡萄糖作為唯一的碳源和能源物質,將沿著氧化和還原兩個平行路徑代謝,產生目的產物和副產物,伴生的其它終產物主要有丁二醇、丁二酮、乙酸、乳酸等有機酸,并研究發現利用蔗糖和檸檬酸有利于總體發酵水平的提高。發酵法生產3-羥基丁酮產業化的關鍵還是上游技術的首先突破,以上研究中部分菌株的3-羥基丁酮產率及性能已具備產業應用的潛力,尤其是不產或少量積累2,3-丁二醇、丁二酮的菌株Bacillus subtilis SFAH31(CGMCC1869),采用傳統技術與現代生物技術相結合進一步提高菌株產率,加強發酵、提取工藝及設備的配套研究,有望應用于工業化發酵生產3-羥基丁酮。
3 結束語
3-羥基丁酮作為一種食用香料和一種重要的平臺化合物,其需求量日益增加,尤其是隨著人們生活水平的不斷提高,對食品的安全性提出了更高的要求,目前,國際上主要有美國JM公司、德國BASF公司和日本的信達公司生產3-羥基丁酮,國內主要包括江蘇潘南香料廠、河南濮盟集團、上海泰禾化工有限公司、上海愛普香料有限公司以及上海凱信生物科技有限公司等。國內外3-羥基丁酮的生產仍然以化學合成工藝為主,產品的應用范圍受到限制。據報道,目前國內已由企業開展了生物發酵法生產3-羥基丁酮的試生產工作,產品并取得了相關認證,為發酵法生產3-羥基丁酮的產業化奠定了基礎。
來自于人口、資源、環境等方面的壓力,以化石資源為原料的傳統化工產業勢必逐步被以可再生資源為原料、環境友好的新型生物化工產業所替代。開展環境友好、原料來源豐富、條件溫和、產品可視為純天然的微生物發酵法生產3-羥基丁酮的技術研究具有廣闊的推廣應用前景。
[1]韓麗.3-羥基丁酮高產菌株的選育及發酵條件研究[D].濟南:山東輕工業學院碩士論文,2007.
[2]紀曉俊,黃和,杜軍,等.3-羥基丁酮的合成及應用進展[J]. 現代化工,2008,28(4):81.
[3]張小舟,曾崇余,任曉乾.乙偶姻合成研究現狀及展望[J]. 江蘇化工,2001(4):29-31.
[4]Xiao Z J,Xu P.Acetoin metabolism in bacteria[J].Critical Reviews in Microbiology,2007,33:127-140.
[5]Teixeira R M,Cavalheiro D,Ninow J L,et al.Optimzation of acetoin production by Hanseniaspora guilliermondii using experimental design[J].Brazilian Journa of Chemical Engineering,2002,19(2):181-186.
[6]Zeng A P,Biebl H,Deckwer W D.Production of 2,3-butanediol in a membrane bioreactor with cell recycle[J].Appl Microbiol Biotechnol,1991,34:463-468.
[7]Hikmet G,Ze'ev B,David M,et al.Enhanced production of acetoin and butanediol in recombinant Enterobacter aerogenes carrying Vitreoscilla hemoglobin gene[J].Bioprocess Biosyst Eng,2004,26:325-330.
[8]趙祥穎,劉建軍,張家祥,等.一株產高純度3-羥基丁酮的枯草芽孢桿菌[P],CN.ZL 200710013402.5,2009-01-28.
[9]劉建軍,趙祥穎,田延軍,等.一株枯草芽孢桿菌在制備3-羥基丁酮中的應用[P],CN.ZL 200710013403.X,2009-11-25.
[10]Juni E.Mechanisms of Formation of Acetoin by Bacteria[J].The Journal of Biological Chemistry,1952,195:715-726.
[11]Harold J S,Severo O.Pyruvate oxidation system and acetoin formation [J].The Journal of Biological Chemistry,1954,209:313-326.
[12]Juni E,Heym G A.A cyclic pathway for the bacterial dissimilation of 2,3-butanediol,acetylmethylcarbinol and diacetyl.I.general aspects of the 2,3-butanediol cycle[J].J Bacteriol,1956,71:425-432.
[13]López J,Thoms B,Fortnagel P.Mutants of Bacillus subtilis blocked in acetoin reductase[J].Eur J Biochem,1973,40(2):479-483.
[14]López J,Thoms B,Rehbein H.Acetoin degradation in bacillus subtilis by direct oxidative Cleavage[J].Eur J Biochem,1975,57:425-430.
[15]Grundy F J,Turinsky A J,Henkin T M.Catabolite Regulation of bacillus subtilis Acetate and acetoin utilization genes by ccpA[J].Journal of Bacteriology,1994,176(15):4 527-4 533.
[16]Huang M,Oppermann-Sanio,Steinbüchel A.Biochemical and molecular characterization of the bacillus subtilis acetoin catabolic pathway[J].J Bacteriol,1999,181(12):3 837-3 841.
[17]Priefert H,Hein S,Krüger N,et al.Identification and molecular characterization of the Alcaligenes eutrophus H16 aco operon genes involved in acetoin catabolism[J].J Bacteriol,1991,173(13):4 056-4 071.
[18]Klaus B,?yvind H,Fredrik C S.The Reduction of diacetyl and acetoin in Aerobacter aerogenes.evidence for one enzyme catalyzing both reactions[J].Eur J Biochem,1971 18:116-119.
[19]?yvind H,Klaus B,Fredrik C S.Diacetyl(acetoin)reductase from Aerobacter aerogenes evidence for multiple forms of the enzyme[J].Eur J Biochem,1971,20:206-208.
[20]Liv J,Sip H L,Fredrik C S.Diacetyl(acetoin)reductase from Aerobacter aerogenes kinetic studies of the reduction of diacetyl to acetoin[J].Eur J Biochem,1973,34:97-99.
[21]Zahler S A,Benjamin L G,Glatz B S,et al.Genetic Mapping of alsA,alsR,thyA,kauA,and citD Markers in Bacillus subtilis[M].Washington,D C:American Society for Microbiology,1976:35-43.
[22]Holtzclaw W D,Chapman L F.Degradative acetolactate synthase of Bacillus subtilis:purifi cation and properties[J].J Bacteriol,1975,121(13):917-922.
[23]Xiao Z J,Liu P H,Qin J Y,et al.Statistical optimization of medium components for enhanced acetoin production from molasses and soybean meal hydrolysate[J].Applied Microbiology and Biotechnology,2007,74(1):61-68.
[24]Ley J D.On the formation of acetoin by acetobacte[J].J Gen Mimobiol,1959,21:852-865.
[25]李元芳,張兆斌,杜毅.中間代謝產物與副產物對乙偶姻合成代謝的影響[C].第七屆中國香料香精學術研討會論文集,2008:126-129.
Present Research Situation of Acetoin Production by Biological Method
Xu Hui1,Jia Shi-ru1,Liu Jian-jun2
1(Key Laboratory of Industrial Microbiology,Ministry of Education,Tianjin University of Science and Technology,Tianjin 300457,China)2(Key Laboratory of Food& Fermentation Engineering,Jinan 250013,China)
Acetoin(3-hydroxy-2-butanone)is an important flavor compound and platform chemical.It can be widely used in the industry of food,chemical and medicine.At present,the production methods of acetoin are mainly based on chemical synthetic menthods.Acetoin is an important physiological metabolite excreted by many microorganisms,In recent years,the demand of acetoin has been growing,so the production of acetoin by biological method has attracted people's attention.This paper described the present research situation of acetoin production by biological method,which mainly involves acetoin producing strains,metabolic mechanism,related enzymes and accumulation strategies.
acetoin,Strains,fermentation,production
博士研究生(賈士儒教授為通訊作者)。
2010-08-16

