采用微量熱法快速檢測食品中的細(xì)菌總數(shù)*
農(nóng)衛(wèi)良,管驍,徐斐
(上海理工大學(xué)醫(yī)療器械與食品學(xué)院,上海,200093)
采用微量熱法快速檢測食品中的細(xì)菌總數(shù)*
農(nóng)衛(wèi)良,管驍,徐斐
(上海理工大學(xué)醫(yī)療器械與食品學(xué)院,上海,200093)
以醬牛肉中的污染菌為測試菌,利用微量熱儀測定了細(xì)菌的生長熱譜曲線。結(jié)果表明,選擇24 h的菌體活化時間,并在優(yōu)化培養(yǎng)基中培養(yǎng)4 h后計算菌體生長熱效應(yīng)值,在103~106CFU/mL范圍內(nèi)菌體放熱量能較好地反映細(xì)菌總數(shù)值,且微量熱法測得結(jié)果與常規(guī)平板計數(shù)法無顯著差異。
微量熱法,細(xì)菌總數(shù),快速檢測
對食品中的細(xì)菌總數(shù)進(jìn)行快速測定是現(xiàn)代食品衛(wèi)生控制工作中的一項重要任務(wù)[1]。近年來,隨著諸如酶聯(lián)免疫吸附分析、聚合酶鏈反應(yīng)技術(shù)、微量熱法等新技術(shù)的開發(fā)成功[2-3],為細(xì)菌總數(shù)的快速定量提供了多種可能。這些快檢技術(shù)原理各不相同,適用范圍也存在差異。其中微量熱法具有通用性強,適用于所有微生物檢測等特點,備受食品工作者的關(guān)注[4]。微量熱法快速檢測微生物是利用微生物生長時產(chǎn)生熱效應(yīng)的原理設(shè)計而成的,微生物在生長和代謝的過程中,能產(chǎn)生一定的代謝熱,且熱效應(yīng)與微生物的數(shù)量呈比例關(guān)系。然而目前此法的發(fā)展也受到一些因素的限制,如微生物生長熱效應(yīng)過程周期長、熱信號小等,因而對熱量值進(jìn)行定量往往誤差較大。若能有效放大微生物的熱信號值,將對采用微量熱法對微生物進(jìn)行快速定量具有重要意義。前期試驗已對量熱用細(xì)菌培養(yǎng)基進(jìn)行了優(yōu)化研究,本試驗通過測定微生物生長熱來表征初始細(xì)菌總數(shù),并將微量熱法測定結(jié)果與常規(guī)平板計數(shù)法進(jìn)行比較,以期驗證微量熱法在細(xì)菌快速定量中的可行性。
1 材料與方法
1.1 材料
1.1.1 材料與試劑
菌種:來自于醬牛肉中的優(yōu)勢菌株,本實驗室自行分離純化;細(xì)菌混懸液是按照醬牛肉樣品中各種細(xì)菌的平均比例進(jìn)行混懸。
NaCl、葡萄糖、MaSO4均為分析純試劑,胰蛋白胨、牛肉浸膏等均為生化試劑。
1.1.2 儀器與設(shè)備
Micro DSCⅢ型微量熱儀,法國SETARAM公司,蠕動泵BT00-300M:常州市城合衛(wèi)生設(shè)備廠。
1.1.3 培養(yǎng)基的制備
普通培養(yǎng)基:胰蛋白胨10 g、NaCl 5 g、牛肉浸膏3 g溶于1 000mL蒸餾水中,調(diào)pH值至6.8~7.2,121℃高壓滅菌20 min備用。
優(yōu)化培養(yǎng)基:胰蛋白胨8.45 g、NaCl 5 g、MgSO40.2 g、酵母浸膏4.5 g、葡萄糖1.42 g溶于1 000mL蒸餾水,調(diào)pH值至7.2,121℃高壓滅菌20 min備用。
1.2 實驗方法
1.2.1 量熱測定[5-6]
量熱實驗在微量熱儀Micro DSC III上進(jìn)行,采用停流法。首先對循環(huán)池及管路進(jìn)行清洗消毒,清洗過程為:先以30mL/h流速的無菌蒸餾水清洗30 min,再用75%乙醇以相同流速清洗30 min,最后用無菌蒸餾水再沖洗30 min。待基線平穩(wěn)后,以30mL/h的流速泵入接過菌種的細(xì)菌培養(yǎng)液,確認(rèn)培養(yǎng)液已充滿流動池后停泵,儀器即開始測量記錄循環(huán)池內(nèi)細(xì)菌生長代謝的熱功率-時間曲線。測量過程完成后,對該生長熱曲線進(jìn)行積分計算出細(xì)菌生長代謝過程的累積放熱量 Q[4,7]。
1.2.2 細(xì)菌活化時間對放熱的影響
冷藏菌種的活化在普通培養(yǎng)基倒成的平板上進(jìn)行。在其他培養(yǎng)條件相同的條件下,改變量熱實驗前細(xì)菌的活化時間(分別為12、24、36和48 h),然后在接種相等菌量的條件下進(jìn)行量熱實驗,比較細(xì)菌前期活化時間對其生長放熱量的影響。
1.2.3 初始細(xì)菌總數(shù)和放熱量Q的關(guān)系
其他條件相同情況下,考察不同初始細(xì)菌接種量分別在優(yōu)化培養(yǎng)基中培養(yǎng)不同時間(4、5、6、7 h)(即對應(yīng)熱譜曲線中不同的積分時間)和累積放熱量之間的對應(yīng)關(guān)系。
1.2.4 標(biāo)準(zhǔn)曲線的建立
利用上述優(yōu)化實驗得到的最佳測熱條件,對不同細(xì)菌總數(shù)的菌懸液(1 000~100 0000 CFU/mL)進(jìn)行熱量值測定,建立“熱量值-細(xì)菌總數(shù)”的標(biāo)準(zhǔn)曲線。
1.2.5 確證實驗
制取未知菌液濃度的菌懸液,分成2份,1份利用量熱法檢測未知濃度菌懸液4 h的放熱量,并通過細(xì)菌放熱標(biāo)準(zhǔn)曲線計算得到細(xì)菌總數(shù)。另1份用平板計數(shù)法檢測細(xì)菌總數(shù)。對2種方法的結(jié)果進(jìn)行比對,驗證標(biāo)準(zhǔn)曲線的準(zhǔn)確性。
2 結(jié)果與分析
2.1 培養(yǎng)基成分對細(xì)菌放熱的影響
量熱過程中所使用培養(yǎng)基的不同會直接影響到細(xì)菌的生長狀況,進(jìn)而對細(xì)菌的生長熱效應(yīng)產(chǎn)生影響。通過量熱實驗分別得到細(xì)菌在優(yōu)化培養(yǎng)基和普通培養(yǎng)基中的生長熱譜圖,如圖1所示。
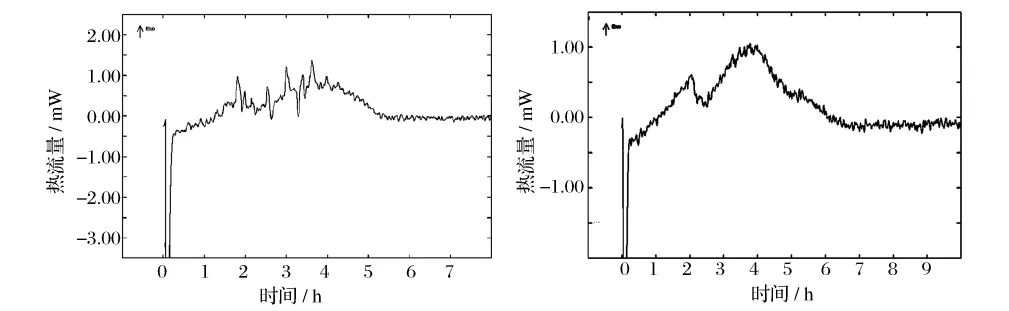
圖1 細(xì)菌在不同培養(yǎng)基中的生長放熱圖譜
從圖1可以看出,細(xì)菌在普通培養(yǎng)基中生長,雖有熱效應(yīng)峰出現(xiàn),但峰形不夠明顯且不規(guī)則,而細(xì)菌在優(yōu)化培養(yǎng)基中生長出現(xiàn)了典型的特征性放熱峰,且比較好地反映出了細(xì)菌生長的4個時期,這可能是由于菌體在不同培養(yǎng)基中生長狀況不同而造成生長熱效應(yīng)有差異引起的[4,8-9]。通過對熱譜曲線不同時間段的積分,可以求得細(xì)菌生長不同時期所產(chǎn)生的累積熱效應(yīng),結(jié)果如圖2所示。從圖2可以看出,在普通培養(yǎng)基中生長的細(xì)菌生長熱效應(yīng)不如在優(yōu)化培養(yǎng)基中的顯著,且累積熱效應(yīng)與放熱時間的關(guān)系呈先增加(5 h之前)后減小的變化趨勢,這可能是由于細(xì)菌在生長初期正常生長放熱,到后期出現(xiàn)菌體自溶吸熱所造成的[10]。相比之下,菌體在優(yōu)化培養(yǎng)基中的生長熱效應(yīng)較大,且在7 h的測熱過程中持續(xù)放熱,熱效應(yīng)與放熱時間呈現(xiàn)出較好的線性關(guān)系,由此說明優(yōu)化培養(yǎng)基更有利于在微量熱法測定過程中的應(yīng)用。
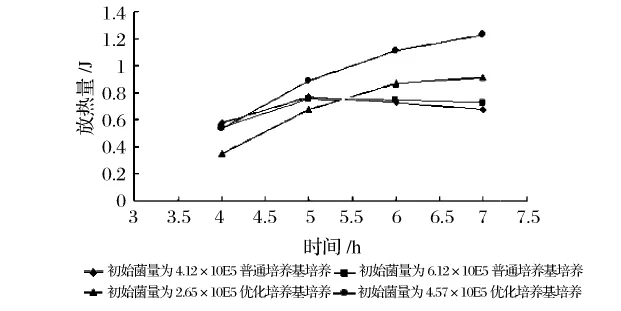
圖2 細(xì)菌在不同培養(yǎng)基中生長熱效應(yīng)的比較
2.2 細(xì)菌前期活化時間對其生長放熱的影響
細(xì)菌活化過程即細(xì)菌恢復(fù)性培養(yǎng),該過程可使細(xì)菌恢復(fù)至良好的生長狀態(tài),這對后面的量熱實驗成敗至關(guān)重要。低溫長時間保藏的菌種生理上處于休眠期,因此在量熱實驗前需對其進(jìn)行活化,從而將細(xì)菌開始放熱時間提前,并增大累積熱信號值。活化時間的長短與活化效果緊密相關(guān)。不同活化時間對量熱實驗的影響如圖3所示。從圖3可見,細(xì)菌活化24 h后放熱狀態(tài)達(dá)到最佳,出現(xiàn)特征性雙峰,重現(xiàn)性高。而活化12 h細(xì)菌在平板中的生長情況不佳,活性不足,未能出現(xiàn)預(yù)計的放熱峰,但在4~5 h波動較大,說明在此區(qū)間已處于對數(shù)生長期,但放熱不均勻,波動大;活化時間為36、48 h的細(xì)菌在制成的菌懸液中出現(xiàn)抱團現(xiàn)象,不易溶解。雖活化時間為36 h的細(xì)菌出現(xiàn)放熱峰,但已處于生長末期,放熱量少。活化36 h和48 h的細(xì)菌放熱曲線無明顯規(guī)律,未出現(xiàn)特征性雙峰,且重現(xiàn)性低,可能是活化時間過長,導(dǎo)致大部分細(xì)菌衰退死亡和分解代謝出一些不利于細(xì)菌生長的物質(zhì),影響細(xì)菌生長放熱[11-13]。
2.3 初始細(xì)菌總數(shù)與放熱量的關(guān)系
要將微量熱法成功應(yīng)用于食品中細(xì)菌的快速定量檢測,應(yīng)能保證使菌體在較短的時間內(nèi)產(chǎn)生較大的熱響應(yīng)值。實驗中比較了不同數(shù)量的細(xì)菌生長不同時間后所產(chǎn)生的熱效應(yīng),結(jié)果如圖4、圖5所示。從圖4中可看出,隨著測熱時間的延長,菌體累積熱效應(yīng)越大,生長5 h的放熱量明顯高于4 h,這可能是由于5 h前菌體處于對數(shù)生長期,生長活動旺盛;5 h后放熱量增幅越來越小,說明菌體可能處于穩(wěn)定期和衰亡期,這一點從熱譜圖(圖3.b)中也可以看出來。由圖5可知,對不同初始菌量的菌體而言,測定其4 h或5 h的累積熱效應(yīng)值與細(xì)菌總數(shù)間呈現(xiàn)了較好的線性關(guān)系,特別是4 h的放熱量與細(xì)菌總數(shù)之間的線性關(guān)系R2值可達(dá)0.966 1。這間接印證了該時期菌體生長穩(wěn)定,熱效應(yīng)持續(xù);而測量6 h或7 h的熱量值,發(fā)現(xiàn)細(xì)菌總數(shù)和熱效應(yīng)間已無明顯的變化規(guī)律,這可能是由于此時的熱效應(yīng)不僅包括菌體的生長熱,還包括菌體自溶、菌體代謝產(chǎn)物對自身的抑制作用等其他影響因素。在每次試驗結(jié)束后,取出菌液進(jìn)行平板計數(shù),得到細(xì)菌在循環(huán)池內(nèi)4~7 h的生長情況,結(jié)果也證明細(xì)菌在4~7 h內(nèi)菌數(shù)增長緩慢,甚至減少。其原因可能是循環(huán)池內(nèi)培養(yǎng)基中氧氣耗盡與菌體生長競爭抑制作用導(dǎo)致的。因此,選擇測熱時間為4 h能較好體現(xiàn)細(xì)菌總數(shù)與放熱量的對應(yīng)關(guān)系。

圖3 不同活化時間的細(xì)菌生長熱譜圖

圖4 測熱時間與放熱量的關(guān)系

圖5 不同細(xì)菌總數(shù)與放熱量的關(guān)系
2.4 放熱標(biāo)準(zhǔn)曲線的建立
通過以上對測熱條件的優(yōu)化實驗,選擇細(xì)菌活化時間24小時,然后將菌體接種于優(yōu)化培養(yǎng)基中導(dǎo)入微量熱儀循環(huán)池,測定菌體4 h內(nèi)的生長熱效應(yīng),并將熱量值與初始細(xì)菌總數(shù)一一對應(yīng),即得到細(xì)菌總數(shù)的計數(shù)標(biāo)準(zhǔn)曲線,如圖6所示。處理結(jié)果表明:若對該曲線進(jìn)行二次回歸擬合,得到的二次回歸曲線y=-7.8×10-7x2+0.001 3x+0.100 8(r2=0.942 4)的擬合關(guān)系并不好;若作一段式線性擬合y=0.000 9x+0.114 1(r2=0.936 1),擬合關(guān)系也不佳;但對該曲線進(jìn)行分段線性擬合,如圖6所示,AB段的擬合曲線為y=0.003 6x+0.043 6(r2=0.969 6),BC段的為y=0.000 8x+0.180 8(r2=0.986 6),由此可見分段線性擬合后各段之間的線性關(guān)系良好,因此可根據(jù)其放熱量并采用分段標(biāo)準(zhǔn)曲線處理方式來計算對應(yīng)的細(xì)菌總數(shù)。
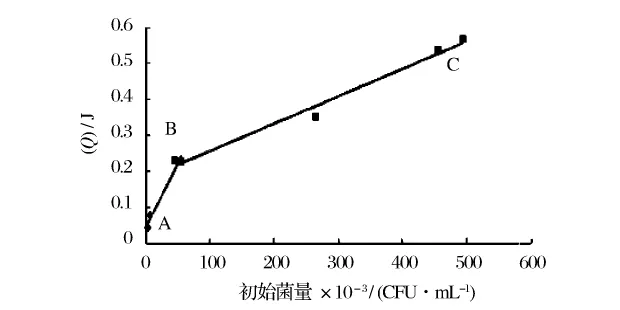
圖6 初始菌數(shù)與放熱量之間的標(biāo)準(zhǔn)曲線
2.5 確認(rèn)實驗
利用微量熱法對2份未知濃度的菌懸液進(jìn)行細(xì)菌總數(shù)檢測,并與傳統(tǒng)的平板計數(shù)法結(jié)果比對,結(jié)果如表1所示。由表1可知,2種測定方法所得結(jié)果之間的誤差小于10%(分別為7.76%和9.78%),F(xiàn)檢驗結(jié)果表明該差異不顯著,由此說明該標(biāo)準(zhǔn)曲線具有實際應(yīng)用價值。特別值得指出的是,該標(biāo)準(zhǔn)曲線提供了103~106CFU/mL范圍內(nèi)的初始菌量的熱量值,可以滿足大多數(shù)實際食品樣品中細(xì)菌總數(shù)的檢測要求。但若細(xì)菌總數(shù)更小,由于能檢測到的熱信號較小,并易受到周圍環(huán)境和儀器精度等因素的影響,應(yīng)該考慮通過其他方式將其熱信號進(jìn)一步放大才能滿足檢測的要求,這有待于進(jìn)一步的研究。

表1 標(biāo)準(zhǔn)曲線驗證結(jié)果
3 結(jié)論
本試驗在已篩選得到醬牛肉優(yōu)勢菌的基礎(chǔ)上,對牛肉中的細(xì)菌總數(shù)微量熱法快速測定實驗條件進(jìn)行了優(yōu)化,優(yōu)化后的實驗條件可用于細(xì)菌總數(shù)的實測,并與傳統(tǒng)的平板計數(shù)法結(jié)果進(jìn)行比較。結(jié)果表明,細(xì)菌活化時間、測熱培養(yǎng)基的選擇及測熱時間長短均對量熱法測定結(jié)果影響顯著,選擇24 h的菌體活化時間,并在優(yōu)化培養(yǎng)基中培養(yǎng)4h后計算菌體生長熱效應(yīng)值,在103~106CFU/mL范圍內(nèi)能較好地反映細(xì)菌總數(shù)值;且微量熱法所得結(jié)果與常規(guī)平板計數(shù)法基本相符;重要的是,微量熱法能大大減少檢測時間,由常規(guī)的48 h減少為4 h。
[1]曾慶梅,張冬冬,楊毅.食品微生物安全檢測技術(shù)[J].食品科學(xué),2007,28(10):632-637.
[2]王莎莎,食品微生物快速檢測技術(shù)的研究進(jìn)展[J].生命科學(xué)儀器,2009(8):60-63.
[3]宋宏新,馬娜.食品中病原微生物快速檢測方法研究進(jìn)展[J].食品研究與開發(fā),2005,26(2):127-129.
[4]Higuera-Guisset J,Rodríguez-Viejo J,Chacón M,et al.Calorimetry of microbial growth using a thermopile based microreactor[J].Thermochimica Acta,2005,427:187-191.
[5]Mohammad Russel,Jun Yao.Different Technique of Microcalorimetry and Their Applications to Environmental Sciences:A Review[J].Journal of American Science,2009,5(4):194-208.
[6]張有民,王保懷,楊森森.生命科學(xué)、醫(yī)學(xué)食品專用高靈敏度微量儀Micro DSC III介紹及應(yīng)用Ⅱ[J].現(xiàn)代科學(xué)儀器,2001(2):39-43.
[7]Wang F.Microcalorimetric measurements of the microbial activities of single-and mixed-species with trivalent iron in soil[J].Ecotoxicology and Environmental Safety,2009,72:128-135.
[8]劉蓮,林貴梅,邵偉.微量熱技術(shù)在微生物和細(xì)胞研究方面的應(yīng)用[J].藥物生物技術(shù),2010(1):79-82.
[9]Marison I,Liu J S,Ampuero S,et al.Biological reaction calorimetry:development of high sensitivity bio-calorimeters[J].Thermochimica Acta,1998,309:157-173.
[10]Johannessen E A,Weaver J M R,Cobbold P H,et al.Heat conduction nanocalorimeter for Pi-scale single cell measurements[J].Applied Physics Letters,2002,80(11):2 029-2 031.
[11]Maskow T,Babel W.A calorimetrically based method to convert toxic compounds into poly-3-hydroxybutyrate and to determine the efficiency and velocity of conversion[J].Applied Microbiology and Biotechnology,2001,55:234-238.
[12]Kabanova N,Kazarjan A,Stulova I,et al.Microcalorimetric study of growth of Lactococcus lactis IL1403 at different glucose concentrations in broth[J].Thermochimica Acta,2009,496:87-92.
[13]Guan Y,Evans P M,Kemp R B.Specific heat flow rate:an on-line and potential control variable of specific metabolic rate in animal cell culture that combines microcalorimetry with dielectric spectroscopy[J].Biotechnology and Bioengineering,1998,58:464-477.
Study on Rapid Detection Method of the Microbial Biomass in Food by Microcalorimetry
Nong Wei-liang,Guan Xiao,Xu Fei
(School of Medical Instrument and Food Engineering,University of Shanghai for Science and Technology,Shanghai 200093,China)
In this paper,the thermogram with respect to the growth of bacteria in beef was determined with microcalorimeter.The results indicated that the total amount of bacteria could be calculated by thermal effect of bacteria growth in the range of 103~106CFU/mL under the condition of active time 24 h and incubation for 4 h in optical culture.And there was no significant difference between the results obtained by the method of microcalorimetry and platecount.
microcalorimetry,microbial biomass,rapid detection
碩士研究生(徐斐教授為通訊作者)。
*上海市教委科研創(chuàng)新項目(08ZZ77),上海市研究生創(chuàng)新基金項目(JWCXSL0902),上海高校選撥培養(yǎng)優(yōu)秀青年教師科研專項基金(slg-07047)
2010-01-25,改回日期:2010-08-23

