響應曲面法優化玉米胚中谷胱甘肽提取工藝條件
徐麗萍 楊春華 王 鑫
(哈爾濱商業大學食品工程學院,哈爾濱 150076)
響應曲面法優化玉米胚中谷胱甘肽提取工藝條件
徐麗萍 楊春華 王 鑫
(哈爾濱商業大學食品工程學院,哈爾濱 150076)
還原型谷胱甘肽(GSH)是一種生物活性三肽,在生物體內具有多種重要的生理功能,在臨床醫藥、食品工業及有關生物研究領域都有著廣泛的用途。以玉米胚為原料,對水提法提取玉米胚中還原型谷胱甘肽的工藝進行研究,利用 Box-Behnken的中心組合設計原理及響應面法(RS M)分析建立二次回歸模型,對提取時間、pH值和提取溫度等因素優化組合,確定水提法提取玉米胚中還原型谷胱甘肽的最佳工藝條件為:提取時間為 19.6 min、pH 3.7、提取溫度為 91.7℃,玉米胚中還原型谷胱甘肽的提取率為 0.145%。
玉米胚 還原型谷胱甘肽 響應曲面 提取
谷胱甘肽是一種三肽(L-γ-谷氨酸 -L-半胱氨酸 -甘氨酸)化合物,屬于含有巰基的小分子活性肽,可分為氧化型和還原型兩大類[1]。其中還原型谷胱甘肽具有生理活性,而生物體內的氧化型谷胱甘肽需還原才能發揮其重要的生理功能。谷胱甘肽廣泛存在于自然界中,動物肝臟、酵母和小麥胚芽中都有豐富的谷胱甘肽,人和動物的血液中也含有較多的谷胱甘肽,而植物組織中的谷胱甘肽含量則較低。其中玉米胚中含有還原型谷胱甘肽 100~200 mg/100 g[2]。谷胱甘肽在許多重要的生物學現象中起著直接或間接的作用,如抗自由基和保護細胞、解毒、促進氨基酸轉運、保護胃腸黏膜、提高免疫力、參與蛋白質合成與降解、調節基因的復制、轉錄、調節細胞生長、維持細胞正常功能、參與膽紅素代謝、促進膽酸代謝,減輕出血傾向等[3-4],因此谷胱甘肽被廣泛應用于醫藥及保健食品的生產[5-7]。
1 材料與方法
1.1 材料與試劑
玉米胚:哈爾濱北農集團。蒸餾水、氫氧化鈉、鹽酸等試劑均為分析純。
1.2 主要儀器
SJ260C多功能食品攪拌器:順德蘭譜電器制造有限公司;ALC-1100.2電子分析天平:北京賽多利斯儀器系統有限公司;DK-98電子恒溫水浴箱、DHG-9123A臺式電熱恒溫鼓風干燥機:上海一恒科技有限公司;R-205旋轉蒸發儀:上海申勝生物技術有限公司;TU-1900雙光束紫外分光光度計:北京普析通用儀器有限責任公司;KQ-500VDE雙頻數控超聲波清洗器:昆山市超聲儀器有限公司;TG16高速離心機:長沙英泰儀器有限責任公司。
1.3 試驗方法
1.3.1 玉米胚中還原型谷胱甘肽提取工藝優化
準確稱取 10 g脫脂粉碎的玉米胚,加入適量蒸餾水后采用超聲波破壁于水溶液中進行水提[8-14],冷卻過濾,離心得上清液,冷凍干燥后得到還原型谷胱甘肽粗品 (GSH)[15-16]。以 GSH得率為指標,在單因素試驗的基礎上,采用響應面優化試驗確定最佳工藝參數。
1.3.2 GSH含量的測定
在 0.1 mol/L氫氧化鈉溶液中的 GSH在220 nm處有較穩定的吸收峰,且線性關系良好,以 GSH質量濃度(mg/mL)為橫坐標,最大吸收波長下的吸光值為縱坐標,制作標準工作曲線[17]。測定的標準曲線回歸方程為:y=18.111x+0.010 6,R2=0.998 5,式中,y為吸光度,x為質量濃度/mg/L。
取 GSH提取液 1 mL于含 24 mL的氫氧化鈉容量瓶中,搖勻后在吸光度 220 nm處進行比色測定。再根據標準曲線查找所測吸光度對應的 GSH質量濃度,計算出 GSH的含量[13]。

1.3.3 試驗設計
采用Box-Behnken模型,以提取時間、pH值和提取溫度為影響玉米胚 GSH為主要的考察因子 (自變量),分別以 X1、X2、X3表示,并以 +1、0、-1分別代表自變量的高、中、低水平,按方程 xi=(Xi-Xo)/X對自變量進行編碼[18]。其中 xi為自變量的編碼值, Xi為自變量的真實值,Xo為試驗中心點處自變量的真實值,X為自變量的變化步長[19],因子編碼及水平見表1。

表 1 Box-Behnken實驗設計因素水平及編碼
2 結果與分析
采用多元回歸分析,擬合二次多項式回歸模型的Box-Behnken設計見表 2。
2.1 回歸模型的建立及其顯著性檢驗
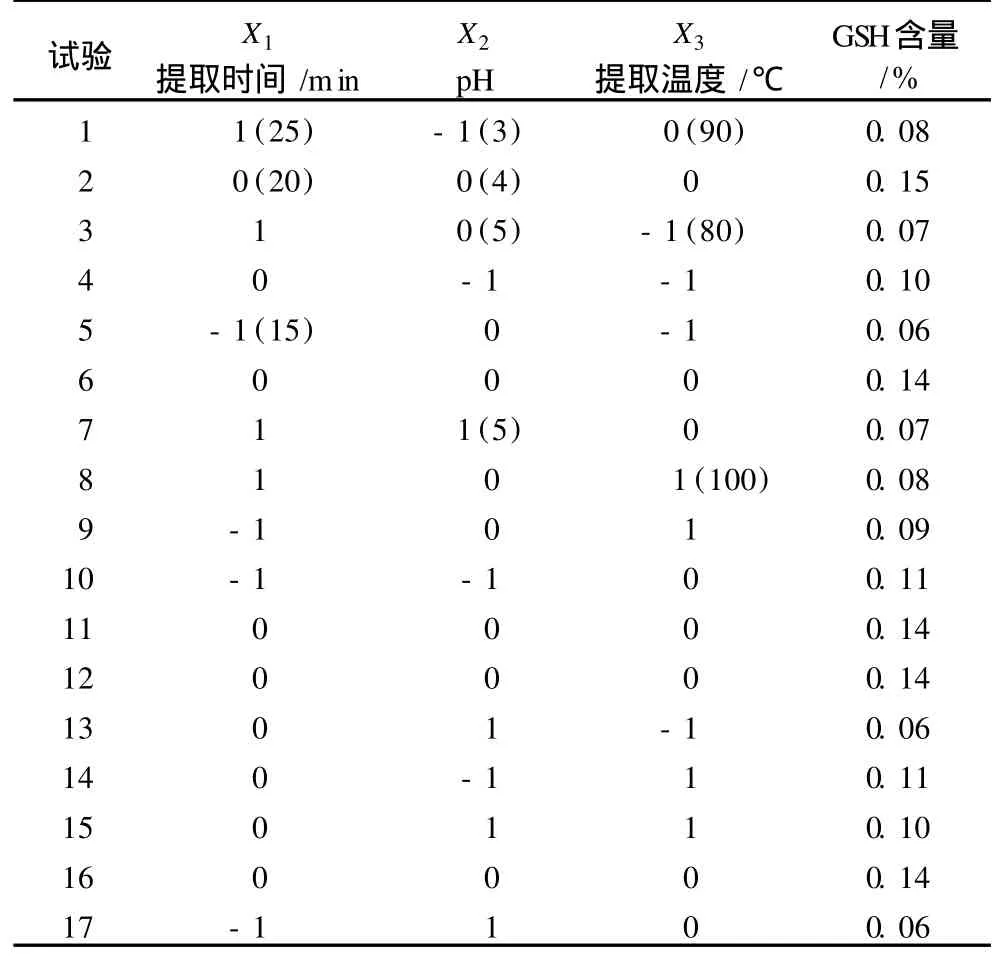
表2 試驗設計與結果
利用 Design Expert 7.1.3軟件對表 2試驗數據進行多元回歸擬合,獲得水提法提取玉米胚中 GSH的含量對自變量提取時間 (x1)、pH(x2)和提取溫度(x3)的二次多項回歸模型方程為:Y=0.14-2.5× 10-3x1- 0.014x2+0.011x3+0.01x1x2-5×10-3x1x3+7.5×10-3x2x3-0.04x12-0.022 x22-0.027x32,式中 Y為玉米胚中 GSH提取值,x1、x2、x3分別為 3個自變量的編碼值[20]。


表3 響應面模型方差分析表
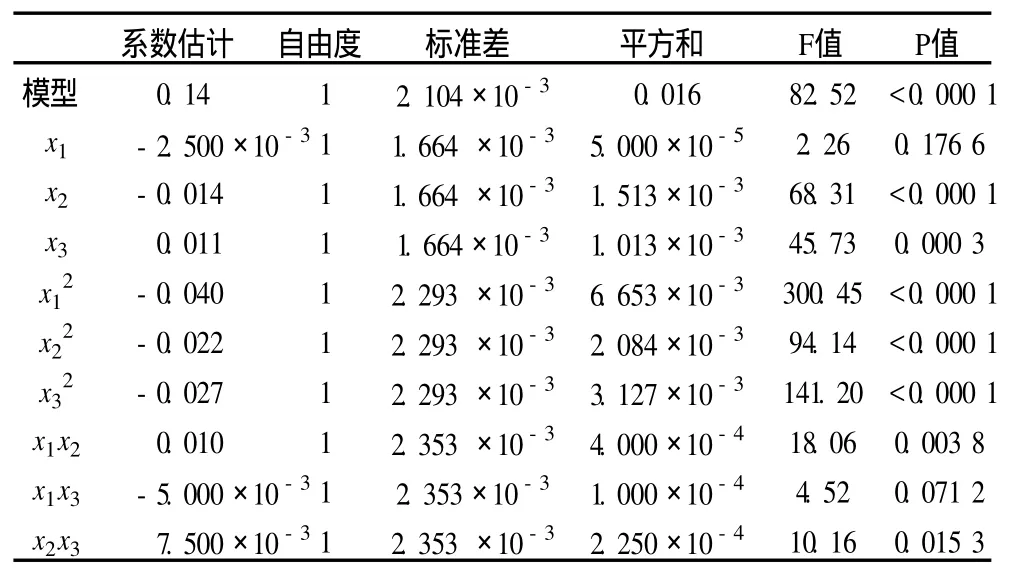
表4 回歸方程系數顯著性檢驗
2.2 水提取玉米胚 GSH的響應面分析與優化
多元回歸方程的響應面及其等高線圖解見圖 1~圖 3。通過該組動態圖即可對任何兩因素交互影響水溶液提取玉米胚 GSH的量效應進行分析與評價,并從中確定最佳因素水平范圍。
圖 1顯示了在提取時間為最佳值 19.6 min時, pH與提取溫度對水提法提取玉米胚中 GSH的交互影響效應。從其等高線圖可以直觀地看出此兩因素的交互作用顯著,隨著pH值增大,GSH的提取量也逐步提高。當 pH值較低時,GSH的提取量隨 pH值增大而增大,但當 pH值超過 4時,GSH的提取量隨 pH值增大而減小。由圖 1可知,在試驗水平范圍內,提取溫度和 pH值分別在 85~95℃和 2.5~3.5的范圍內,GSH的提取量可以達到試驗中的最大值。
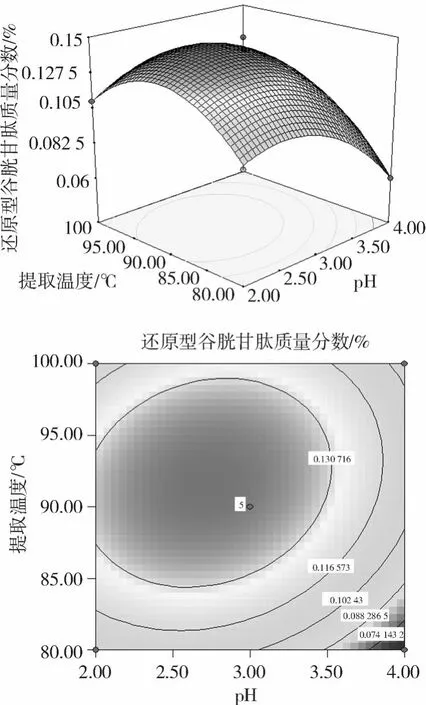
圖1 pH、提取溫度及其交互作用對水溶液提取玉米胚GSH的響應面和等高線圖
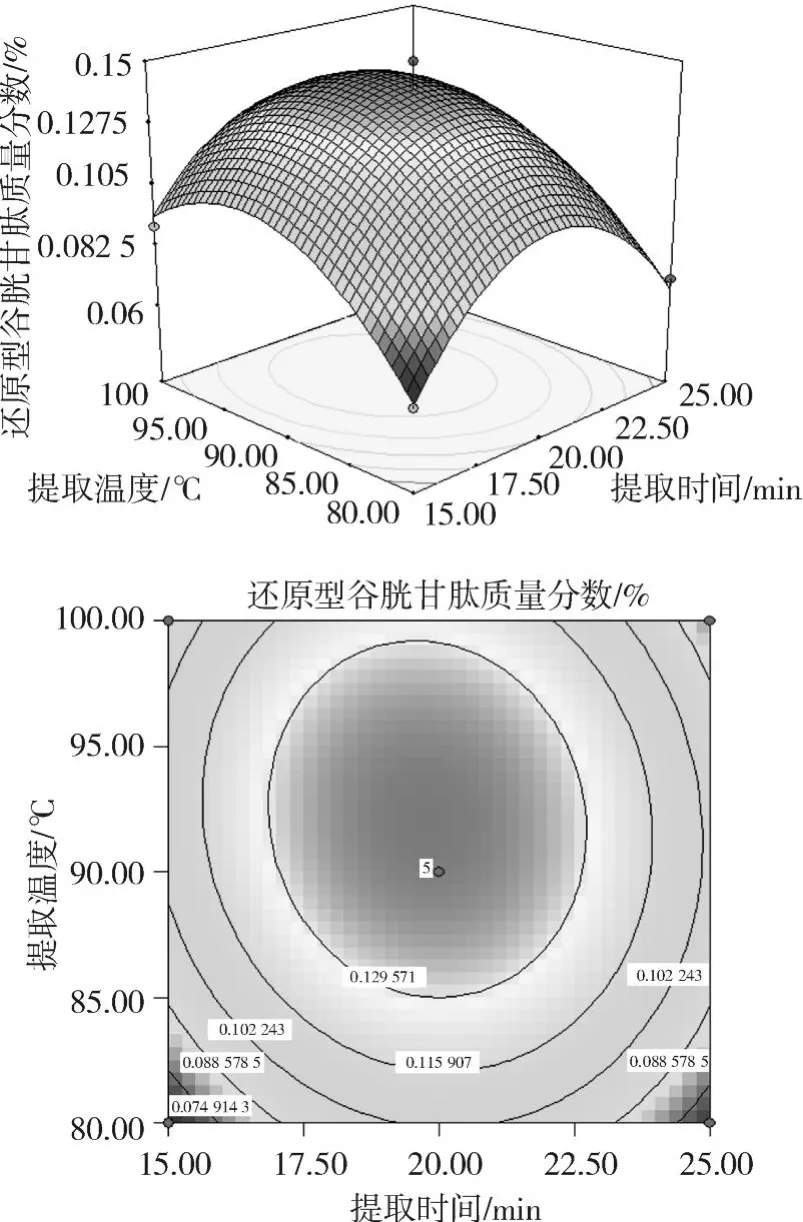
圖 2 提取時間、提取溫度及其交互作用對水溶液提取玉米胚 GSH的響應面和等高線圖
圖 2顯示了在 pH為最佳值 3.7時,提取時間與提取溫度對水提法提取玉米胚中 GSH的交互影響效應。從其等高線圖可以直觀地看出兩因素的交互作用不顯著;從圖 2可以看出,在試驗水平范圍內,提取溫度對 GSH的提取影響不大,當提取時間較短時, GSH提取量隨時間的延長而增大,但當提取時間超過 25 min時,GSH提取量隨時間的延長而減小。

圖 3 提取時間、pH及其交互作用對水溶液提取玉米胚GSH的響應面和等高線圖
圖 3顯示了在提取溫度為最佳值 91.7℃時,提取時間與 pH對水提法提取玉米胚中 GSH的交互影響效應。從其等高線圖可以直觀地看出此兩因素的交互作用較顯著;從圖 3可以看出,在試驗水平范圍內,提取時間對 GSH的提取影響不大,pH值對 GSH的提取量有較大影響,隨著 pH值的增大 GSH提取量也增大。
采用優化后的工藝進行谷胱甘肽的提取,谷胱甘肽的提取率為 0.145%。
3 結論
利用響應曲面優化設計 (RS M)建立了以玉米胚為原料提取 GSH的二次多項數學模型,經檢驗證明是合理可靠的,同時利用模型的響應曲面及其等高線對影響提取的關鍵因子及其相互作用進行探討,優化出玉米胚中 GSH提取的工藝參數為提取時間19.6 min、pH 3.7、提取溫度 91.7℃,玉米胚芽中谷胱甘肽的提取率為 0.145%。
[1]袁爾東,鄭建仙.功能性食品基料——谷胱甘肽的研究進展[J].食品與發酵工業,1999,25(5):52-57
[2]劉宜鋒,曹新志.新型食品添加劑——谷胱甘肽[J].福州大學學報:自然科學版,2002(30):714-721
[3]JamesL Holly,MD.Glutathione and oxidative stress-part I[J].MedicalAssociates,LLP
[4]Danyelle M Townsend,Kenneth D Tew,Haim Tapiero.The importance of glutathione in human disease[J].Biomedicine &Phar macotherapy,2003(57):145-155
[5]卓肇文.還原型谷胱甘肽的功能與應用 [J].氨基酸雜志,1989,1:41-42
[6]盧薇.谷胱甘肽的化學與醫療作用[J].化學教育,2004, (1):7-12
[7]ParrisM.Kidd.Glutathione:systemic protectant against oxi2 dative and free radical damage[J].Alternative Medicine Re2 view,1997,2(3):155-176
[8]Xiong ZQ,GuoMJ,Guo YX,et al.Efficient extraction of in2 tracellular reduced glutathione from fermentation broth of sac2 charomyces cerevisiae by ethanol[J],Bioresource Technolo2 gy,2008,17:1011-1014
[9]Guo BL,Xian YL,Guo CD,et al.A new strategy to enhance glutathione production by multiple H2O2-induced oxidative stresses in Candida utilis[J].Bioresource Technology,2008 (100):350-355
[10]Yin L,Gong YW,Jian C.Glutathione:a review on biotech2 nological production[J].Appl Microbiol Biotechnol,2004 (66):233-242
[11]范崇東,王淼,徐榕榕.熱水提取酵母中谷胱甘肽的條件優化[J].食品工業科技,2002(2):132-145
[12]曹新志.谷胱甘肽的分離和干燥方法[J].廣州食品工業科技,1996,12(2):44-45
[13]張艷榮,陳麗娜,劉婷婷,等.玉米谷胱甘肽提取技術的研究[J].食品科學,2007,28(7):232-236
[14]劉國琴,陳潔,趙雷,等.小麥胚芽中谷胱甘肽提取方法探討及工藝條件優化[J].河南工業大學學報:自然科學版,2007,28(2):1-5
[15]陳儉梅,周林.幾種谷胱甘肽的檢測方法[J].山東食品發酵,2007,3(146):26-29
[16]樊月平,于健春,余躍,等.谷胱甘肽的生理意義及其各種測定方法比較、評價[J].中國臨床營養雜志,2003,11 (2):136-139
[17]楊培惠,齊劍英,馮德雄,等.谷胱甘肽的應用及其檢測方法[J].中國生化藥物雜志,2002,23(1):52-54
[18]袁志發,周靜芋.試驗設計與分析 [M].北京:高等教育出版社,2000:381
[19]Douglas CMontgomery.實驗設計與分析[M].北京:中國統計出版社,1998:589-592
[20]周紀薌.實用回歸分析方法[M].上海:上海科學技術出版社,1990:77-79.
Condition Optimization of Extracting Glutathione from Corn Germ by Response SurfaceMethodology
Xu Liping Yang Chunhua Wang Xin
(College of Food Engineering,Harbin University of Commerce,Harbin 150076)
Glutathione is one ofmajor non-protein thiol compounds.GSH,the reduced form of glutathione,is widely used in many fields,such as clinicalmedicine,food industry and biological research.To optimize the technol2 ogy ofwater extraction of corn germ glutathione,corn germ was used as raw material,Box-Behnken central compos2 ite design and the response surface method were applied with three influencing factors including extraction time,pH value and extraction temperature.Results:The established opti mum extraction conditions are extraction ti me 19.6 min,pH 3.7,and extraction temperature 91.7℃.The yield of corn germ glutathione is 0.145%.
corn germ,GSH,response surface methodology,extraction
S38 文獻標識碼:A 文章編號:1003-0174(2010)05-0015-04
黑龍江省自然科學基金(C200813)
2009-05-19
徐麗萍,女,1963年出生,教授,食品營養與安全

