交聯殼聚糖樹脂對Ni(Ⅱ)的吸附性能
黨明巖,賈秀紅,趙春英
(沈陽理工大學環境與化學工程學院,遼寧沈陽 110168)
交聯殼聚糖樹脂對Ni(Ⅱ)的吸附性能
黨明巖,賈秀紅,趙春英
(沈陽理工大學環境與化學工程學院,遼寧沈陽 110168)
以環硫氯丙烷為交聯劑,合成了交聯殼聚糖樹脂,研究了該樹脂對Ni(Ⅱ)的吸附特性及吸附動力學。結果表明,當溶液pH為7~8時,Ni(Ⅱ)去除率較高;在吸附120min時,Ni(Ⅱ)去除率可達到99.1%;當ρ初始(Ni2+)增至60 mg/L時,樹脂接近飽和吸附;樹脂在20~40℃時以物理吸附為主。對樹脂吸附動力學的研究表明,吸附過程符合一級動力學模型,液膜擴散為吸附過程的速率控制步驟。
殼聚糖;鎳;吸附動力學
引 言
殼聚糖是自然界大量存在的甲殼素的脫乙酰產物,為鏈狀大分子,含有大量的羥基,氨基,可借助氫鍵,也可借助鹽鍵形成具有類似網狀結構的籠形分子,進而對金屬離子產生螯合作用,因此能有效地吸附或捕集溶液中的金屬離子。殼聚糖的機械強度可通過適當的化學改性來增強,常用作螯合吸附劑,用于鋅、鉑、銅等重金屬離子的去除或分離[1~3]。
電鍍廢水中往往含有多種重金屬離子,其中鎳離子會對生物體產生極大危害。去除水體中的鎳可采用化學吸附法、電解法、螯合吸附法等方法,其中螯合吸附法具有去除率高、無二次污染、污泥便于回收、設備要求簡單等優點,但常用的螯合吸附劑的成本偏高。本文基于成本低廉的天然產物殼聚糖,合成了新型的螯合吸附樹脂,研究了其對Ni(Ⅱ)的吸附性能。
1 實驗部分
1.1 儀器與試劑
TAS-990F原子吸收分光光度計;PHS-3C型精密酸度計;THZ-82恒溫振蕩器。
殼聚糖(脫乙酰度為95.7%,黏度為185mPa· s);高純鎳絲;其它試劑均為分析純。
1.2 實驗方法
1.2.1 交聯劑的制備
將15.6mL環氧氯丙烷和50mL的蒸餾水在冰浴冷卻后加入16.8g硫脲,攪拌反應4 h,將反應液倒入分液漏斗中靜置分層,收集下層有機相,蒸餾,收集85℃餾分,即為交聯劑(環硫氯丙烷),在0~5℃下保存備用[4]。
1.2.2 交聯殼聚糖樹脂的制備
用1%的醋酸水溶液將殼聚糖溶脹至半透明膠狀,與過量的硫酸鎳溶液混合,在20℃下恒溫振蕩2h,抽濾后干燥。取干燥后的產品懸浮于50mL蒸餾水中,加入6mL環硫氯丙烷進行交聯反應,在攪拌下再滴加適量的NaOH溶液,使之在堿性條件下反應15h。將反應產物過濾洗滌至中性,再用乙醇清洗,在60℃干燥至質量恒定,得交聯殼聚糖樹脂。
1.2.3 Ni(Ⅱ)標準貯備液的配制
準確稱取高純鎳絲1.000g,加硝酸10mL,用水浴加熱使其完全溶解,蒸干后,加入5mL鹽酸,再蒸干,用去離子水稀釋至1 000mL,貯備液中ρ(Ni2+)為1 000mg/L。
1.2.4 樹脂對Ni(Ⅱ)的靜態吸附
準確稱量一定量的交聯殼聚糖,加入某一初始質量濃度的Ni(Ⅱ)溶液,調節其pH,在給定的溫度下置于恒溫振蕩器中振蕩吸附,定時取樣,離心分離后取上清液,用原子吸收分光光度計測定其吸光度[5],通過預先測定的工作曲線求出吸附后溶液中的ρ(Ni2+),并按下式計算出Ni(Ⅱ)的去除率及樹脂的吸附量。
樹脂吸附量按Г=(ρo-ρ)V/m計算,Ni(Ⅱ)去除率按η=(ρo-ρ)/ρo計算。
式中:ρ0、ρ分別為Ni(Ⅱ)初始質量濃度和吸附后溶液中殘留的Ni(Ⅱ)質量濃度,mg/g;V為溶液體積,mL;m為干樹脂的質量,g。
2 結果與討論
2.1 溶液pH對Ni(Ⅱ)去除率的影響
稱取0.03g樹脂,按1.2.4的實驗方法,去除率η與溶液pH的關系如圖1所示。
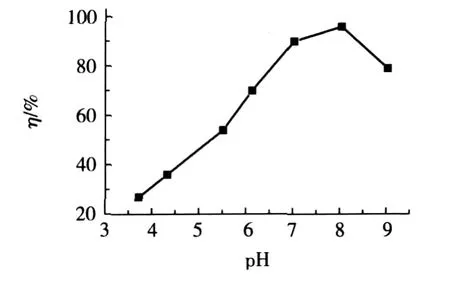
圖1 pH對Ni(Ⅱ)去除率的影響
由圖1可見,隨著溶液pH的增加,Ni(Ⅱ)去除率也會增加,達峰值后pH繼續增加時,去除率又隨之下降。pH較小時,樹脂分子鏈上的-NH2結合了H+,形成帶正電荷的-NH3+,削弱了螯合金屬離子的能力,同時由于樹脂分子表面帶正電荷,與帶同種電荷的Ni(Ⅱ)產生靜電斥力,也會使螯合機會減小。另外,H+與Ni(Ⅱ)存在著競爭吸附,從而使樹脂對Ni(Ⅱ)的吸附量下降。而當溶液pH過大時,則會出現Ni(OH)2沉淀,影響樹脂對Ni(Ⅱ)的吸附,因而酸度過低會導致吸附量降低。pH為7~8時Ni(Ⅱ)的去除率最高。
2.2 吸附時間對Ni(Ⅱ)去除率的影響
吸附時間對Ni(Ⅱ)去除率的影響如圖2所示。
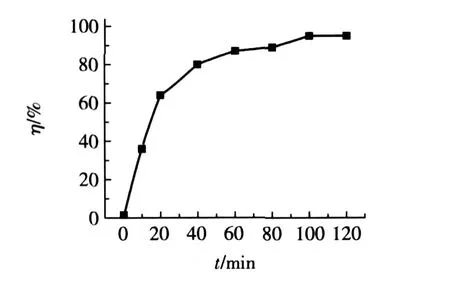
圖2 吸附時間對Ni(Ⅱ)去除率的影響
由圖2可見,吸附過程在初始階段進行得較快,因為Ni(Ⅱ)主要被吸附在樹脂顆粒的外表面,吸附過程容易進行,因而吸附速率較大,在30min時,Ni(Ⅱ)去除率已達到71.2%。隨著吸附過程的進行,Ni(Ⅱ)開始沿樹脂的孔隙向內部遷移、擴散,內擴散成為吸附速率的控制步驟,因此吸附速率逐漸降低。溶液中Ni(Ⅱ)的質量濃度越來越小,在120min時,質量濃度推動力趨近于零,吸附趨于平衡,這時樹脂對Ni(Ⅱ)的去除率達99.1%。
2.3 ρo[Ni(Ⅱ)]對吸附量Г的影響
ρo[Ni(Ⅱ)]對吸附量Г的影響如圖3所示。
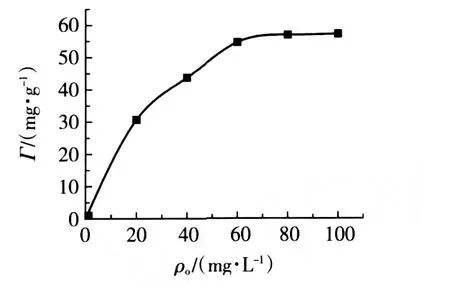
圖3 ρo[Ni(Ⅱ)]對樹脂吸附量的影響
由圖3可見,隨著溶液中ρo[Ni(Ⅱ)]的增加,Ni(Ⅱ)的去除率逐漸增大,當ρo[Ni(Ⅱ)]增至60 mg/g時,去除率增加趨勢減慢,說明此時吸附過程趨近飽和,再增加ρo[Ni(Ⅱ)]對去除率影響不大。
2.4 溫度對Ni(Ⅱ)吸附量的影響
樹脂吸附量與溫度之間的關系如圖4所示。
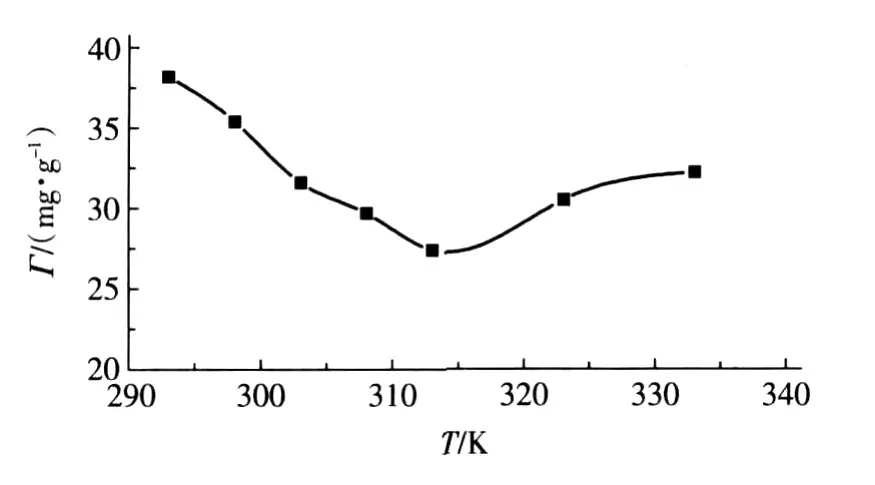
圖4 溫度對樹脂吸附量的影響
由圖4可見,在熱力學溫度為313~333K時,Г隨溫度升高而增加,因為升高溫度時,溶液中離子運動速度加快,樹脂活性增加,有利于吸附過程進行,因此樹脂吸附量增大。而在293~313K的溫度范圍內,吸附量隨溫度升高而下降,這可能是因為在這一溫度范圍內樹脂對Ni(Ⅱ)的吸附機理是以物理吸附為主,因為物理吸附過程是放熱過程,根據吸附平衡理論,溫度升高不利于吸附。
2.5 吸附動力學
不同溫度下,樹脂吸附量與吸附時間的關系曲線如圖5所示。
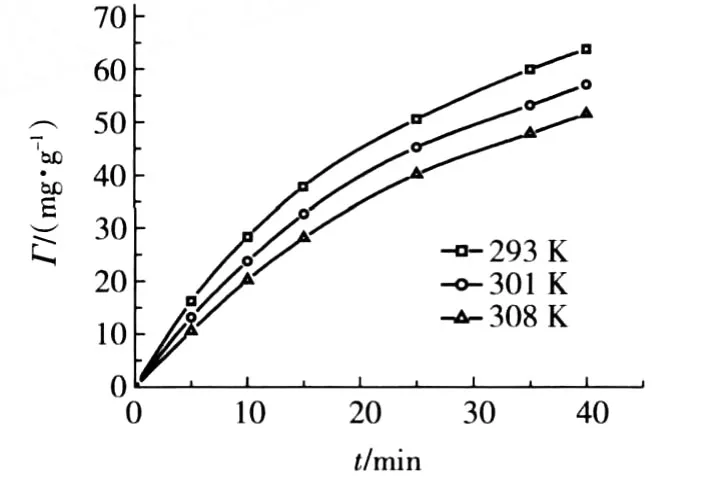
圖5 樹脂吸附Ni(Ⅱ)的動力學曲線
由圖5可見,在不同溫度下,樹脂吸附量隨時間增長的趨勢相近,都是在初始階段快速吸附,到一定時間后吸附趨近平衡。采用一級動力學方程對吸附動力學數據進行線性擬合[6]。
一級動力學模型為
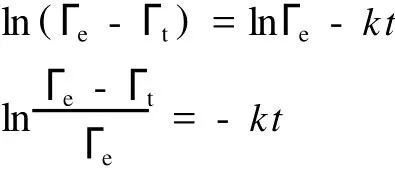
式中:t為吸附時間,min;Гt和Гe分別為t時刻和吸附平衡時的樹脂吸附量,mg/g;k為表觀吸附速率常數,min-1。
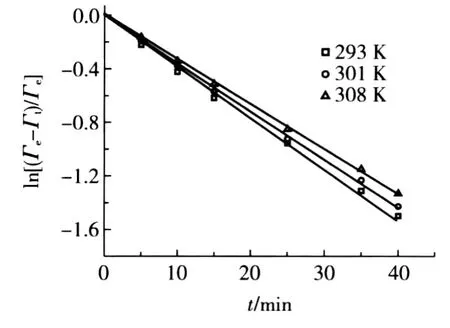
圖6 一級動力學方程擬合曲線
由圖6中不同溫度下的擬合直線的斜率可以分別求得其表觀吸附速率常數k,數據擬合的結果見表1。
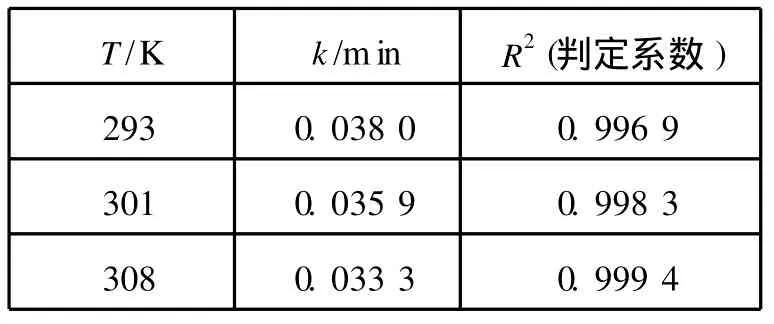
表1 吸附動力學參數
圖6中良好的線性關系以及表1中的判定系數R2>0.99,表明了一級吸附動力學方程來描述樹脂對Ni(Ⅱ)的吸附量隨時間的變化關系是合適的。這也表明液膜擴散為吸附過程的速率控制步驟[7]。
3 結 論
交聯殼聚糖樹脂對Ni(Ⅱ)有較好的吸附性能,溶液的pH、吸附時間、初始質量濃度、溫度等因素均對吸附過程有一定的影響。溶液pH對Ni(Ⅱ)的去除率影響較大,pH為7~8時,去除率較高;在30min時,樹脂對Ni(Ⅱ)的去除率可達到71.2%,在120min時,去除率可達99.1%;當ρo[Ni(Ⅱ)]增至60 mg/g時,樹脂接近飽和吸附;樹脂在20~40℃時以物理吸附為主。
對樹脂吸附動力學的研究表明,吸附過程符合一級動力學模型,液膜擴散為吸附過程的速率控制步驟。
[1] 丁萍,黃可龍,李桂銀.殼聚糖衍生物對Zn(Ⅱ)的吸
附動力學及機理研究[J].化學通報,2006,(7): 503-507.
[2] 黨明巖,張廷安,王娉.新型交聯殼聚糖樹脂顆粒對鉑的吸附行為[J].過程工程學報,2008,8(1):86-90.
[3] Juang Rueyshin,Wu Fengchin,Tseng Ruling.Adsorption removal of copper(Ⅱ)using chitosan from simulated rinse solutions containing chelating agents[J].Wat. Res.,1999,33(10):2403-2409.
[4] Tabushi I,Tamaru Y,Yoshida Z.A Mechanistic Study of the Acetolyses of 3-chloropropene Sulfide and 2-chloroethylMethyl Sulfide[J].Bull Chem Soc Japan,1974,47(6):1455-1459.
[5] 冒愛榮.火焰原子吸收光譜法測定鍍鉻液中的鎳[J].電鍍與精飾,2008,30(3):35-37.
[6] Ho Y S,Mckay G.The sorption of lead[Ⅱ〗ionson peat [J].Wat Res,1999,33(2):578-584.
[7] Boyd G E,Adamson A W,Myers L S.The exchange. adsorption of ions from aqueous solutions by organnic zeolitesⅡkinetics[J].J Am Chem Soc,1947,(69):2836-2848.
Adsorption performance of Crossli nked Chitosan Resi n for Nickle(II)ions
DANGMing-yan,J I A Xiu-hong,ZHAO Chun-ying
(School of Environmental&Chemical Engineering,Shenyang Ligong University,Shenyang 110168,China)
Crosslinked chitosan resin was synthesized using chloromethyl thiirane as crosslinking agent. The adsorption properties and the adsorption kinetics of the resin forNi(Ⅱ)were studied.Results show that the optimum pH value for the adsorption is bet ween 7 and 8;the adsorption rate can reach to 99.1% in 120 minutes’adsorption process;the adsorption reaches equilibration when the initial concentration of Ni(Ⅱ)is 60mg/L and the adsorption ismainly physisorbed at 20~40℃.Study on the adsorption kinetics shows that the adsorption follows the first-order kineticsmodel and liquid film diffusion is the control step.
chitosan;nickel;adsorption kinetics
X781.1
:A
1001-3849(2010)05-0008-04
2010-01-05
:2010-01-28
黨明巖(1975-),女,遼寧鐵嶺人,沈陽理工大學環境與化學工程學院講師,博士.

