人NPTX2真核表達載體的構建及穩定轉染細胞系的建立
張玲 高軍 龔燕芳 李兆申 吳洪玉 金晶 滿曉華
·論著·
人NPTX2真核表達載體的構建及穩定轉染細胞系的建立
張玲 高軍 龔燕芳 李兆申 吳洪玉 金晶 滿曉華
目的構建人神經元正五聚蛋白2(NPTX2)真核表達載體,轉染人胰腺癌細胞PANC1,建立穩定轉染的細胞系。方法通過雙酶切的方法獲得人NPTX2全長cDNA,利用NotⅠ和EcoRⅠ酶切位點將其插入到真核表達載體pcDNA3.1(+),經酶切和測序驗證后,用脂質體轉染法轉染PANC1細胞,通過G418篩選,建立穩定轉染的PANC1細胞,用實時定量PCR方法篩選NPTX2 mRNA高表達克隆。結果成功構建了pcDNA3.1(+)-NPTX2真核表達載體,并建立了穩定轉染的PANC1細胞,成功表達了目的基因。結論真核表達載體的構建和穩定轉染PANC1細胞系的建立為進一步研究NPTX2基因在胰腺癌細胞的作用奠定了良好的基礎。
胰腺腫瘤; NPTX2; 轉染; 細胞系
材料與方法
一、主要試劑
含人NPTX2全長cDNA的pReceiver-M15-NPTX2質粒購自廣州復能基因公司。質粒pcDNA3.1(+)和人胰腺癌細胞系PANC1為本實驗室保存。限制性內切酶EcoRⅠ和NotⅠ、T4 DNA連接酶購自TaKaRa公司;反轉錄試劑盒購自Fermentas公司;SYBR Green Master Mix購自TOYOBO公司;凝膠回收試劑盒購自維特潔公司;質粒抽提試劑盒購自北京博大泰克公司;LipofectamineTM2000為Invitrogen公司產品;G418購自Sigma公司;Trizol購自Invitrogen公司;SuperECL購自北京普利萊基因技術有限公司;兔抗人NPTX2多克隆抗體購自Protein Tech Group公司;小鼠抗人β-actin單克隆抗體購自Sigma公司;羊抗小鼠IgG購自GenScript公司;HRP標記的羊抗兔IgG購自上海普飛生物技術有限公司。
二、人NPTX2真核表達載體的構建
對pReceiver-M15-NPTX2和pcDNA3.1(+)質粒分別行EcoRⅠ、NotⅠ雙酶切。酶切后經瓊脂糖凝膠電泳分離、切割,回收獲取NPTX2片段(1326 bp)和pcDNA3.1(+)質粒大片段。經T4連接酶16℃過夜連接后轉化感受態E.coli DH5α細胞,氨芐青霉素(60 μg/ml)篩選培養,挑取陽性克隆,擴增后抽提質粒進行酶切和測序鑒定。
三、人NPTX2轉染PANC1細胞
PANC1細胞常規培養,待細胞融合至90%~95%時,應用LipofectamineTM2000將pcDNA3.1(+)和pcDNA3.1(+)-NPTX2轉染PANC1細胞。48 h后在含G418(1000 μg/ml)的培養基中加壓篩選2周,獲得具有抗性的陽性細胞克隆,繼續在含G418(500 μg/ml)的培養基中培養,獲得穩定表達人NPTX2的PANC1細胞(PANC1-NPTX2)。
四、實時定量PCR檢測NPTX2 mRNA的表達
收集pcDNA3.1(+)轉染的細胞及PANC1-NPTX2。應用Trizol抽提細胞總RNA,取2 μg進行反轉錄。用SYBR Green摻入法進行實時定量PCR擴增。NPTX2上游引物5′-CCTCCCACTCCGCAC-AAAC-3′,下游引物5′-CACCGCATAGGAGAAGGGG-3′,擴增片段133 bp;內參GAPDH上游引物5′-GCACCGTCAAGGCTGAGAA-3′,下游引物5′-ATGGTGGTGAAGACGCCAGT-3′,擴增片段145 bp。以去核酸無菌水作為陰性對照。每個樣品均設3個復孔。采用ABI 7500 system soft進行分析,標本中NPTX2基因的CT值通過下列公式進行計算:△CT =NPTX2的CT值-GAPDH的CT值,△△CT =樣本△CT -對照△CT,NPTX2基因相對表達量為2-△△CT。
五、蛋白印跡法檢測NPTX2蛋白的表達
收集轉染細胞,裂解制備蛋白樣品,常規行Western blotting。兔抗人NPTX2一抗1∶800稀釋,小鼠抗人β-actin抗體1∶10 000稀釋,羊抗兔HRP標記的二抗1∶2000稀釋,羊抗鼠HRP標記的二抗1∶5000稀釋。最后ECL發光,暗室中顯影、定影。應用ImageJ軟件掃描條帶光密度,以NPTX2/β-actin的光密度比值表示NPTX2蛋白的相對表達量。
六、統計學分析
應用SPSS15.0統計學分析軟件,兩組NPTX2 mRNA表達量采用t檢驗,P<0.05認為有統計學差異。
結 果
一、真核表達載體pcDNA3.1(+)-NPTX2的酶切鑒定
NPTX2全長cDNA為1326 bp。pcDNA3.1(+)-NPTX2經雙酶切后電泳可見略小于1500 bp的片段(圖1),對照質粒pcDNA3.1(+)無此片段。
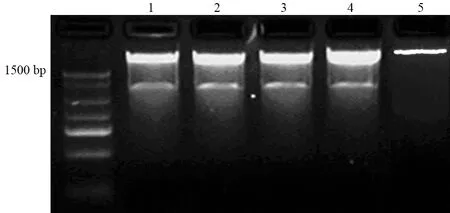
圖1pcDNA3.1(+)-NPTX2質粒(1~4)和pcDNA3.1(+)質粒(5)酶切鑒定電泳圖
二、真核表達載體pcDNA3.1(+)-NPTX2的測序鑒定
將含pcDNA3.1(+)-NPTX2重組質粒的大腸桿菌單克隆菌液送至上海英俊公司測序。應用Chromas和DNAman 軟件分析測序結果,證實了所提供的重組質粒均包含1326 bp插入片段,與GenBank中公布的NPTX2 mRNA序列匹配,同源性均為100%,且含有pcDNA3.1(+)質粒的序列。
三、轉染的PANC1細胞NPTX2 mRNA的表達
GAPDH mRNA與NPTX2 mRNA均有較好的擴增曲線與溶解曲線(圖2)。設對照質粒轉染的PANC1細胞NPTX2 mRNA相對表達量(relative quantity, RQ)為1,則PANC1-NPTX2的NPTX2 mRNA的RQ值為30.089,兩組差異顯著(P<0.05)。
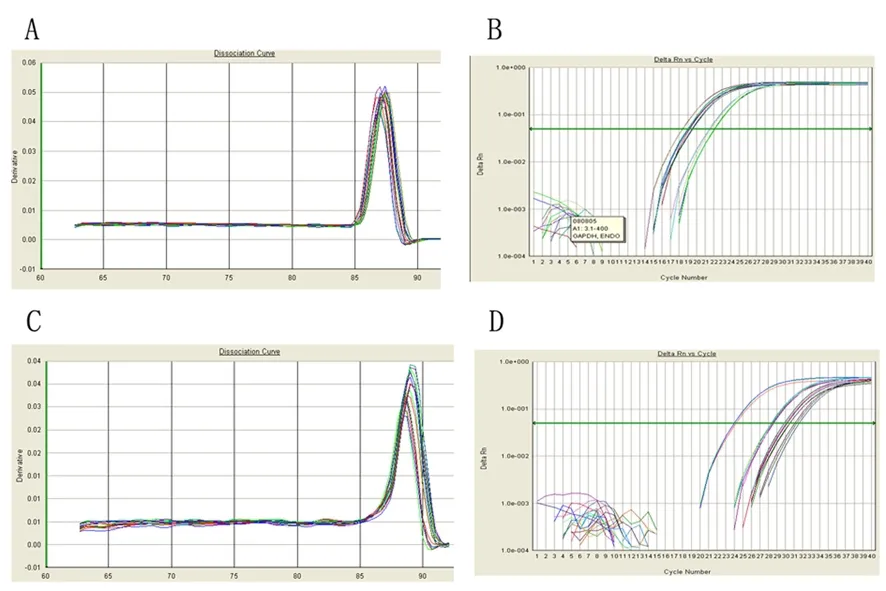
圖2GAPDH(A、B)和NPTX2(C、D)的融解曲線和擴增曲線
四、轉染細胞NPTX2蛋白的表達
空白對照PANC1細胞和pcDNA3.1轉染的細胞均未檢測到NPTX2蛋白的表達,pcDNA3.1-NPTX2轉染細胞檢測到NPTX2蛋白表達(圖3)。
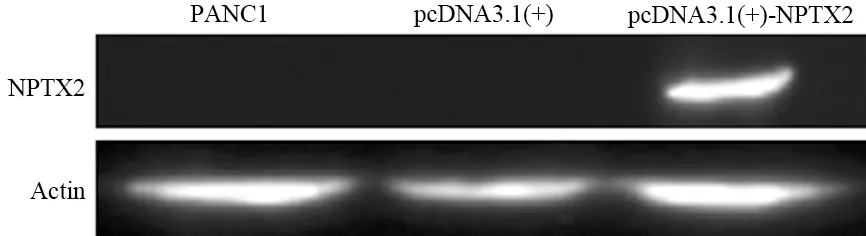
圖3 轉染細胞的NPTX2蛋白表達
NPTX2基因又稱為神經元活性調節正五聚體蛋白(neuronal activity-regulated pentraxin, Narp)。目前針對該蛋白研究較多地集中在神經系統疾病中,如癲癇發作和帕金森病[6-9],在胰腺疾病的研究尚少。為此,本文將NPTX2基因轉染人胰腺癌細胞株PANC1,為后續的研究奠定基礎。
利用表達系統在哺乳動物細胞內表達目的基因是研究基因功能及其相互作用的重要手段。在各種表達系統中,最早被采用的是原核表達系統,這也是目前掌握最為成熟的表達系統[10]。其優點在于能夠在較短時間內獲得基因表達產物,且所需成本相對低廉。但該系統存在許多難以克服的缺點,如原核表達缺乏轉錄后修飾。為此,許多學者將原核基因調控系統引入真核基因調控領域,基因工程研究中常用的真核表達系統有酵母表達系統、昆蟲細胞表達系統和哺乳動物細胞表達系統[11]。
本研究采用哺乳動物表達系統pcDNA3.1(+)。
它不僅含有氨芐青霉素抗性可用于原核擴增,還含有新霉素抗性可用G418篩選穩定表達株。我們將人NPTX2全長cDNA成功地插入pcDNA3.1(+)載體的CMV啟動子下游,構建NPTX2真核表達載體。經酶切、PCR和測序鑒定正確無誤后,通過脂質體介導將pcDNA3.1(+)-NPTX2重組質粒轉染PANC1細胞,通過G418篩選建立了穩定轉染細胞系。采用實時定量PCR和Western blotting分別從轉錄和翻譯水平檢測到NPTX2基因的表達,表明重組的人NPTX2基因在PANC1細胞中能有效地被轉錄和翻譯,成功地建立了一個在基因組DNA中穩定整合有pcDNA3.1(+)-NPTX2載體的PANC1細胞系。
[1] Hruban RH,Lacobuzio-Donahue C,Wilentz RE,et al.Molecular pathology of pancreatic cancer.Cancer J,2001,7:251-258.
[2] Egger G,Liang G,Aparicio A,et al.Epigenetics in human disease and prospects for epigenetic therapy.Nature,2004,429:457-63.
[3] 宋健,曹佳,高軍,等.胰腺癌組織SPARC基因CpG島甲基化狀態及臨床意義.中華胰腺病雜志,2008,8:145-147.
[4] Sato N,Fukushima N,Maitra A,et al.Discovery of novel targets for aberrant methylation in pancreatic carcinoma using high-troughput microarrays.Cancer Res,2003,63:3735-3742.
[5] Matsubayashi H,Canto M,Sato N,et al.DNA methylation alterations in pancreatic juice of patients with suspected pancreatic disease.Cancer Res,2006,66:1208-1217.
[6] Tsui CC,Copeland NG,Gilbert DJ,et al.Narp,a novel member of the pentraxin family,promotes neurite outgrowth and is dynamically regulated by neuronal activity.J Neurosci,1996,16:2463-2478.
[7] O′Brien RJ,Xu D,Petralia RS,et al.Synaptic clustering of AMPA receptors by the extracellular immediate-early gene product Narp.Neuron,1999,23:309-323.
[8] O′Brien R,Xu D,Mi R,et al.Synaptically targeted narp plays an essential role in the aggregation of AMPA receptors at excitatory synapses in cultured spinal neurons.J Neurosci,2002,22:4487-4498.
[9] Moran LB,Hickey L,Michael GJ,et al. Neuronal pentraxin II is highly upregulated in Parkinson′s disease and a novel component of Lewy bodies.Acta Neuropathol,2008,115:471-478.
[10] Busuttil BE,Turney KL,Frauman AG.The expression of soluble,full-lengh,recombinant human TSH receptor in a prokaryotic system.Protein Expr Pufir,2001,23:369-373.
[11] 郭廣君,呂素芳,王榮富.外源基因表達系統的研究進展.科學技術與工程,2006,6:582-587.
2008-12-05)
(本文編輯:屠振興)
Constructionofeukaryoticvectorofhumanneuronalpentraxin2andestablishmentofstabletransfectedPANC1cellline
ZHANGLing,GAOJun,GONGYan-fang,LIZhao-shen,WUHong-yu,JINJing,MANXiao-hua.
DepartmentofGastroenterology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
LIZhao-shen,Email:zhsli@81890.net
ObjectiveTo construct eukaryotic vector of human neuronal pentraxin 2 (NPTX2), and obtain the stable transfected PANC1 cell lines.MethodsThe full-length cDNA of NPTX2 was digested by EcoR1 and Not1, and was cloned into plasmid pcDNA3.1, which were confirmed by sequencing, then the pcDNA3.1 (+) and pcDNA3.1 (+)-NPTX2 vectors were transfected into PANC1 cells by LipofectamineTM2000. The stable transfected PANC1 cell lines were selected by the ability of resistance to G418. The NPTX2 mRNA expression of PANC1 in the selected clones was detected by real-time quantitative PCR.ResultsThe eukaryotic vector pcDNA3.1 (+)-NPTX2 was constructed successfully, stable transfected PANC1 cell line was established and confirmed by real-time quantitative PCR.ConclusionsThe construction of eukaryotic vector targeting NPTX2 and the established stable transfected PANC1 cell line provided a solid experimental foundation for further studies on the function of NPTX2 in pancreatic cancer cells.
Pancreatic neoplasms; NPTX2; Transfection; Cell line
研究表明,胰腺癌存在遺傳學改變及表觀遺傳學變化[1-3],但是,迄今為止胰腺癌的確切分子發病機制尚不清楚。神經元正五聚蛋白2(neuronal pentraxin 2, NPTX2)在胰腺癌組織及胰腺癌患者胰液中均處于高甲基化狀態[4-5],但該基因在胰腺癌發生發展過程中的作用尚無報道。為進一步研究NPTX2基因的功能及其在胰腺癌發病機制中的作用,本實驗建立了穩定轉染NPTX2的人胰腺癌細胞PANC1,現報道如下。
10.3760/cma.j.issn.1674-1935.2010.01.012
200433 上海,第二軍醫大學長海醫院消化內科
李兆申,Emial: zhsli@81890.net

