4,4′-聯吡啶多鉬酸鹽的合成、結構與變色性質
孫德慧 張吉林 任慧娟 崔振峰 孫德新
(1長春工程學院,長春 130012;2中國科學院長春應用化學研究所,稀土資源利用國家重點實驗室,長春 130022; 3裝甲兵技術學院,長春 130117)
4,4′-聯吡啶多鉬酸鹽的合成、結構與變色性質
孫德慧1,*張吉林2任慧娟1崔振峰1孫德新3
(1長春工程學院,長春 130012;2中國科學院長春應用化學研究所,稀土資源利用國家重點實驗室,長春 130022;3裝甲兵技術學院,長春 130117)
通過水熱合成法,合成了4,4′-聯吡啶多鉬酸鹽((4,4′-bipyridine)Mo7O22·H2O)單晶超分子化合物.通過元素分析、熱重-差熱分析(TG-DTA)、粉末X射線衍射(XRD)、單晶X射線衍射、傅里葉變換紅外(FTIR)光譜、紫外-可見漫反射光譜(UV-Vis DRS)和電子自旋共振(ESR)技術對其組成、熱穩定性、結構、光譜和電子特性進行了表征.實驗結果表明:該超分子化合物的分子式為C10H12Mo7N2O23,在空氣中320℃以下不分解.屬于單斜晶系(空間群為P2/n),晶胞參數為a=1.22561(19)nm,b=0.55222(9)nm,c=1.8385(3)nm,β=103.221(2)°,V=1.2113(3)nm3, Z=2和Dc=3.289 g·cm-3.基于F2的最終統計:GOF=0.982,R1=0.0228和wR2=0.0557(I>2σ(I)).該單晶超分子化合物由質子化的4,4′-聯吡啶陽離子和多金屬鉬酸鹽陰離子[Mo7O22]2-及結晶水組成.它們通過氫鍵、靜電引力和分子間作用力結合在一起的,并構成二維網絡結構.樣品在光照或加熱條件下具有光致變色和熱致變色性質.XRD和FTIR證明,變色前后,樣品的結構除輕微的畸變外幾乎沒有變化;而ESR結果表明,光致變色與熱致變色的機理可能存在差別.該光致和熱致變色的超分子化合物能夠為變色機理研究提供參考模型,并在傳感器和光敏材料等領域具有潛在應用.
超分子化合物;多金屬氧酸鹽;光致變色;熱致變色;聯吡啶
通過分子間弱的相互作用力而進行的分子識別和分子組裝是自然界中的普遍現象,但由分子識別和分子組裝所合成的超分子化合物近年來卻引起人們極大的研究興趣[1-4].許多研究多酸的工作者注意力已由多酸陰離子本身的結構和性能轉向多酸陰離子與一些功能性的有機分子靠分子間作用力結合成一體的新型超分子化合物的結構和功能.這是因為多金屬氧酸鹽是集獨特多樣的晶體結構、特殊的光電性質和多種混合價態于一體的優良的電子接受體,因而在傳感器、染料、電極、電池、光電變色器件等諸多方面倍受青睞[5-8].而許多有機分子呈平面狀(如聯吡啶類和共軛的芳香環體系),它們是很好的π電子供體和優秀的有機分子材料[9-10].這兩類分子材料的結合將可能制備出具有獨特光電性質的多金屬氧酸鹽超分子化合物.關于吡啶類有機分子作為配體配位到Mo—O骨架上的文獻已有報道[11-12],而吡啶類有機分子作為配體配位到雜金屬原子如Ni、Cu、Co、Fe、Zn、Ag等的多酸鹽化合物的報道更多[13-21],然而,有關吡啶類有機分子作為抗衡陽離子的多金屬鉬酸鹽超分子化合物的合成卻鮮見報道[9,22-23],對于它們的變色性質研究,到目前為止,還未見報道.
這里,我們通過水熱合成將有機分子4,4′-聯吡啶與多金屬鉬酸鹽組裝成超分子化合物.采用四元單晶X射線衍射分析確定該超分子化合物的結構.通過光致變色和熱致變色樣品的電子自旋共振譜(ESR)的研究,討論其光致變色和熱致變色的機理.
1 實驗部分
1.1 試劑與儀器
1.1.1 試 劑
實驗所需藥品均為分析純,其中,三氧化鉬(MoO3)和氯化鋅(ZnCl2·H2O)購于北京化工廠;4,4′-聯吡啶購于美國Aldrich公司.實驗用水均為去離子水.
1.1.2 儀 器
C、H和N的元素分析采用德國VarioEL型C、H、N元素分析儀進行;而金屬元素分析采用美國TJA公司POEMS型電感耦合等離子體光譜儀(Inductively Coupled Plasma-Atomic Emission Spectrometry,ICP-AES)進行測試.熱重-差熱分析(TGDTA)用美國TA公司的SDT 2960 Simultaneous TG-DTA綜合熱分析儀測定,測定條件,在空氣中進行,氧化鋁坩堝,參比物α-Al2O3,加熱速度10℃· min-1.紫外-可見漫反射光譜(UV-Vis DRS)的測試采用日本日立公司生產的HITACHI U-4100光譜儀進行.樣品的粉末X射線衍射(XRD)測試在日本理學D/Max 2500 V/PC X射線衍射儀上完成.X射線源為Cu Kα1,λ=0.154056 nm.傅里葉變換紅外(FT-IR)光譜采用美國BIO-RAD公司FTS135型紅外光譜儀測試,測定范圍400-4000 cm-1,分辨率為1 cm-1.固體粉末樣品的制備采用KBr壓片法.電子自旋共振譜(ESR)采用日本JES-FE3AX型光譜儀在室溫下測定.磁場掃描范圍為±0.1 T,中心磁場強度為0.3366 T.
1.1.3 單晶結構X射線衍射
一個具有0.180 mm×0.130 mm×0.047 mm尺寸的樣品無色單晶被挑選用來測試.數據用德國Bruker-AXS Smart CCD晶體衍射儀收集,石墨單色器,Mo Kα射線(λ=0.071703 nm),T=293 K,θ范圍在1.82°-26.01°之間,利用ω-掃描技術.數據進行經驗吸收校正.結構采用直接法用SHELXTL-97程序解析,并用全矩陣最小二乘法修正.所有非氫原子進行各向異性修正,質子化氫原子H(1)和H(2)從差值傅里葉衍射圖中確定,其它氫原子被放在其理想的位置.
1.2 實驗過程
將反應物MoO3,4,4′-聯吡啶,去離子水和助劑ZnCl2·H2O以1∶0.4∶144∶1摩爾比混合,室溫下,磁力攪拌30 min后,得到土色混合物.將該土色混合物轉入到45 mL帶有聚四氟乙烯內襯的不銹鋼反應釜中,180℃反應72 h.然后以0.1℃·min-1的速率降到室溫,即得到無色方形晶體樣品,用去離子水洗滌并在45℃空氣中干燥,產率65%.
2 結果與討論
2.1 樣品的組成
元素分析的結果表明,樣品的組成為C10H12Mo7N2O23,計算值(%),C,10.00;H,1.00;N, 2.33;Mo,56.00.實驗值(%),C,11.07;H,1.05;N, 2.27;Mo,57.00.
2.2 樣品的熱穩定性
圖1給出了樣品的TG-DTA曲線.從TG曲線可知,該化合物在50-700℃表現為四步失重.第一步失重出現在320-360℃溫度范圍內,失重為1.5%,相當于多酸化合物所失結晶水數目(計算值1.5%);第二步失重出現在360-426℃溫度范圍內,失重為13.1%,對應聯吡啶的失去(計算值13.2%);第三、四步失重出現在426-570℃溫度范圍內,總失重為53.9%,最終產物為MoO3.從DTA曲線可知,有一個吸熱峰,約在386℃,相應于超分子晶格被破壞,結晶水和聯吡啶被釋放;有4個放熱峰,位于約456、476、521和566℃,相應于多酸骨架的斷裂并最終氧化為MoO3,而這說明多酸骨架的斷裂氧化過程存在許多中間產物.TG-DTA測試結果表明,樣品在320℃以下是穩定的,不分解.
2.3 樣品的結構
表1和表2列出了樣品的晶體數據(No.CCDC-627734):該單晶樣品屬單斜晶系,P2/n空間群,化學式為C10H12Mo7N2O23,相對分子量為1199.80,晶胞參數a=1.22561(19)nm,b=0.55222(9)nm,c=1.8385(3) nm,β=103.221(2)°,V=1.2113(3)nm3,Z=2.
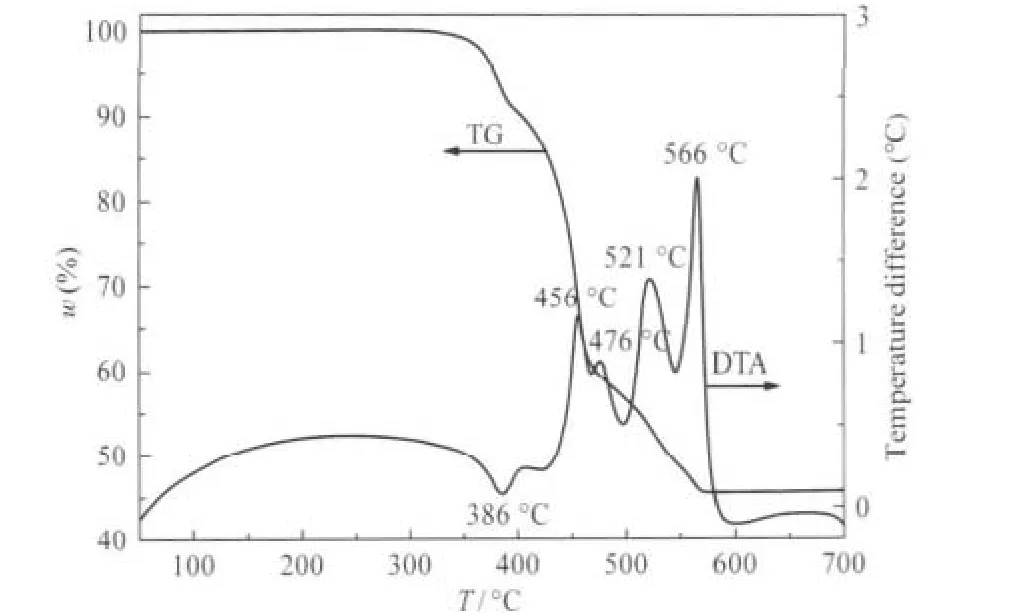
圖1 樣品的TG和DTA曲線Fig.1 TG and DTA curves of the sample
樣品的晶體結構示于圖2中.晶體結構解析表明:樣品是由[Mo7O22]2-陰離子組裝的無限鏈通過質子化的聯吡啶陽離子和水分子以氫鍵連接成二維網絡結構(見圖2A).在晶體結構中,聯吡啶陽離子與水分子位于這些無限鏈之間,并以氫鍵形式與[Mo7O22]2-陰離子無限鏈中的氧連接.其基本結構單元由一個七核鉬氧簇[Mo7O22]2-多陰離子骨架和一個質子化的聯吡啶有機陽離子及一個水分子組成(見圖2B).[Mo7O22]2-陰離子骨架由七個MoO6八面體通過共邊和共角的方式連接組成線性帶,然后每兩個相鄰的線性帶在每個第七個Mo原子的位置交錯90°(即垂直錯過一個多面體的位置)以共頂點的方式連接成呈階梯型的鏈狀(見圖2C).每個八面體具有兩個短的、兩個中等的、兩個長的Mo—O鍵(見表2),而兩個短的Mo—O鍵對應于八面體中的端氧.
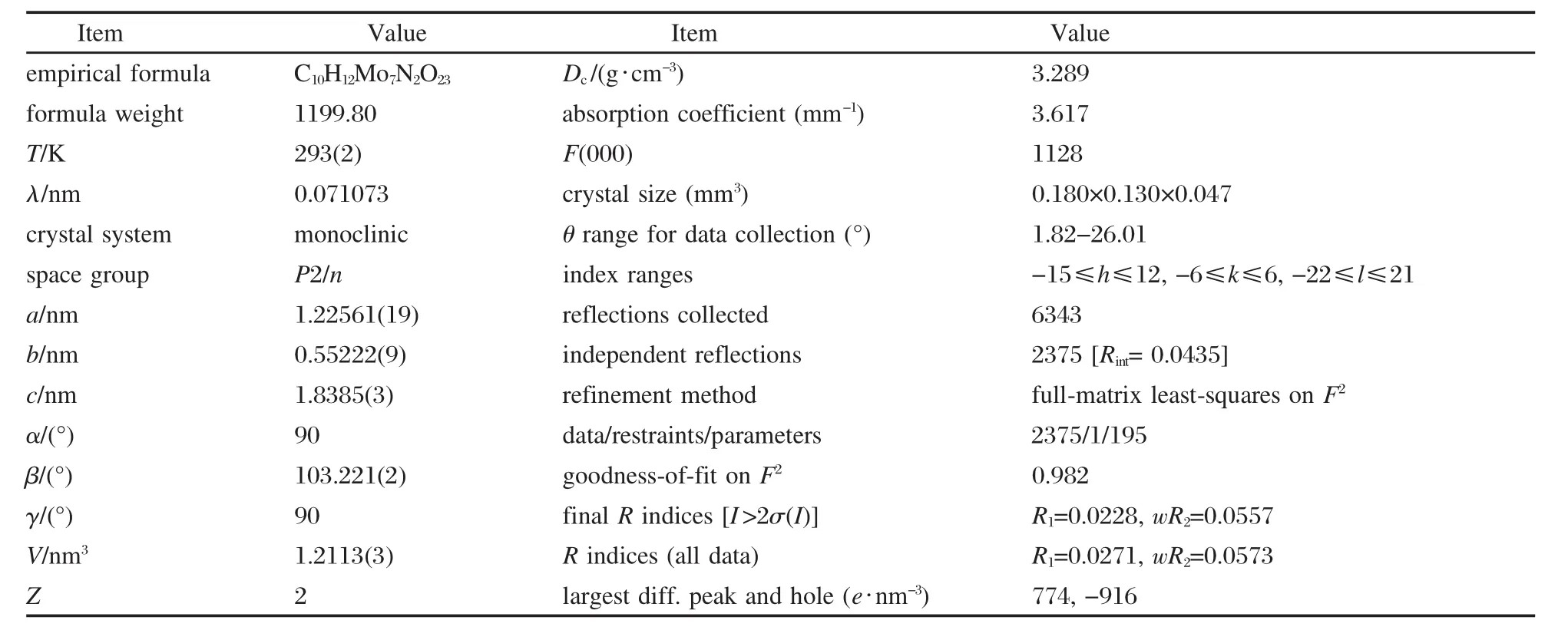
表1 樣品的晶體數據和結構精修(No.CCDC-627734)Table 1 Crystal data and structure refinement of the sample(No.CCDC-627734)
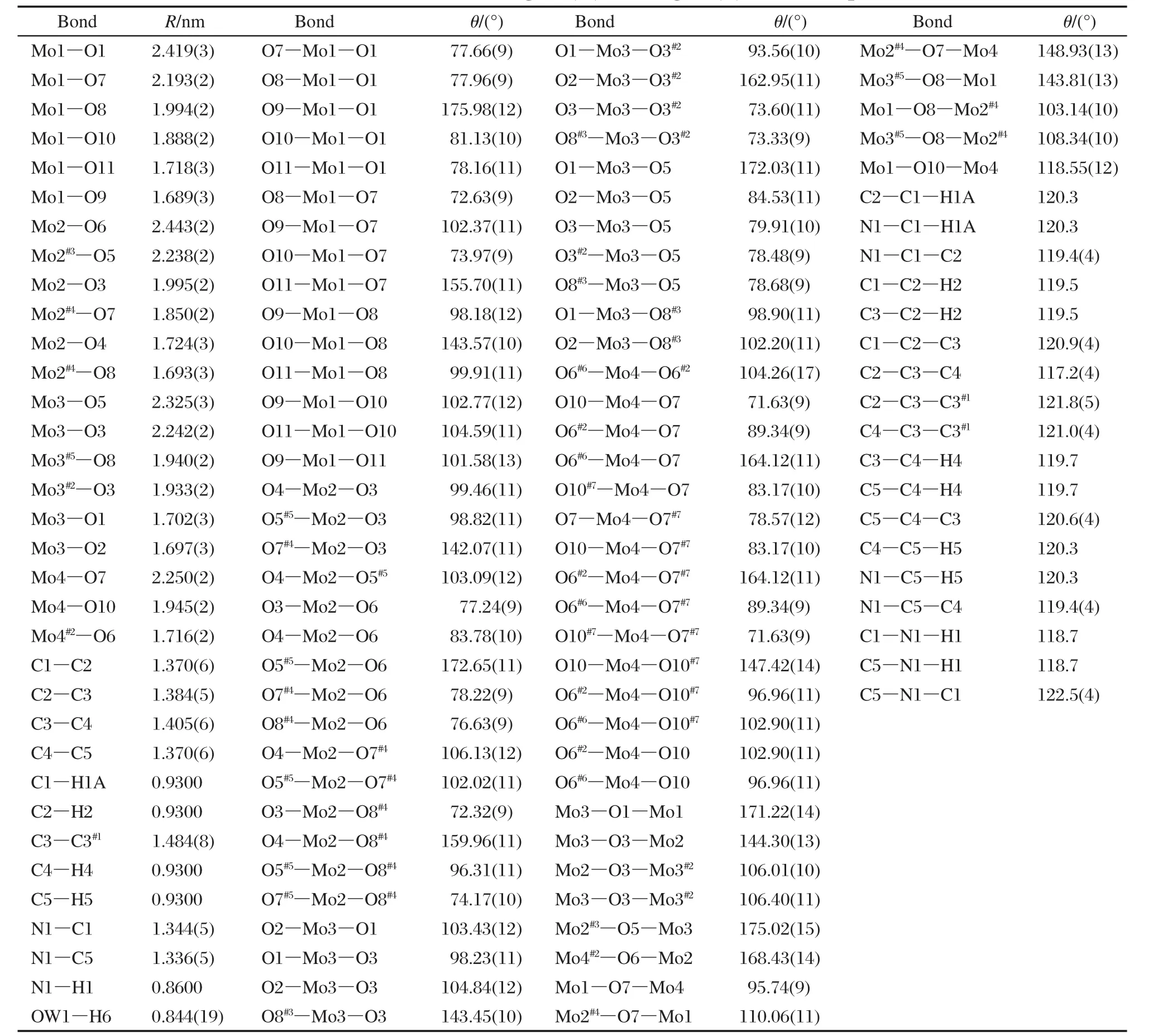
表2 樣品的主要鍵長(R)和鍵角(θ) Table 2 Selected bond lengths(R)and angles(θ)of the sample
2.4 樣品的變色性質
2.4.1 紫外-可見漫反射光譜
在365 nm紫外光照射和不同加熱溫度下樣品會變色,而且隨著光照時間的延長和加熱溫度的升高,樣品的顏色逐漸加深,圖3A和3B分別為樣品在不同光照時間和不同加熱溫度下的紫外-可見漫反射光譜.從光譜曲線可以看出:在200-400 nm紫外光區,樣品有著相似的吸收,即都有兩個較強的吸收帶,中心位于235和300 nm左右.這一強的吸收帶可歸屬于化合物的本征吸收帶,也就是說,從價帶到導帶的躍遷.在400-800 nm的可見光區,其光譜吸收可歸屬于Mo(V)-O-Mo(VI)→Mo(VI)-O-Mo(V)價間電荷轉移躍遷(IVCT)和/或Mo(V)(4d1)鉬原子的d-d躍遷.在加熱樣品和相對應的光照樣品的光譜吸收之間存在差別,可能是源于它們的變色機理不同所導致的.
2.4.2 變色樣品的結構分析
圖4給出了樣品變色前后的XRD和紅外光譜圖.通過XRD(圖4A)進行的結構分析表明:在光照或加熱過程中,樣品的晶體結構除了輕微的畸變外幾乎沒有變化.從圖4B中的FTIR光譜中,可以觀察到樣品在 941、915、881、858、849、811、750、728、 667、643、635和565 cm-1處有一系列吸收峰,這些在1000-400 cm-1區間的吸收峰主要是 [Mo7O22]2-的特征吸收峰;而在3300-1000 cm-1區間的吸收峰(如3062、3040、3014、1608、1536、1491、1417、1221、1072 cm-1)主要是質子化的聯吡啶的特征吸收峰.另外,在3447 cm-1有一寬而弱的吸收帶,為結晶水的吸收帶.同時,我們發現光照或加熱前后,樣品有著幾乎同樣的特征光譜,這意味著在實驗條件下的光照或加熱對樣品的分子骨架影響較小,甚至可以忽略不計.
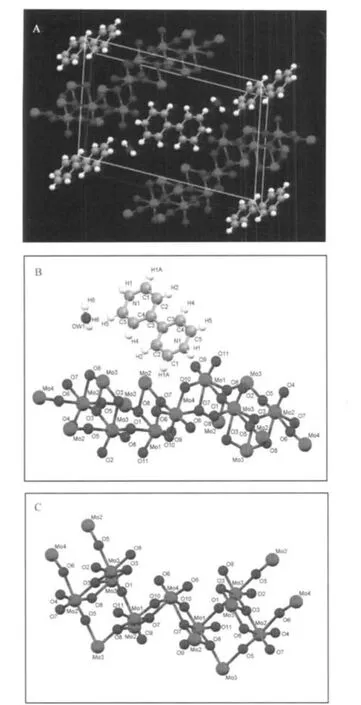
圖2 樣品的晶體結構Fig.2 Crystal structure of the sample(A)the two demensional(2D)network structure;(B)the basic structural unit;(C)the framework structure of the[Mo7O22]2-polyanion
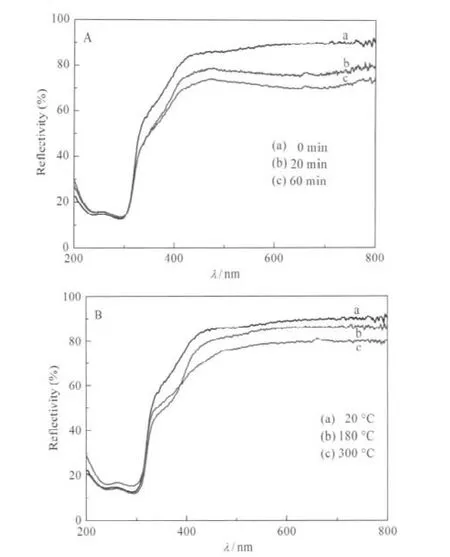
圖3 樣品在不同光照時間(A)和不同加熱溫度(B)時的紫外-可見漫反射光譜Fig.3 UV-Vis DRS of the sample under different irradiation time(A)and different annealing temperatures(B)
2.4.3 變色樣品的價態
圖5給出了樣品在光照不同時間和加熱不同溫度時的ESR譜,從圖5A中可觀察到:光照前樣品(即原樣品)未出現ESR信號,而光照5 min后,ESR譜圖則顯示了一個較弱的信號,并且隨著光照時間的延長,Mo(V)原子的特征ESR信號隨之增強.這說明光照后,樣品中有些Mo(VI)原子被還原為Mo (V)原子,即在多金屬氧酸鹽中的Mo(VI)原子發生了光還原反應.從圖5B中也觀測到:原樣品加熱變色后,樣品也出現了Mo(V)原子的特征ESR信號.這說明加熱可以導致氧原子中的電子向Mo(VI)原子轉移并將其還原為Mo(V)原子.但光照樣品與加熱樣品的ESR譜并不相同,說明Mo(V)在兩種情況下所處的微環境有所不同.因此,可以得出結論:在UV光照射和加熱后,原樣品中的Mo(VI)原子會被還原成Mo(V)原子,樣品的變色是由于Mo(V)的產生引起的,而二者的變色機理可能不同.
2.4.4 光致變色與熱致變色機理探討
關于有機胺多鉬酸鹽光致變色的研究已經有較多的報道[24-25],對于光致變色機理,大家普遍接受Yamase等[24]提出的觀點:在紫外光照射下,Mo(VI)原子發生了光還原,并產生具有d1電子構型的Mo(V)原子.其光還原的機理為:MoO6八面體中配體到金屬的電荷轉移(O→M LMCT)可以誘導通過氫鍵與氮原子相連的質子遷移到橋氧上,同時,O→M LMCT所形成的空穴與氮原子上的非鍵電子相互作用形成電荷轉移復合物.該電荷轉移復合物反映了電子和空穴的電荷分離,而且電子和空穴是多鉬酸鹽化合物晶體中O→M LMCT躍遷產生的[24].配體氧到金屬離子的荷移躍遷,即能帶理論中的價帶到導帶的電子躍遷導致了紫外光區兩個強的吸收帶的出現,而在可見和近紅外區出現的譜帶主要源于部分填充的d1電子的價間荷移躍遷(intervalence charge transfer transition,IVCT)[26-27].聯吡啶多鉬酸鹽作為有機胺多鉬酸鹽的一種,我們認為4,4′-聯吡啶多金屬鉬酸鹽超分子化合物的光致變色遵循同樣的機理,即在紫外光誘導下,與4,4′-聯吡啶中氮原子氫鍵相連的質子遷移到MoO6八面體中橋氧上形成電荷轉移復合物,而部分Mo(VI)原子被還原為Mo(V)原子.配體氧到金屬離子的荷移躍遷和d1電子的價間荷移躍遷導致了紫外光區的特征吸收和可見光區的光致變色現象.圖6為4,4′-聯吡啶多金屬鉬酸鹽超分子化合物的光致變色機理示意圖.
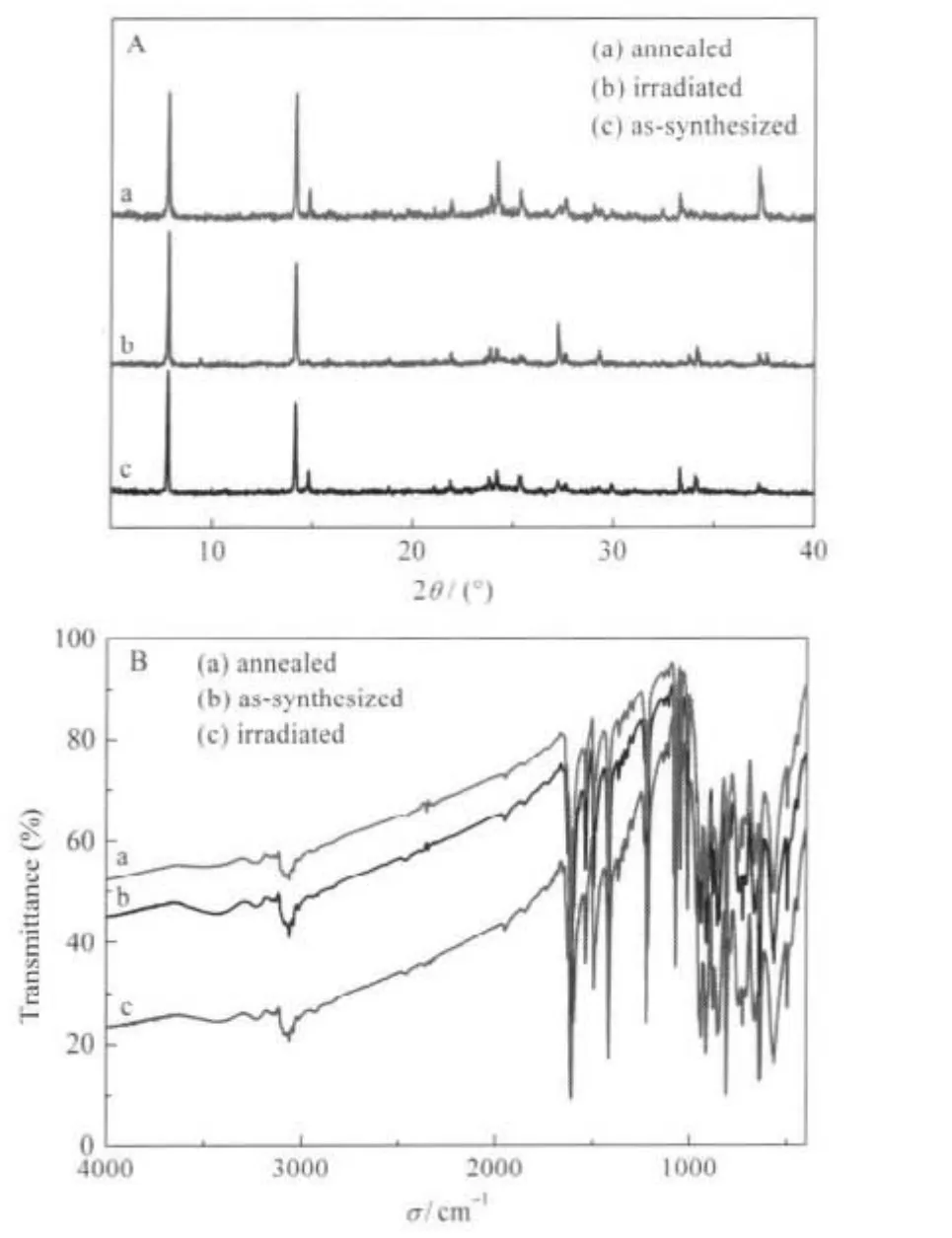
圖4 樣品在不同實驗條件下的XRD(A)和FTIR(B)譜圖Fig.4 XRD patterns(A)and FTIR spectra(B)of the sample under different experiment conditions
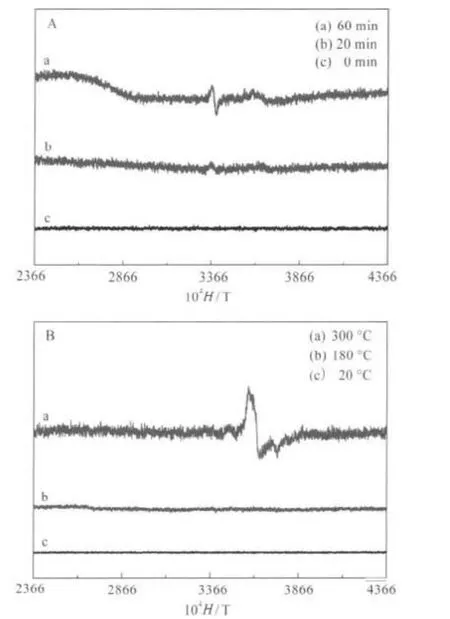
圖5 樣品在不同光照時間(A)和不同加熱溫度(B)下的電子自旋共振譜Fig.5 ESR of the samples under different irradiation time(A)and different annealing temperatures(B)
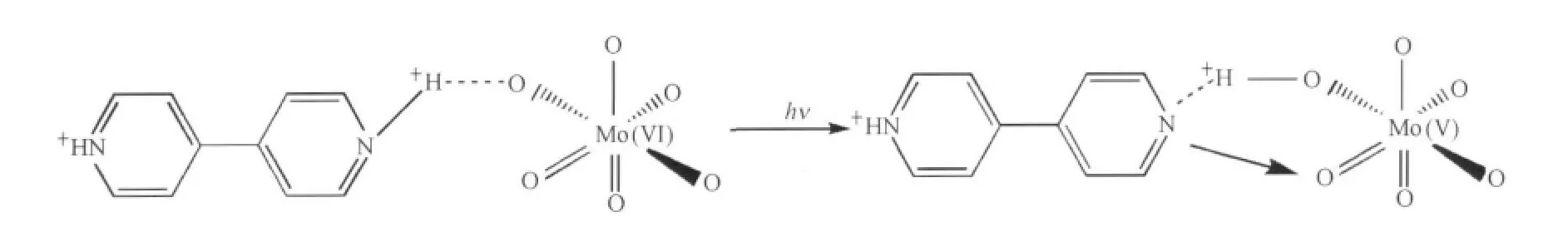
圖6 樣品的光致變色機理示意圖Fig.6 Scheme of the photochromic mechanism of the sample
相對于光致變色來說,多金屬氧酸鹽的熱致變色及機理研究的較少.例如,2004年,Jiang等[28]采用層接層自組裝法制備了含有多金屬氧酸鹽簇化合物K12.5Na1.5[NaP5W30O110]的熱致變色多層膜,并對熱致變色機理進行了解釋.其熱致變色機理與Yamase的烷基胺多金屬氧酸鹽的光致變色機理幾乎是相同的.然而,我們發現:本文合成的4,4′-聯吡啶多金屬鉬酸鹽和先前報道過的乙二胺三鉬酸鹽超分子化合物[29]的熱致變色性質均不同于它們的光致變色性質,而這種差別可能是它們的變色機理不同所引起的,但我們對其熱致變色機理目前尚不清楚,還有待于進一步的研究.
3 結論
綜上,利用水熱法合成了4,4′-聯吡啶多金屬鉬酸鹽超分子化合物單晶樣品,并通過單晶X射線衍射解析了其晶體結構.該樣品在320℃以下穩定,不分解.它不僅具有光致變色性質,而且具有熱致變色性質.變色樣品的晶體結構除了輕微的畸變外幾乎沒有變化,但電子自旋共振譜證明,變色樣品中的部分Mo(VI)原子被還原為Mo(V)原子.我們對其光致變色機理進行了初步研究與探討,而熱致變色機理尚不清楚.所獲得的光、熱超分子化合物變色材料在傳感器和光敏材料等領域具有潛在應用.
1 Han,Z.;Chai,T.;Wang,Y.;Gao,Y.;Hu,C.Polyhedron,2010, 29(1):196
2 Forster,R.J.;Keyes,T.E.Coordination Chemistry Reviews,2009, 253(13-14):1833
3 Yu,R.;Kuang,X.F.;Wu,X.Y.;Lu,C.Z.;Donahue,J.P. Coordination Chemistry Reviews,2009,253(23-24):2872
4 Zhang,T.;Brown,J.;Oakley,R.J.;Faul,C.F.J.Current Opinion in Colloid&Interface Science,2009,14(2):62
5 Zhang,T.R.;Spitz,C.;Antonietti,M.;Faul,C.F.J.Chem.Eur.J., 2005,11(3):1001
6 Murakami,H.;Kozeki,T.;Suzuki,Y.;Ono,S.;Ohtake,H.; Sarukura,N.;Ishikawa,E.;Yamase,T.Appl.Phys.Lett.,2001,79 (22):3564
7 Glezos,N.;Argitis,P.;Velessiotis,D.;Diakoumakos,C.D.Appl. Phys.Lett.,2003,83(3):488
8 Yamase,T.;Ishikawa,E.;Fukaya,K.;Nojiri,H.;Taniguchi,T.; Atake,T.Inorg.Chem.,2004,43(25):8150
9 Hidekazu,K.;Kazuya,I.;Kazuyoshi,U.;Kenji,T.;Hirokazu,O.; Zhu,T.;Mineo,S.Inorg.Chim.Acta,2009,362(1):238
10 Xie,Y.M.;Zhang,Q.S.;Zhao,Z.G.;Wu,X.Y.;Chen,S.C.;Lu, C.Z.Inorg.Chem.,2008,47(18):8086
11 Zapf,P.J.;LaDuca Jr.,R.L.;Rarig Jr.,R.S.;Johnson III,K.M.; Zubieta,J.Inorg.Chem.,1998,37(13):3411
12 Zapf,P.J.;Haushalter,R.C.;Zubieta,J.Chem.Mater.,1997,9(9): 2019
13 Ma,P.T.;Zhao,J.W.;Wang,J.P.;Shen,Y.;Niu,J.Y.J.Solid State Chem.,2010,183(1):150
14 Liu,H.;Gómez-García,C.J.;Peng,J.;Sha,J.;Wang,L.;Yan,Y. Inorg.Chim.Acta,2009,362(6):1957
15 Zhao,J.;Song,Y.;Ma,P.;Wang,J.;Niu,J.J.Solid State Chem., 2009,182(7):1798
16 Xiao,D.;Yuan,R.;Sun,D.;Zhang,G.;Chen,H.;He,J.;Wang,E. J.Mol.Struct.,2009,936(1-3):264
17 Li,G.;Salim,C.;Hinode,H.Solid State Sciences,2008,10(2): 121
18 Qian,B.H.;Ma,W.X.;Xu,X.Y.;Lu,L.D.;Yang,X.J.;Wang, X.Acta Phys.-Chim.Sin.,2008,24(9):1650 [錢保華,馬衛興,許興友,陸路德,楊緒杰,汪 信.物理化學學報,2008,24(9): 1650]
19 Shi,Z.Y.;Gu,X.J.;Peng,J.;Xin,Z.F.Eur.J.Inorg.Chem., 2005,(19):3811
20 Li,Z.H.;Yin,C.;Wang,R.J.;Wang,P.;Guo,H.Y.Acta Phys.-Chim.Sin.,2003,19(12):1133 [李增和,銀 陳,王如驥,王平,郭洪猷.物理化學學報,2003,19(12):1133]
21 Luan,G.;Li,Y.;Wang,S.;Wang,E.;Han,Z.;Hu,C.;Hu,N.;Jia, H.Dalton Trans.,2003,(2):233
22 Wang,Z.L.;Wei,L.H.;Wang,J.P.Chem.Research,2005,16 (4):42 [王子梁,魏林恒,王敬平.化學研究,2005,16(4):42]
23 Zapf,P.J.;Haushalter,R.C.;Zubieta,J.Chem.Commun.,1997, (3):321
24 Yamase,T.Chem.Rev.,1998,98(1):307
25 Niu,J.Y.;You,X.Z.;Duan,C.Y.;Fun,H.K.;Zhou,Z.Y.Inorg. Chem.,1996,35(14):4211
26 Qi,W.;Li,H.;Wu,L.J.Phys.Chem.B,2008,112(28):8257
27 Wang,E.B.;Hu,C.W.;Xu,L.Introduction to polyacid chemistry. Beijing:Chemical Industry Press,1998:98-100 [王恩波,胡長文,許 林.多酸化學導論.北京:化學工業出版社,1998:98-100]
28 Jiang,M.;Wang,E.;Xu,L.;Kang,Z.;Lian,S.J.Solid State Chem.,2004,177(4-5):1776
29 Sun,D.;Zhang,H.;Wang,C.;Zhang,J.;Yu,J.;Peng,C.Chem. Lett.,2006,35(10):1146
December 21,2009;Revised:February 2,2010;Published on Web:March 26,2010.
Synthesis,Structure and Chromic Properties of 4,4′-Bipyridine Polyoxomolybdate
SUN De-Hui1,*ZHANG Ji-Lin2REN Hui-Juan1CUI Zhen-Feng1SUN De-Xin3
(1Changchun Institute of Technology,Changchun 130012,P.R.China;2State Key Laboratory of Rare Earth Resource Utilization, Changchun Institute of Applied Chemistry,Chinese Academy of Sciences,Changchun 130022,P.R.China;3The Amour Technology Institute of PLA,Changchun 130117,P.R.China)
We synthesized a 4,4′-bipyridine polyoxomolybdate((4,4′-bipyridine)Mo7O22·H2O)single crystal supramolecular compound by a hydrothermal method and characterized its composition,thermostability,structure, spectra and electron properties by elemental analysis,thermal gravimetric and differential thermal analysis(TG-DTA), powder X-ray diffraction(XRD),single crystal X-ray diffraction,Fourier transform infrared(FTIR)spectroscopy,UVVis diffuse reflectance spectroscopy(UV-Vis DRS),and electron spin resonance(ESR).Experimental results show that the molecular formula of the supramolecular compound is C10H12Mo7N2O23and it does not decompose below 320℃in air.It belongs to the monoclinic system(space group P2/n)with a=1.22561(19)nm,b=0.55222(9)nm,c=1.8385(3)nm, β=103.221(2)°,V=1.2113(3)nm3,Z=2 and Dc=3.289 g·cm-3.The final statistics based on F2are GOF=0.982,R1= 0.0228 and wR2=0.0557 for I>2σ(I).The single crystal supramolecular compound consists of protonated 4,4′-bipyridine cations and polyoxomolybdate[Mo7O22]2-anions as well as lattice water.They form a two dimensional(2D) network through hydrogen bonds,electrostatic attraction,and intermolecular forces.The samples show photochromism under UV irradiation and thermochromism under annealing conditions.XRD and FTIR verify that before and after the color changes,the crystal structure of the samples is almost unchanged except for distortion.ESR spectra indicate that a difference exists between the thermochromic and photochromic mechanisms.This supramolecular compound with thermochromic and photochromic behaviors can serve as a reference model for a chromic mechanism and may have potential application in fields such as sensors and photosensitive materials.
Supramolecular compound;Polyoxometalate;Photochromism;Thermochromism;Bipyridine
[Article] www.whxb.pku.edu.cn
*Corresponding author.Email:dhsun998@gmail.com;Tel:+86-431-85711658.
The project was supported by the National Natural Science Foundation of China(20871083)and Department of Education of Jilin Province, China(2008-371,2008-210).
國家自然科學基金(20871083)和吉林省教育廳(2008-371,2008-210)資助項目
O641

