溶膠—凝膠法制備Nd摻雜納米TiO2
朱曉東,白 昱
(1.成都大學工業制造學院,四川成都 610106;2.成都印鈔有限公司,四川成都 611130)
0 引 言
納米TiO2具有獨特的顏色效應、光催化作用及紫外屏蔽等功能,在汽車工業、防曬化妝品、廢水處理、空氣凈化及環境保護等領域有廣泛的應用[1-5].但研究者在對其應用研究中發現,由于其結構關系,要想成為一種好的光催化材料,TiO2還存在一些缺陷,主要表現在:帶隙較寬,僅能吸收波長小于387.5 nm的紫外光,而輻射到地面的紫外光部分僅占太陽光的3%~5%[6],太陽能的利用率極低;光生電子—空穴對的復合率較高,導致光催化活性降低;大規模工業化應用時存在如回收困難等不便.為了克服這些缺陷,科研人員在提高TiO2光催化劑結構和性能、開拓新應用領域等方面作了大量的深入研究.例如,在半導體材料中摻入微量雜質原子或離子(簡稱摻雜)來調節半導體的性能,采用恰當的方法將稀土元素摻雜到半導體納米材料中等.
稀土離子摻雜,是利用物理或化學方法將稀土離子引入到TiO2晶格中,從而在其晶格中引入新電荷、形成缺陷或改變晶格類型,導致TiO2的結構特性、電子特性、光學特性發生改變.在稀土摻雜納米TiO2的制備方面,不同方法所制備的摻雜納米TiO2的形狀、尺寸、表面結構等物化性質存在差異,各種方法的技術難度和制備成本也不盡相同.目前,主要有以下幾種制備方法:溶膠—凝膠法,浸漬法,水熱合成法,醇鹽水解法和均勻沉淀法[7-12].
溶膠—凝膠法是20世紀80年代迅速發展起來的濕化學合成方法,被廣泛應用于各種無機功能材料的合成當中.該方法在常溫或近似常溫下把金屬醇鹽溶液加水分解,同時發生縮聚反應制成溶膠,進一步反應形成凝膠,再進行高溫煅燒處理,即可制得納米級氧化物粉末.由于溶膠—凝膠技術從納米單元開始,在納米尺度上進行反應,最終制備出具有納米結構特征的材料,且是一種低溫制備納米結構材料的特殊工藝,特別適于摻雜納米氧化物的制備[7].基于此,本文選擇溶膠—凝膠法制備稀土元素Nd摻雜納米TiO2以及純納米TiO2.
1 納米TiO2的溶膠—凝膠法制備
1.1 溶膠—凝膠法反應步驟
溶膠—凝膠法主要反應步驟為前驅物溶于溶劑(水或有機溶劑)中形成均勻的溶液,溶質與溶劑產生水解或醇解反應,反應生成物聚集成納米尺度粒子并形成溶膠,溶膠經蒸發干燥轉變為凝膠.其基本反應如下:
(1)溶劑化.金屬鹽的陽離子MZ+吸引水分子形成溶劑單元M(H2O)nZ+(Z為M離子的價數),并釋放出H+,
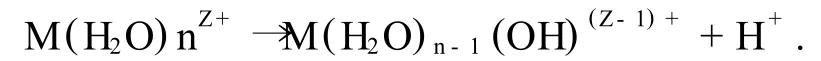
(2)水解反應.金屬醇鹽M(OR)n(n為金屬M的原子價,R代表烷基)與水反應,

反應可延續進行,直至生成M(OH)n.
(3)縮聚反應.其可分為,
失水縮聚,

失醇縮聚,
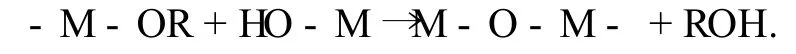
1.2 溶膠—凝膠法的工藝參數選擇
由于鈦醇鹽的水解速度很快,其水解反應和縮聚反應幾乎同時發生,因而不能獨立地描述水解和縮聚反應,但通過控制反應條件,可以得到預期結構的材料.其主要的影響因素參數選擇如下.
1.2.1 醇鹽與溶劑的選擇.
(1)醇鹽的選擇.由于,同一種元素的不同醇鹽的水解速率不同,隨著C鏈的增長,醇鹽電負性降低,Ti(OR)4接受電子的能力變差,使Ti4+易與·OH配位.因此,隨著烷基中C原子數增加,醇鹽的水解速率下降.故應選擇水解動力學穩定性差即配位基團小的金屬醇鹽作為反應前驅體.另外,隨著醇鹽濃度的增大,水解反應加快,凝膠化時間縮短,但如果濃度過高,水解縮聚產物聚合度過高,容易引起粒子的聚集沉淀,但凝膠化時間過短,反應不易控制.在實驗中,醇鹽選擇鈦酸丁酯.
(2)溶劑的選擇.金屬醇鹽水解反應是親核試劑OH-與金屬M的親核反應,反應過程中親核試劑被溶劑分子包圍.隨著溶劑配位基C鏈增長,電負性減弱,親核試劑與M結合能力增強,為除掉親核試劑周圍的一部分溶劑分子,使溶劑與醇鹽接觸發生反應,必須付出更多的能量.同時,醇分子中的烴基對酸與水的締合有空間阻礙作用,烴基愈大,阻礙作用愈大,生成氫鍵能力減小,使水解反應變慢,成核誘導時間變長,體積平均粒徑增加,單分散性能更好.因而,溶劑配位基的選擇應與底物相同或相近,其作用是把多相溶液調成均相.在實驗中,采用乙醇作溶劑.
此外,乙醇的加入量也要合適,如果加入過多,將會延長凝膠時間.其原因是醇不但抑制水解反應,還會發生酯醇反應,溶劑和醇鹽的OR差別愈大,轉化率愈高,而且醇量的增加必然導致金屬醇鹽濃度下降,使已水解的金屬醇鹽分子之間的碰撞機率下降,對縮聚反應也不利;但如果醇的加入量太少,會導致金屬醇鹽濃度過高,水解縮聚產物濃度過高,也容易引起粒子的聚集或沉淀.根據以上分析,實驗中,我們選擇鈦酸丁酯為前驅體,乙醇作為溶劑,乙醇與鈦酸丁酯的比例為2.5∶1.
1.2.2 水 量.
加水量的多少直接影響水解縮聚產物的結構.水量過少,醇鹽水解速度慢,醇鹽分子上水解形成的-OH基團少,其縮聚易于形成低交聯度的產物.反之,則易于形成高度交聯的產物.同時,當加水量小于水解化學計量水量時,則隨著金屬醇鹽M(OR)n中烷基R的增加,溶膠的粘度增大,凝膠化時間縮短;當加水量過多時,由于過量水沖淡了縮聚物的濃度,則隨R的增加,粘度下降,凝膠化時間延長.此外,如果加水量過多,將會使凝膠的干燥收縮和干燥應力增加,從而延長干燥時間.在實驗中,確定鈦醇鹽和水的比例為2∶1.
1.2.3 抑制劑.
抑制劑的作用在于控制鈦酸丁酯的水解反應速度,從而進一步控制所制備納米材料的尺寸.一般認為,在酸抑制體系中,水解反應主要是H3O+對OR基的取代反應,而在堿抑制體系和不加抑制劑的體系中,水解反應主要是OH-對OR基的取代反應.由于抑制機理不同,對同一種醇鹽的水解縮聚,酸抑制和堿抑制將產生結構和形態完全不同的水解產物.在實驗中,采用冰乙酸作抑制劑.
1.2.4 反應溫度.
從反應動力學角度考慮,溫度升高,水解速率增大,縮聚速率也增大,并且原料易揮發,得到產品的粒徑將會增大;而溫度降低,水解速率降低,縮聚速率降低,凝膠化時間變短,此時產品粒徑減小.同時,醇鹽的水解反應是微放熱可逆反應.綜合考慮,溫度不宜過高或過低,選擇反應溫度在25~30℃之間.
2 實驗及分析
2.1 試樣制備
在實驗中,我們采用溶膠—凝膠法制備稀土元素Nd摻雜納米TiO2及純納米TiO2試樣,具體步驟為:
(1)先將適量的0.1 mol硝酸釹溶液加入到10 mL冰醋酸、40 mL無水乙醇與10 mL蒸餾水的混合液中,充分攪拌后得到溶液A.
(2)將20 mL的鈦酸丁酯與50 mL無水乙醇均勻混合得到溶液B,置于分液漏斗中.
(3)在劇烈攪拌下將溶液B逐滴加入到溶液A中,滴加完畢后繼續攪拌2 h以形成均勻透明的稀土元素Nd摻雜TiO2溶膠,然后室溫放置陳化,以形成凝膠.
(4)將凝膠在100℃下烘干,研磨并過400目篩后得到樣品粉體.
(5)樣品粉體在500℃下焙燒3 h后最終得到Nd摻雜納米TiO2.
同時,在A溶液中不添加稀土鹽溶液制得的粉體為純納米TiO2.
2.2 結果分析
將制得的稀土元素Nd摻雜納米TiO2及純納米TiO2試樣采用透射電鏡(TEM)表征粉體形貌,結果如圖1所示.從圖1中可以看出,溶膠—凝膠法制備的純納米TiO2與Nd摻雜納米TiO2粒子大部分呈球形,基本由小粒子組成,純納米TiO2粒徑在12 nm左右,摻雜Nd5%-TiO2粒徑在8 nm左右.

圖1 純納米TiO2和摻雜納米Nd5%-TiO2的TEM圖
3 結 論
采用溶膠—凝膠法制備稀土元素Nd摻雜納米TiO2以及純納米TiO2的具體參數為:乙醇與鈦酸丁酯的比例為2.5∶1,鈦醇鹽和水的比例為2∶1,選用冰乙酸作抑制劑,反應溫度為25~30℃.經過形成溶膠、凝膠以及焙燒研磨后得到稀土元素Nd摻雜納米TiO2以及純納米TiO2粉體試樣.經TEM分析表明,試樣的粒子大部分呈球形,純納米TiO2粒徑在12 nm左右,摻雜納米Nd5%-TiO2粒徑在8 nm左右,均達到了納米級別.
[1]Hagfeldt A,Gratzel M.Light-induced Redox Reactions in Nanocrystalline Systems[J].Chemical Reviews,1995,95(1):49-68.
[2]Fox MA,Dulay M T.Heterogeneous Photocatalysis[J].Chemical Reviews,1993,93(1):314-357.
[3]Hoffmann M R,Martin S T,Choi W,et al.Environmental Applications of Semiconductor Photocatalysis[J].Chemical Reviews, 1995,95(1):69-96.
[4]Stafford U,Gray KA,Kamat P V.Photocatalytic Degradation of Organic Contaminants,Halophenols and Related Model Compounds,Heterogeneous[J].Chemistry Reviews,1996,96(3):77 -104.
[5]Iwasaki M,Hara M,Kawada H,et al.Cobalt Iondoped TiO2Photocatalyst Response to Visible Light[J].Journal of Colloid Interface Science,2000,224(1):202-204.
[6]李慧泉,周新木,李越湘.稀土摻雜二氧化鈦光催化的研究進展[J].江西化工,2003,19(4):81-84.
[7]Li X Z,Li F B,Yang CL,et al.Photocatalytic Activity of WOx-TiO2Under Visible Light Irradiation[J].Journal of Photochemistry and Photobiology(A):Chemistry,2001,141(2-3):209-217.
[8]Xu A W,Gao Y,Liu H Q.The Preparation,Characterization, and their Photocatalytic Activities ofRare-Earth-Doped TiO2Photocatalysts[J].Journal of Catalysis,2002,207(2):151-157.
[9]Bahtat A,Bouazaoui M,Bahtat M,et al.Fluorescence of Er3+Ions in TiO2Planar Waveguides Prepared by a Sol-gel Process [J].Optics Communications,1994,111(1-2):50-60.
[10]He C,Yu Y,Hu X F,et al.Influence of Silver Doping on the Photocatalytic Activity of Titania Films[J].Applied Surface Science,2002,200(1-4):239-247.
[11]Ohno T,Tanigawa F,Fujihara K,et al.Photocatalytic Oxidation of Water by Visible Light Using Ruthenium-doped Titanium Dioxide Powder[J].Journal of Photochemistry Photobiology (A):Chemistry,1999,127(1-3):107-110.

