利用葉綠素熒光技術揭示光照、溫度和鹽度對鼠尾藻嫩芽的影響
梁洲瑞, 王飛久, 孫修濤, 汪文俊, 丁昌玲, 李 濤
(1. 農業部海洋漁業資源可持續利用重點開放實驗室, 中國水產科學研究院黃海水產研究所, 山東青島266071; 2. 上海海洋大學 水產與生命學院, 上海201306)
利用葉綠素熒光技術揭示光照、溫度和鹽度對鼠尾藻嫩芽的影響
梁洲瑞1,2, 王飛久1, 孫修濤1, 汪文俊1, 丁昌玲1, 李 濤1
(1. 農業部海洋漁業資源可持續利用重點開放實驗室, 中國水產科學研究院黃海水產研究所, 山東青島266071; 2. 上海海洋大學 水產與生命學院, 上海201306)
采用鼠尾藻嫩芽為實驗材料, 研究了不同光強(25~220 μmol/(m2·s))、溫度(5~34℃)和鹽度(0~60)對其葉綠素熒光參數的影響。測定的葉綠素熒光參數包括光系統II最大熒光產量(Fv/Fm)、最大潛在相對電子傳遞速率(RrET,max)、快速光曲線的初始斜率等。結果表明:(1)鼠尾藻嫩芽易受強光、高溫脅迫, 在強光照射下, 其Fv/Fm值明顯降低, 溫度大于30℃時對其光合作用有顯著影響; (2)5℃低溫處理1 h或0~60鹽度處理9 h對光系統Ⅱ均有明顯影響, 但24 h恢復后, 除了鹽度60組, 其他組的葉綠素熒光參數均可基本恢復正常。初步分析了鼠尾藻嫩芽的抗逆生理, 可為鼠尾藻的人工栽培提供參考。
鼠尾藻(Sargassum thunbergii); 脅迫條件; 葉綠素熒光參數
鼠尾藻(Sargassum thunbergii)屬于褐藻門馬尾藻屬(Sargassum)。鼠尾藻具有很高的生態、經濟價值:如凈化重金屬污染海區、降低海區富營養化; 可提取碘、褐藻膠、甘露醇等食品或醫藥原料; 作為海參鮑魚的飼料等[1-6]。
鼠尾藻作為一種重要的大型經濟海藻, 其自然資源日益減少, 開展鼠尾藻人工繁殖、育苗及栽培技術的研究勢在必行。雖然近年來這些方面的研究工作已廣泛展開[7-12], 但許多生物基礎科學問題研究不深入(如光合作用有關基礎理論等), 不能完全滿足鼠尾藻產業發展需求并由此限制了鼠尾藻應用價值的更大發揮。鼠尾藻的自然生長環境是受到海水漲落潮及雨水影響較大的潮間帶, 光照、溫度、鹽度等環境因子的變化較大, 其能在環境變化劇烈的潮間帶生長必有其獨特的生理特性。植物通過光合作用獲取能量, 為此對鼠尾藻光合作用生理的研究顯得尤為重要, 但目前有關這方面的研究尚未見報道。在人工養殖鼠尾藻過程中, 附著生物尤其是貽貝、雜藻(如水云屬和多管藻屬中的藻類)等對鼠尾藻的生長十分不利。在鼠尾藻、羊棲菜、銅藻等馬尾藻屬的養殖實踐過程中, 可利用其具有較強的耐受滲透壓變化的能力, 通過干露苗繩、自來水沖洗等方法除掉這些對滲透壓較為敏感的附著生物[9,13-14]。但鼠尾藻耐受滲透壓變化的范圍有多大, 還沒有深入的研究報道。由此, 鼠尾藻鹽度脅迫的研究對在人工養殖過程中如何更有效除掉鼠尾藻附著生物有重要的指導意義。
葉綠素熒光于1834年被首次發現[15], 由于其是測定植物光合作用的有效、快速、無損傷的探針, 現已被廣泛應用于植物光合機理的研究。目前國內外利用葉綠素熒光技術對高等植物生理脅迫、作物增產潛力預測等方面的研究報道較多[16-17], 對微型海藻[18-20]和大型海藻(如條斑紫菜, 龍須菜, 滸苔等)[21-23]的研究也有報道。在褐藻門中, 有關溫度、鹽度和光照脅迫機制的研究已有一些報道[13-14,24]。
經過有性繁殖階段后, 鼠尾藻枝條糜爛脫落,嫩芽從其假根基部生出, 開始新一輪的營養繁殖[25]。溫度與光照強度是鼠尾藻新生枝條生長的主要限制因子[26]。在鼠尾藻人工養殖實踐中, 可利用其營養繁殖特性——固著器(假根)多年生, 實行多茬養殖[9]。本實驗利用葉綠素熒光技術研究光照、溫度和鹽度對鼠尾藻嫩芽的影響, 初步分析了鼠尾藻嫩芽的抗逆生理, 這對鼠尾藻人工栽培有理論和應用上的價值。
1 材料和方法
1.1 材料
于2010年11月中旬在青島太平角潮間帶礁石區(該時段該地區海水溫度約為16~19℃)采集鼠尾藻,置于GXZ智能型光照培養箱進行暫養一周, 培養條件:溫度 18℃, 光照度約為 60 μmol/(m2·s), 用滅菌海水(鹽度 33)作為培養液, 并添加營養鹽3 mg/L)和二氧化鍺(2 mg/L, 抑制硅藻繁殖)。
1.2 方法
實驗于光照培養箱中進行, 鼠尾藻嫩芽長度為1~2 cm, 放于盛有200 mL培養液的燒杯中培養。葉綠素熒光參數的測定均采用水下飽和脈沖葉綠素熒光儀(DIVING-PAM, WALZ, Germany)。測定方法如下:嫩芽進行暗適應30 min后再測Fv/Fm; 測定快速光曲線時, 設置的光合有效輻射(PAR)分別為26、48、88、131、176、254、399、499 μmol/(m2·s), 每個 PAR照射10 s。所測定的參數由數據采集軟件wincontrol計算出。以下每個處理組做4個平行。
光強實驗設置3個光照度(低、中、高光強分別為:30~40 μmol/(m2·s)、60~80 μmol/(m2·s)和 180~220 μmol/(m2·s), 培養條 件為:白色日光燈, 光周期12L:12D, 溫度18℃, 鹽度33。測定培養1 h后鼠尾藻嫩芽的Fv/Fm值。
溫度實驗設置 7個溫度組(5、10、26、28、30、32 和 34℃)與對照組(18℃)。培養條件為:白色日光燈, 光照度 60~80 μmol/(m2·s), 光周期12L:12D, 鹽度33。分別測定培養 1 h后和在對照條件下恢復培養24 h后鼠尾藻嫩芽的Fv/Fm及快速光曲線。
鹽度實驗設置 6個鹽度組(0、10、20、40、50和60)與對照組(鹽度33)。培養條件為:白色日光燈, 光照度 60~80 μmol/(m2·s), 光周期 12L:12D, 溫度 18℃。分別測定培養 0.5、1、2、4、6、9 h后和在對照條件下恢復培養24 h后鼠尾藻嫩芽的Fv/Fm及快速光曲線。
1.3 數據處理
采用Excel和SPSS軟件進行方差、顯著性分析等數據處理(以P<0.01作為極顯著性差異, 以P<0.05作為顯著性差異), 用 GraphPad Prism 軟件繪制圖形。為了對快速光曲線進行定量比較, 需進行曲線擬合, 利用下面公式擬合曲線[27]:
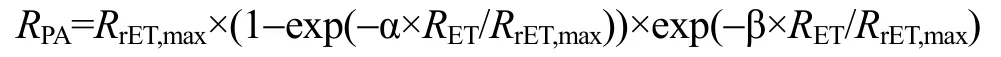
曲線擬合采用最小二乘法, 用 Statistica軟件進行。公式中的符號含義是:RPA為光合有效輻射;RET為電子傳遞速率;RrET,max為最大潛在相對電子傳遞速率; α為快速光曲線的初始斜率; β為快速光曲線下降階段的斜率。
2 結果
2.1 光強實驗
鼠尾藻嫩芽在中等光強下, 處理1 h后Fv/Fm值略微升高; 在低光強下, 處理1 h后Fv/Fm值略微降低。中、低光強組, 處理前后Fv/Fm值差異不顯著(P>0.05)。而在高光強下,Fv/Fm值在處理前后差異顯著(P<0.05), 見圖1。另外, 高光強組的鼠尾藻換為在60~80 μmol/(m2·s)的光照度下培養 24 h 后測其Fv/Fm值, 發現其Fv/Fm值能恢復正常。
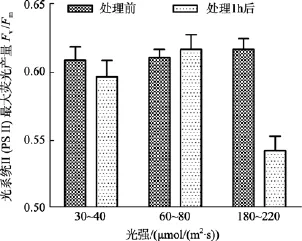
圖1 不同光強處理前及處理1 h后鼠尾藻嫩芽的 Fv/Fm(n=4)Fig. 1 The optimal chlorophyll fluorescence quantum yields (Fv/Fm) of newborn branches of S. thunbergii before and 1 h after exposure to different light intensity respectively
2.2 溫度實驗
除了5℃和34℃處理組, 其他溫度組在處理1 h后光系統 II(PSII)最大熒光產量Fv/Fm值與對照組(18℃)間差異不顯著(P>0.05)。在恢復培養 24h后,34℃處理組的Fv/Fm值與對照組間差異顯著(P<0.05),而5℃組的Fv/Fm值可基本恢復正常(P>0.05), 見圖2。
由圖3看出, 10℃和26℃組處理1 h后的RrET,max值與對照組(18℃)的相差較小。32℃和34℃組處理1 h后的RrET,max值均明顯低于對照組(P<0.05), 分別為對照組的81.06%、64.81%。5、28和30℃組處理1 h后的RrET,max值低于對照組, 但未達到顯著程度(P>0.05)。恢復培養24 h后, 32℃和34℃處理組的RrET,max值均明顯低于對照組(P<0.05), 分別為對照組的82.64%、71.84%。
5℃和34℃組處理1 h后快速光曲線的初始斜率α值均顯著低于對照組(P<0.05), 分別為對照組的81.08%、83.36%。恢復培養24 h后, 32℃和34℃處理組的初始斜率α值均明顯低于對照組(P<0.05), 分別為對照組的90.06%、89.59%, 見圖4。
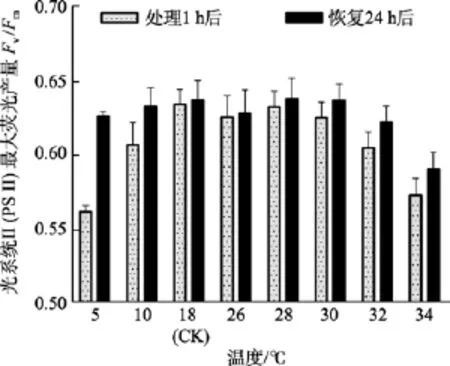
圖2 不同溫度處理1 h及恢復培養24 h后鼠尾藻嫩芽的Fv/Fm(n=4)Fig. 2 The optimal chlorophyll fluorescence quantum yields (Fv/Fm) of newborn branches of S. thunbergii after exposure to different temperatures for 1 h and the corresponding values 24 h after recovered culture
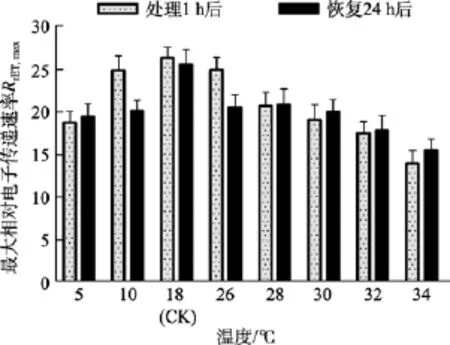
圖3 不同溫度處理1 h及恢復培養24 h后鼠尾藻嫩芽的最大相對電子傳遞速率RrET,max(n=4)Fig. 3 The maximum relative electron transport rate(RrET,max) of newborn branches of S. thunbergii after exposure to different temperatures for 1 h and the corresponding values 24 h after recovered culture
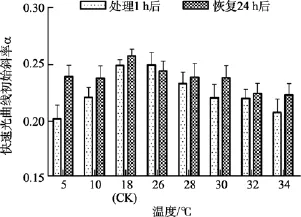
圖4 不同溫度處理1 h及恢復培養24 h后鼠尾藻嫩芽的快速光曲線初始斜率α(n=4)Fig. 4 The initial slope (α) of the rapid light curve of newborn branches of S. thunbergii after exposure to different temperatures for 1 h and the corresponding values 24 h after recovered culture
2.3 鹽度實驗
無論是高鹽處理還是低鹽處理, 隨著時間的延長, 鼠尾藻嫩芽各個處理組的Fv/Fm值、RrET,max值均呈降低的趨勢。
由圖5可知, 對于Fv/Fm值, 鹽度 0、50和 60組在處理 6 h時,Fv/Fm值與對照組間差異極顯著(P<0.01)。鹽度60組在處理9 h后恢復培養24 h, 其Fv/Fm和RrET,max值與對照組間差異顯著(P<0.05), 見圖6和圖7。
由圖8可知, 鹽度0和60組的RrET,max值在處理9 h內均明顯低于對照組(鹽度33), 其大致在對照組的 74%~88%范圍內波動變化。鹽度 10、20、40和50處理組的RrET,max值大致呈線性下降變化。
3 討論
葉綠素熒光與光合作用密切相關, 環境因子對光合作用的影響可通過葉綠素熒光參數反映出來[28]。經過充足暗適應后測出的Fv/Fm反映了當時所有的PSII反應中心均處于開放態時的量子產量, 即植物的潛在最大光合能力, 是衡量 PSII完整性的指標[29]。在正常生理狀態下,Fv/Fm是一個很穩定的值,藻類約為0.65[30], 當受到脅迫時, 其值顯著下降[31]。PSII的相對光合電子傳遞速率(RET)是反映實際光強下的表觀電子傳遞速率; 快速光曲線的初始斜率,反映了光能利用效率[29,32]。
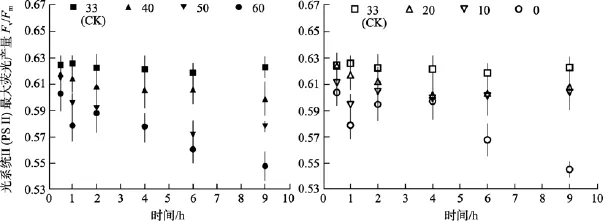
圖5 不同鹽度處理0.5 h、1 h、2 h、4 h、6 h及9 h后鼠尾藻嫩芽的Fv/Fm(n=4)(圖的左邊是高鹽, 右邊是低鹽)Fig. 5 The otimal chlorophyll fluorescence quantum yields (Fv/Fm) of newborn branches of S. thunbergii after exposure to different salinities for 0.5, 1, 2, 4, 6 and 9 h respectively(Left side:high salinities; Right side:low salinities)
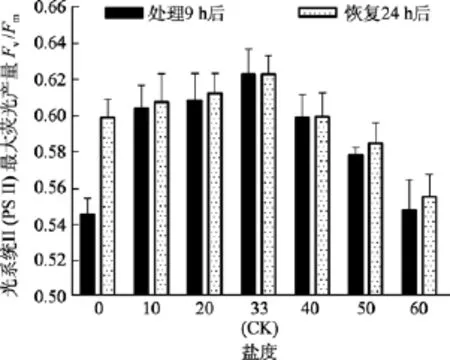
圖6 不同鹽度處理9 h和恢復培養24 h后鼠尾藻嫩芽的Fv/Fm(n=4)Fig. 6 The Fv/Fm of newborn branches of S. thunbergii after exposure to different salinities for 9 h and the values 24 h after recovered culture
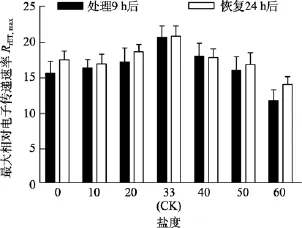
圖7 不同鹽度處理9 h和恢復培養24 h后鼠尾藻嫩芽的RrET,max(n=4)Fig. 7 The RrET,max of newborn branches of S. thunbergii after exposure to different salinities for 9 h and the values 24 h after recovered culture
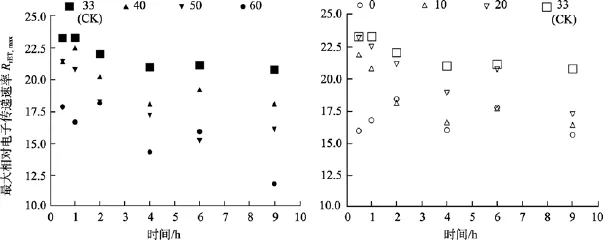
圖8 不同鹽度處理0.5 h、1 h、2 h、4 h、6 h及9 h后鼠尾藻嫩芽的RrET,max(n=4)(圖的左邊是高鹽, 右邊是低鹽)Fig. 8 The maximum relative electron transport rate (RrET,max) of newborn branches of S. thunbergii after exposure to six salinities for 0.5,1,2,4 ,6 and 9 h respectively(Left side:high salinities; Right side:low salinities)
一般來說,Fv/Fm值下降是植物葉片發生光抑制的重要特征[33-34]。本實驗中, 高光強處理下,Fv/Fm值明顯下降, 說明高光強可能使鼠尾藻嫩芽產生了光抑制, 即其光合機構由于吸收了過剩光能而引起光合能力和光合活性下降; 而換為中光強下培養后則能恢復正常, 說明在本實驗條件下鼠尾藻嫩芽受強光脅迫是可逆失活。有研究指出, 有效的能量耗散過程是強光脅迫下防御光破壞的一個重要機制, 而PSII反應中心的可逆失活可能是防御PSII反應中心免受光破壞的主要保護機制[35-36]。
研究表明, PSII的活性在高溫時受到抑制, 它是最易熱敏感的色素蛋白復合體之一[37-38]。類囊體膜含有光合色素和電子傳遞鏈組分, 是進行光反應的部位, 其對高溫也非常敏感, 高溫可導致其結構的改變[39]。本次溫度實驗, 5℃處理1 h后鼠尾藻嫩芽Fv/Fm、RrET,max和初始斜率α值均發生不同程度的降低, 但恢復培養24 h后上述參數均能基本恢復正常(P>0.05), 而32℃和34℃組處理1 h后上述參數均顯著降低且不能恢復正常。這表明短時間的低溫處理對鼠尾藻嫩芽的光合系統沒有大的破壞性, 而溫度大于 32℃時使鼠尾藻嫩芽光合電子傳遞過程受抑制和損傷, 光合電子傳遞速率下降, 光能利用效率下降。同為馬尾藻屬, 銅藻的幼苗在 35℃高溫下脅迫1 h也對其PSII造成了非逆轉的損傷, 其可耐受的溫度上限為28℃[14], 而羊棲菜幼苗卻能耐受長達6 h的40℃高溫[13]。
羊棲菜的幼苗能耐受淡水 6 h的低鹽脅迫[13];銅藻幼苗同樣具有較強耐受鹽度變化的能力, 其能耐受高鹽60處理6 h和低鹽0處理1 h[14]。本次鹽度脅迫的實驗結果說明即使是低鹽度0和高鹽度50處理 9 h, 在恢復培養 24 h后鼠尾藻嫩芽的Fv/Fm和RrET,max值也基本能恢復到正常水平(P>0.05), 表明鼠尾藻嫩芽也能夠耐受較大范圍的滲透壓變化。有研究指出, Na+傳遞系統是藻類耐鹽的最重要決定因素[40]; Na+轉運ATP酶在藻細胞質離子動態平衡中起著關鍵作用[41]。那么, 鼠尾藻嫩芽是否可能具有較強大的離子傳遞系統, 還有待進一步研究驗證。
綜上所述, 鼠尾藻嫩芽易受強光、高溫脅迫, 在強光照射下, 其Fv/Fm值明顯降低, 溫度大于30℃時對其光合作用有顯著影響。5℃低溫處理1 h或0~60鹽度處理9 h后, 鼠尾藻嫩芽的光系統Ⅱ受到顯著影響, 但24 h恢復后, 除了鹽度60組, 其他組的葉綠素熒光參數均可基本恢復正常。所以在養殖過程中,鼠尾藻嫩芽生長階段應采取遮光、降溫等措施, 若要除去對低鹽敏感的附生生物, 可用淡水沖洗或浸泡數小時。
[1]韓曉弟, 李嵐萍. 鼠尾藻特征特性與利用[J]. 特種經濟動植物, 2005, (1):27.
[2]林超, 于曙光, 郭道森, 等. 鼠尾藻中褐藻多酚化合物的抑菌活性研究[J]. 海洋科學, 2006, 30(3):94-97.
[3]劉朝陽, 孫曉慶, 范士亮. 當前刺參養殖面臨的主要困境及發展策略[J]. 飼料工業, 2006, 27(22):28-30.
[4]史大永, 李曉紅, 李敬, 等. 海藻提取物環氧加酶-2抑制活性研究[J]. 海洋科學, 2009, 33(7):30-32.
[5]魏玉西, 于曙光. 兩種褐藻乙醇提取物的抗氧化活性研究[J]. 海洋科學, 2002, 26(9):49-51.
[6]吳海一, 詹冬梅, 劉洪軍, 等. 鼠尾藻對重金屬鋅、鎘富集及排放作用的研究[J]. 海洋科學, 2010, 34(1):69-74.
[7]王飛久, 孫修濤, 李鋒. 鼠尾藻的有性繁殖過程和幼苗培育技術研究[J]. 海洋水產研究, 2006, 27(5):1-6.
[8]孫修濤, 王飛久, 汪文俊, 等. 基于有性繁殖的鼠尾藻規模化繁育試驗[J]. 漁業科學進展, 2010, 31(3):84-91.
[9]鄒吉新, 李源強, 劉雨新, 等. 鼠尾藻的生物學特性及筏式養殖技術研究[J]. 齊魯漁業, 2005, 22(3):25-29.
[10]張澤宇, 李曉麗, 韓余香, 等. 鼠尾藻的繁殖生物學及人工育苗的初步研究[J]. 大連水產學院學報, 2007,22(4):255-259.
[11]詹冬梅, 李美真, 丁剛, 等. 鼠尾藻有性繁育及人工育苗技術的初步研究[J]. 海洋水產研究, 2006, 27(6):55-59.
[12]潘金華, 張全勝, 許博. 鼠尾藻有性繁殖和幼孢子體發育的形態學觀察[J]. 水產科學, 2007, 26(11):589-592.
[13]Pang S J, Zhang Z H, Zhao H J, et al. Cultivation of the brown algaHizikia fusiformis(Harvey) Okamura:stress resistance of artificially raised young seedlings revealed by chlorophyll fluorescence measurement[J].Journal of Applied Phycology, 2007, 19(5):557-565.
[14]張玉榮, 劉峰, 單體鋒, 等. 利用葉綠素熒光技術揭示人工培育的銅藻幼苗對脅迫溫度、光照和鹽度的反應[J]. 南方水產, 2009, 5(2):1-9.
[15]Govindje E. Sixty-three years since Kautsky:Chlorophyll a fluorescence[J]. Australian Journal of Plant Physiology, 1995, 22(2):131-160.
[16]陳建明, 俞曉平, 程家安. 葉綠素熒光動力學及其在植物抗逆生理研究中的應用[J]. 浙江農業學報, 2006,18(1):51-55.
[17]陳貽竹, 李曉萍, 夏麗, 等. 葉綠素熒光技術在植物環境脅迫研究中的應用[J]. 熱帶亞熱帶植物學報,1995, 3(4):79-86.
[18]梁英, 馮力霞, 尹翠玲, 等. 葉綠素熒光技術在微藻環境脅迫研究中的應用現狀及前景[J]. 海洋科學,2007, 31(1):71-76.
[19]王帥, 梁英, 馮力霞, 等. 重金屬脅迫對杜氏鹽藻生長及葉綠素熒光特性的影響[J]. 海洋科學, 2010,34(10):38-48.
[20]王昭玉, 王江濤. 葉綠素熒光檢測技術在浮游植物營養鹽限制研究中的應用[J]. 海洋科學, 2008, 32(12):97-101.
[21]Lin A P, Wang G C, Shen S D, et al. Two specific causes of cell mortality in freeze-thaw cycle of young thalli ofPorphyra yezoensis(Bangiales, Rhodophyta)[J]. Journal of Phycology, 2010, 46(4):773-779.
[22]Wang Z Y, Wang G C, Niu J F, et al. Optimization of conditions for tetraspore release and assessment of photosynthetic activities for different generation branches of Gracilaria lemaneiformis Bory[J]. Chinese Journal of Oceanology and Limnology, 2010, 28(4):738-748.
[23]Lin A P, Shen S D, Wang G C, et al. Comparison of chlorophyll and photosynthesis parameters of floating and attachedUlva prolifera[J]. Journal of Integrative Plant Biology, 2011, 53(1):25-34.
[24]Pang S J, Jin Z H, Sun J Z, et al. Temperature tolerance of young sporophytes from two populations ofLaminaria japonicarevealed by chlorophyll fluorescence measurements and short-term growth and survival performances in tank culture[J]. Aquaculture, 2007, 262(2):493-503.
[25]王增福. 鼠尾藻的生理生態和繁殖生物學研究[D].中國科學院海洋研究所, 2007.
[26]孫修濤, 王飛久, 劉桂珍. 鼠尾藻新生枝條的室內培養及條件優化[J]. 海洋水產研究, 2006, 27(5):7-12.
[27]Peter J R, Rolf G. Rapid light curves:A powerful tool to assess photosynthetic activity[J]. Aquatic Botany, 2005,82(3):222-237.
[28]Schreiber U, Gademann R, Ralph P J, et al. Assessment of photosynthetic performance of prochloron inLissoclinum patellain hospite by chlorophyll fluorescence measurements[J]. Plant and Cell Physiology, 1997,38(8):945-951.
[29]張守仁. 葉綠素熒光動力學參數的意義及討論[J].植物學通報, 1999, 16(4):444-448.
[30]Kolber Z, Zehr J, Falkowski P G. Effects of growth irradiance and nitrogen limitation on photosynthesis energy conversion in photosystem II[J]. Plant Physiology, 1988, 88(3):923-929.
[31]許大全, 張玉忠, 張榮銑. 植物光合作用光抑制[J].植物生理學通訊, 1992, 28(4):237-243.
[32]Krause G H. Photoinhibition of photosynthesis:an evaluation of damaging and Protective mechanisms[J].Physiologia Plantarum, 1988, 74(3):566-574.
[33]Dodd I C, Critchley C, Woodall G S, et al. Photoinhibition in differently coloured juvenile leaves of syzygium species[J]. Journal of Experimental Biology, 1998,49(325):1 437-1 445.
[34]Krause G H, Weis E. Chlorophyll fluorescence and photosynthesis:The basics[J]. Annual Reviews of Plant Physiology and Plant Molecular Biology, 1991, 42:313-349.
[35]郭連旺, 沈允鋼. 高等植物光合機構避免強光破壞的保護機制[J]. 植物生理學通訊, 1996, 32(1):1-8.
[36]李新國, 孟慶偉, 趙世杰. 強光脅迫下銀杏葉片的光抑制及其防御機制[J]. 林業科學, 2004, 40(3):56-59.
[37]Morgan-Kiss R, Ivanov A G, Williams J, et al. Differential thermal effects on the energy distribution between photosystemⅡ and photosystemⅠ in thylakoid membranes of a psychrophilic and mesophilic alga[J].Biochimicaet Biophysica Acta, 2002, 1 561(2):251-265.
[38]Wen X, Gong H, Lu C. Heat stress induces an inhibi-tion of excitation energy transfer from phycobilisomes to photosystem II but not to photosystem I in a cyanobacteriumSpirulina platensis[J]. Plant Physiology and Biochemistry, 2005, 43(4):389-395.
[39]郭延平, 周慧芬, 曾光輝, 等. 高溫脅迫對柑橘光合速率和光系統活性的影響[J]. 應用生態學報, 2003,14(6):867-870.
[40]Serrano R, Mulet J M, Rios G, et al. A glimpse of the mechanisms of ion homeostasis during salt stress[J].Journal of Experimental Botany, 1999, 50:1023-1036.
[41]Balnokin Y, Popova L, Gimmler H. Further evidence for an ATP-driven sodium pump in the marine algaTetraselmis (Platymonas) viridis[J]. Journal of Plant Physiology, 1997, 150:264-270.
Effects of light intensity, temperature and salinity on newborn branches ofSargassum thunbergiievaluated with chlorophyll fluorescence assay
LIANG Zhou-rui1,2, WANG Fei-jiu1, SUN Xiu-tao1, WANG Wen-jun1, DING Chang-ling1, LI Tao1
(1. Key Laboratory for Sustainable Utilization of Marine Fishery Resources, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China; 2. Aquatic and Life School, Shanghai Ocean University, Shanghai 201306, China)
May, 13, 2011
Sargassum thunbergii; stress condition; chlorophyll fluorescence parameters
The effects of different light intensity (25~220 μmol/(m2·s)), temperatures (5~34℃) and different salinities (0~60) on chlorophyll fluorescence parameters of newborn branches ofSargassum thunbergiiwere studies in this paper. The optimal chlorophyll fluorescence quantum yield of photosystem II (Fv/Fm), maximum relative electron transport rate (RrET,max) and initial slope of rapid light curve were determined. The results show:(1) The newborn branch ofS. Thunbergiisuffered from high intensity light and high temperature stress easily and theFv/Fmdecreased significantly under high intensity light. The photosynthesis was remarkably affected when the temperature was higher than 30℃. (2) One hour treatment at 5℃ or nine-hour treatment at 0~60 salinity affected the photosystem II obviously. However, the chlorophyll fluorescence parameters could nearly recover to normal level after 24 hours under standard culture condition except those in 60 salinity group. The preliminary analysis of the newborn branches ofS. thunbergiiabout resistance physiology could provide reference for the artificial cultivation ofS.thunbergii.
Q945.78
A
1000-3096(2011)12-0021-07
2011-05-13;
2011-08-12
國家“863”計劃項目(2006AA10A416, 2012AA100813); 公益性行業(農業)專項(200903030)
梁洲瑞(1986-), 男, 廣西欽州人, 碩士研究生, 主要從事海藻生物學研究, E-mail:liangzhourui@163.com; 王飛久, 通信作者, 研究員, E-mail:wangfj@ysfri.ac.cn, 電話:0532-85838673
張培新)

