TassC結(jié)合過氧化物酶體對早期受染巨噬細胞內(nèi)的鼠傷寒沙門菌的影響
潘欣,蔡家麟,李廣波,李晗,陳龍,吳鑒今
(第二軍醫(yī)大學微生物學教研室,上海200433)
鼠傷寒沙門菌(Salmonella typhimurium,St)可引起人胃腸炎,可使鼠產(chǎn)生傷寒樣膿血癥并致死,是研究人傷寒的一種常用模式微生物[1]。該菌屬于細胞內(nèi)致病菌,其感染細胞后一個顯著特性是能夠形成一個膜性小泡(salmonella-containing vacuole,SCV)。該菌侵入細胞后,雖可刺激巨噬細胞產(chǎn)生多種細胞因子、抗菌肽等物質(zhì)殺傷胞內(nèi)菌,但該菌有數(shù)種致病基因可以使其或者在宿主細胞內(nèi)開發(fā)自己的小生境獲取營養(yǎng);或者干擾宿主的防御機制得以生存[2]。沙門菌通過Ⅲ型分泌系統(tǒng)(typeⅢsecretion system,TTSS)將細菌的毒力因子分泌轉(zhuǎn)運到宿主細胞[3]。沙門菌有2個Ⅲ型分泌系統(tǒng)(TTSS-1和TTSS-2)[4],其中致病島Ⅰ(salmonella pathogenesis island,SPI)編碼的Ⅲ型分泌系統(tǒng)TTSS-1在細菌感染的最初階段發(fā)揮作用,調(diào)節(jié)沙門菌與腸上皮細胞的相互作用,介導細菌的內(nèi)化及促炎因子的產(chǎn)生[5]。致病島Ⅱ(SPI-2)編碼的Ⅲ型分泌系統(tǒng)TTSS-2在細菌所致的系統(tǒng)性感染中發(fā)揮重要作用,當細菌進入宿主細胞后,TTSS-2的效應(yīng)蛋白被轉(zhuǎn)運至細胞內(nèi)的不同部位,包括細胞核、細胞質(zhì)、細胞骨架及吞噬體等,這些不同的定位模式提示這些效應(yīng)蛋白可能調(diào)控宿主細胞的多種功能[6]。SPI-2系統(tǒng)可以分泌很多蛋白,其中SpiC可以與宿主細胞的Hook3相互作用而抑制SCV與溶酶體的融合[7]。宿主細胞編碼的一種NIPSNAP家族名為TassC(Target for Salmonella secreted protein SpiC,TassC)的蛋白可以與SpiC相互作用[8],SpiC阻止含TassC囊泡募集到SCV而繞開細胞內(nèi)的降解途徑,可以通過干擾SCV沿肌動蛋白細胞骨架運動或通過阻止攜帶細菌特異性成分的囊泡與溶酶體融合來實現(xiàn)[8]。沙門菌分泌的SifA和SseJ可以影響肌動蛋白重組織[9],但SpiC對細胞骨架沒有影響,卻在體內(nèi)和體外阻止囊泡之間的融合[10]。而SpiC究竟阻止哪類囊泡的融合目前還不清楚。我們曾發(fā)現(xiàn)TassC多抗磁珠可以結(jié)合過氧化物酶體標志物過氧化氫酶(catalase)和可誘導型一氧化氮合成酶(iNOS)[11];最近的研究發(fā)現(xiàn)TassC定位于細胞的過氧化物酶體上,而過氧化物酶體和TassC在沙門菌感染后出現(xiàn)在沙門菌吞噬泡周圍。推測在感染早期,TassC結(jié)合過氧化物酶體攜帶iNOS參與殺菌機制;而隨著感染時間的延長,胞內(nèi)菌分泌至細胞的SpiC得以積累[12],并通過與TassC的結(jié)合而阻止過氧化物酶體及其攜帶的殺菌物質(zhì)與鼠傷寒沙門菌結(jié)合,殺菌作用被抑制,使部分細菌在胞內(nèi)得以生存,感染的晚期事件還有待實驗進一步驗證。
1 材料與方法
1.1 材料
1.1.1 細胞系和菌株鼠傷寒沙門菌ATCC 14028(以下簡稱ST)購于美國ATCC;鼠巨噬細胞RAW264.7購于中國科學院上海細胞生物研究所。
1.1.2 主要試劑與儀器pDsRed2-Perxi和pTassC-GFP質(zhì)粒為本課題組保存;SYTO42購于美國Invitrogen公司;山羊抗人溶酶體相關(guān)膜蛋白(LAMP-1)購于美國Santa Cruz公司;FuGENE 6購于瑞士Roche公司;Olympus IX81熒光顯微鏡購于日本Olympus公司。
1.2 方法
1.2.1 鼠巨噬細胞過氧化物酶體和TassC的熒光標記將鼠巨噬細胞RAW264.7以3×105細胞/孔的密度平鋪于放有無菌蓋玻片的6孔板內(nèi),37℃5%CO2孵育至細胞80%匯合時,取3 μL FuGENE 6與200 μL Opti-MEMⅠ無血清培養(yǎng)基混合,加入2 μg質(zhì)粒(過氧化物酶體組為2 μg pDsRed2質(zhì)粒;TassC組為2 μg pTassC-GFP質(zhì)粒;過氧化物酶體-TassC組為pDsRed2-Perxi和pTassC-GFP質(zhì)粒各1 μg;對照組為2 μg pcDNA 3.1-GFP質(zhì)粒),分別混勻后室溫靜置20 min。各孔細胞分別用Opti-MEMⅠ無血清培養(yǎng)基洗滌1次,加入FuGENE 6-質(zhì)粒混合物,并補充800 μL Opti-MEMⅠ無血清培養(yǎng)基,37℃5%CO2孵育4 h后,換含有10%小牛血清的DMEM培養(yǎng)基繼續(xù)培養(yǎng)48 h。用熒光顯微鏡鑒定陽性細胞,pD-sRed2質(zhì)粒轉(zhuǎn)染陽性細胞名為RAW-D細胞,pTassC質(zhì)粒轉(zhuǎn)染陽性細胞名為RAW-T細胞,pD-sRed2-Perxi和pTassC-GFP質(zhì)粒轉(zhuǎn)染陽性細胞名為RAW-DT細胞,pcDNA3.1-GFP質(zhì)粒轉(zhuǎn)染陽性細胞名為RAW-G。
1.2.2 免疫染色6孔板無菌蓋玻片上的質(zhì)粒轉(zhuǎn)染的巨噬細胞,染色前用PBS洗3次,加4%多聚甲醛(Polysciences)固定30 min,用PBS洗,經(jīng)含0.5%Triton X-100(Shelton Scientific)的PBS透化30 min后,再用Image-iT FX信號增強劑(In-
2 結(jié)果與分析
2.1 巨噬細胞TassC位于囊泡結(jié)構(gòu)中
綠色熒光蛋白在激發(fā)光譜為489 nm、發(fā)射光譜為508 nm的熒光顯微鏡下呈綠色,所用濾光片vitrogen)封閉30 min。將一抗和二抗用PBS稀釋至適當濃度依次于室溫孵育60 min。染色并干燥后的蓋玻片用抗褪色金牌介質(zhì)(Invitrogen)在載玻片上裝片。指甲油封片。溶酶體標志物山羊抗人溶酶體相關(guān)膜蛋白(Lamp-1)多抗或過氧化物酶體標志物山羊抗人過氧化氫酶(catalase)多抗分別以1∶500稀釋。用鍵合了Alexa 594的驢抗山羊IgG(Invitrogen)顯色。
1.2.3 鼠傷寒沙門菌ATCC 14028感染質(zhì)粒轉(zhuǎn)染鼠巨噬細胞ST接種于LB培養(yǎng)基上,37℃過夜培養(yǎng)(不振蕩)。收獲細菌用不含抗生素的Opti-MEM I無血清培養(yǎng)基洗滌3次并懸浮于該培養(yǎng)基中,加入細胞滲透性熒光染料SYTO42至終濃度為1 μmol/L,渦旋混勻后室溫孵育30 min。用不含抗生素的Opti-MEMⅠ無血清培養(yǎng)基洗滌3次去除浮色,再懸浮于該培養(yǎng)基中。以10∶1(細菌∶細胞)的比例感染質(zhì)粒轉(zhuǎn)染48 h的細胞,1 000 r/min室溫離心5 min,然后在37℃5%CO2孵箱中放置60 min,PBS洗滌3次,加4%多聚甲醛(Polysciences)固定30 min,用PBS洗。干燥后的蓋玻片用抗褪色金牌介質(zhì)(Invitrogen)在載玻片上裝片。指甲油封片。為FITC。pcDNA3.1-GFP質(zhì)粒轉(zhuǎn)染的陽性細胞可見綠色熒光蛋白GFP散布于細胞質(zhì)中,沒有成形的結(jié)構(gòu)(圖1);pTassC-GFP質(zhì)粒轉(zhuǎn)染的陽性RAW-T細胞可見發(fā)綠色熒光的TassC位于有形的囊泡結(jié)構(gòu)中(圖2)。
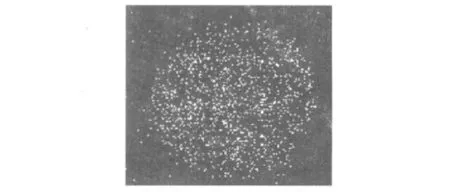
圖1 pcDNA3.1-GFP質(zhì)粒轉(zhuǎn)染RAW264.7細胞示綠色熒光蛋白GFP散布于細胞質(zhì)中Fig.1 The pcDNA3.1-GFP plasmids carrying green fluorescent protein showed dispersed pattern in RAW264.7 cytoplasm
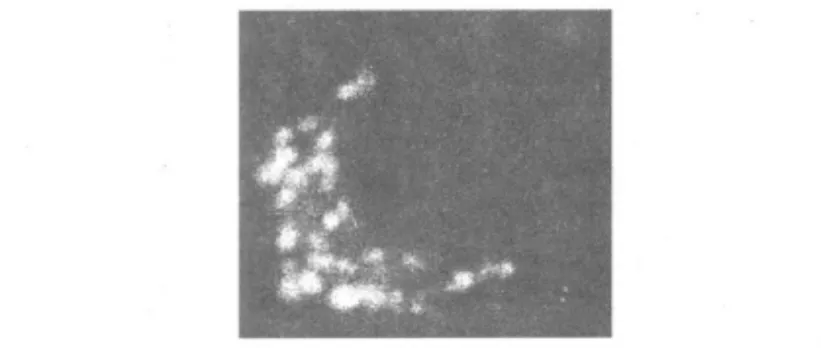
圖2 pTassC-GFP質(zhì)粒轉(zhuǎn)染RAW264.7細胞示發(fā)綠色熒光的TassC-GFP位于囊泡結(jié)構(gòu)中Fig.2 The pTassC-GFP plasmids carrying TassC-GFP localized in vesicular structures in RAW264.7 cells
2.2 巨噬細胞TassC與溶酶體、過氧化物酶體的關(guān)系

圖3 RAW-T細胞TassC-GFP囊泡與溶酶體無共定位Fig.3 TassC-GFP uncolocalize with lysosomal marker Lamp-1 in RAW-T cells
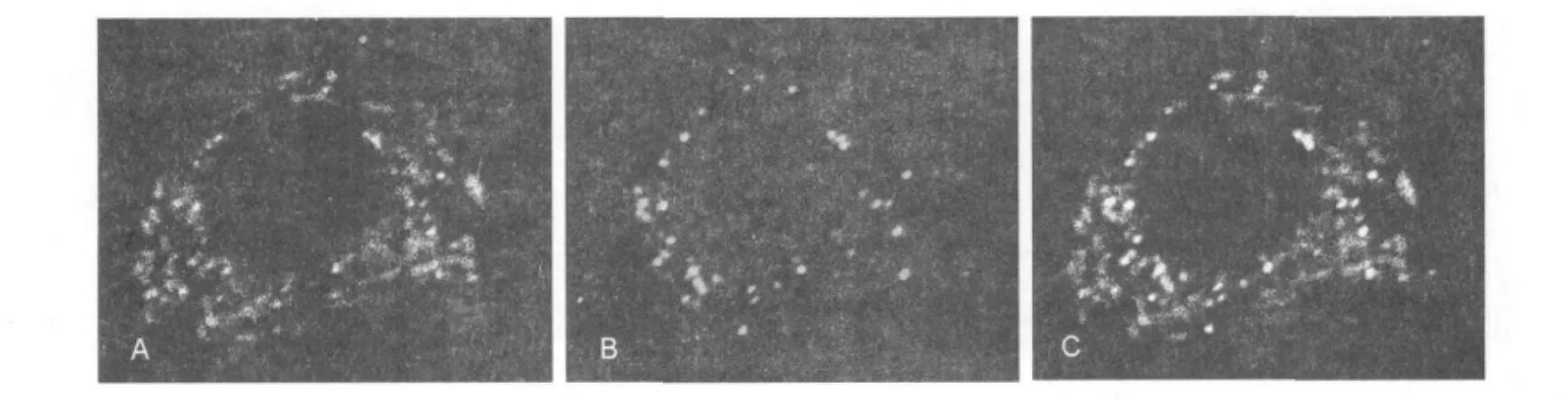
圖4 RAW-DT細胞TassC-GFP囊泡與過氧化物酶體共定位Fig.4 TassC-GFP colocalize with peroxisome in RAW-DT cells
RAW-T細胞的免疫熒光結(jié)果顯示溶酶體標志物Lamp-1與TassC-GFP囊泡結(jié)構(gòu)區(qū)域無共定位(圖3),即溶酶體與TassC囊泡兩者不結(jié)合;pDsRed2-Perxi質(zhì)粒含PTS1序列,可將紅色熒光蛋白轉(zhuǎn)入過氧化物酶體基質(zhì)中,pDsRed2-Perxi和pTassC-GFP質(zhì)粒共轉(zhuǎn)染的陽性RAW-DT細胞中可見發(fā)綠色熒光的TassC-GFP可與發(fā)紅色熒光的過氧化物酶體共定位(圖4),即過氧化物酶體可與TassC囊泡結(jié)合。
2.3 巨噬細胞TassC與過氧化物酶體聚在入侵巨噬細胞的鼠傷寒沙門菌周圍
SYTO42標記的鼠傷寒沙門菌感染RAW-DT細胞1 h,可見細胞內(nèi)發(fā)藍綠色熒光的鼠傷寒沙門菌吞噬泡(Salmonella-containing vacuole,SCV)可與發(fā)綠色熒光的TassC-GFP和發(fā)紅色熒光的過氧化物酶體共定位(圖5),且過氧化物酶體和TassC在SCV周圍集聚較多。
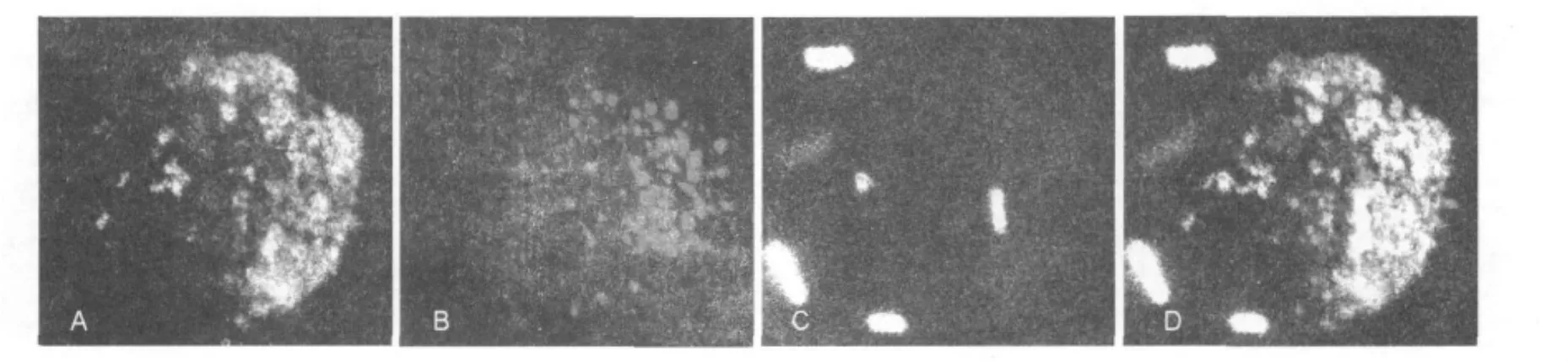
圖5 鼠傷寒沙門菌入侵RAW-DT招募TassC-GFP囊泡與過氧化物酶體Fig.5 TassC-GFP on peroxisome was recruitmented to the Salmonella-containing vacuole in RAW-DT cells
3 討論
沙門菌感染細胞形成的傷寒沙門菌吞噬泡SCV,其暫時獲得的早期可循環(huán)內(nèi)涵體標志物,如早期內(nèi)涵體抗原1(Eea1)、轉(zhuǎn)鐵蛋白受體(Tfr1)、Rab5和Rab11,迅速被晚期內(nèi)涵體標志物(如空泡ATP酶和Rab7)所取代;隨后吞噬泡還會獲得溶酶體標志物如Lamp-1(lysosome-associated membrane proteins,Lamp),但沒有其他的溶酶體活性標志物,如6-磷酸甘露糖、組織蛋白酶L和組織蛋白酶D等水解酶[13]。這使含有寄生菌的囊泡得以偽裝而逃逸宿主細胞的防御損傷。
本研究發(fā)現(xiàn)與鼠傷寒細菌產(chǎn)生的SpiC相互作用的TassC在細菌侵入早期可以與過氧化物酶體結(jié)合,并招募過氧化物酶體聚集在細菌周圍。過氧化物酶體屬于真核細胞中的呼吸類細胞器,行使的功能十分廣泛,在脂質(zhì)代謝和過氧化氫解毒方面起重要作用。已有的研究表明,誘導型一氧化氮合酶(iNOS)在鼠肝細胞中定位于過氧化物酶體[14],iNOS催化產(chǎn)生的NO˙具有重要的殺菌、抗病毒、殺傷腫瘤細胞等活性[15]。過氧化物酶體募集到吞噬泡周圍可能已經(jīng)獲得了如iNOS[14]或其他天然殺菌的催化酶,有可能在過氧化物酶體貼近吞噬泡時實現(xiàn)了iNOS的殺菌功能。TassC和過氧化物酶體及其攜帶的誘導型一氧化氮合酶在鼠傷寒沙門菌感染中晚期是否由于SpiC的大量產(chǎn)生而遠離胞內(nèi)菌使之得以在胞內(nèi)繼續(xù)生存值得進一步研究。
[1] 潘欣.鼠傷寒沙門菌感染巨噬細胞鐵穩(wěn)態(tài)相關(guān)基因的mRNA表達譜[J].微生物學雜志,2008,28(3):15-20.
[2] Pan X,Tamilselvam B,Hansen EJ,et al.Modulation of iron homeostasis in macrophages by bacterial intracellular pathogens[J].BMC Microbiol,2010,10:64.
[3] Hueck CJ.Type III protein secretion systems in bacterial pathogens of animals and plants[J].Microbiol Mol Biol Rev,1998,62(2):379-433.
[4] Galán JE,Ginocchio C,Costeas P.Molecular and functional characterization of the Salmonella invasion gene invA:homology of InvA to members of a new protein family[J].J Bacteriol,1992,174(13):4338-4349.
[5] Galán JE.Interactions of Salmonella with host cells:encounters of the closest kind[J].Proc Natl Acad Sci USA,1998,95(24):14006-14008.
[6] Shea JE,Hensel M,Gleeson C,et al.Identification of a virulence locus encoding a second type III secretion system in Salmonella typhimurium[J].Proc Natl Acad Sci USA,1996,93(6):2593-2597.
[7] Shotland Y,Kr?mer H,Groisman EA.The Salmonella SpiC protein targets the mammalian Hook3 protein function to alter cellular trafficking[J].Mol Microbiol,2003,49(6):1565-1576.
[8] Lee AH,Zareei MP,Daefler S.Identification of a NIPSNAP homologue as host cell target for Salmonella virulence protein SpiC[J].Cell Microbiol,2002,4(11):739-750.
[9] Beuzón CR,Méresse S,Unsworth KE,et al.Salmonella maintains the integrity of its intracellular vacuole through the action of SifA[J].EMBO J,2000,19(13):3235-3249.
[10] Yu XJ,Ruiz-Albert J,Unsworth KE,et al.SpiC is required for secretion of Salmonella Pathogenicity Island 2 type III secretion system proteins[J].Cell Microbiol,2002,4(8):531-540.
[11] 潘欣.巨噬細胞過氧化物酶體與鼠傷寒沙門菌相互作用的初步分析[J].解放軍醫(yī)學雜志,2008,33(4):407-409.
[12] Uchiya K,Barbieri MA,F(xiàn)unato K,et al.A Salmonella virulence protein that inhibits cellular trafficking[J].EMBO J,1999,18(14):3924-3933.
[13] Ramsden AE,Holden DW,Mota LJ.Membrane dynamics and spatial distribution of Salmonella-containing vacuoles[J].Trends Microbiol,2007,15(11):516-524.
[14] Loughran PA,Stolz DB,Vodovotz Y,et al.Monomeric inducible nitric oxide synthase localizes to peroxisomes in hepatocytes[J].Proc Natl Acad Sci USA,2005,102(39):13837-13842.
[15] Pan Xin.Expression profiles of iron metabolism-related genes in macrophages infected by Salmonella typhimurium[J].Med J Chin PLA,2008,33(5):502-505.

