海水及海產品中溶藻弧菌的分離與鑒定
張曉艷,寧喜斌
(上海海洋大學食品學院,上海201306)
溶藻弧菌(Vibrio alginolyticus)是腹瀉病原菌中的一員,為專性嗜鹽性弧菌。與其他致病弧菌一樣,廣泛分布于海洋和江河入海口的水域中,并且數量居海水類弧菌之首[1],過去一直被認為不致病或僅能引起部分創傷性感染而未受到重視,近年研究證實該菌與副溶血弧菌一樣是常見的病原菌[2-5],為海洋環境的主要優勢菌種之一[6]。溶藻弧菌可引起人類食物中毒、中耳炎和敗血癥等[7],夏季是養殖動物感染溶藻弧菌發病的主要季節,容易發生該菌引發的重大流行病,對我國特別是南方地區的海水養殖造成巨大威脅。目前,我國國標中對溶藻弧菌的檢測方法還沒有具體規定,探討海水及海產品中溶藻弧菌的分離鑒定方法,對其進行安全控制及以后建立溶藻弧菌的檢測標準具有十分重要的意義。
1 材料與方法
1.1 材料
1.1.1 菌株溶藻弧菌標準菌株V.a ATCC 17749,購于上海復祥生物公司。
1.1.2 樣品50份海水采集于上海東海近海,40份大黃魚購于上海市水產市場,30份南美白對蝦購于上海市南匯新蘆苑農貿市場,25份貽貝購于浙江嵊泗。
1.1.3 培養基及主要試劑3%NaCl的TCBS瓊脂、3%NaCl三糖鐵瓊脂、無鹽蛋白胨等培養基及鑒定用的生化試劑購于上海市疾病預防控制中心;科瑪嘉弧菌顯色培養基購于上海科瑪嘉微生物技術有限公司;細菌柱式基因組DNA提取試劑盒、PCR反應試劑盒及所用引物等均購于生工生物(上海)有限公司;瓊脂糖購于加拿大Bio Basic INC公司;EB購于上海華舜生物工程有限公司;DNA MakerⅠ購于天根生化科技(北京)有限公司。
1.1.4 主要儀器PCR儀(PTC-200,美國Bio-Rad公司);凝膠成像系統(GelDoc XR,美國Bio-Rad公司)。
1.2 方法
1.2.1 樣品的取樣及處理用無菌海水采樣器于東海近海不同區域采集海水,取水面下30~100 cm深處的海水,每個點取2份,每份500 mL,共50份海水。在上海市水產市場購買新鮮的大黃魚,共40份,將購置的樣品魚用75%乙醇體表消毒后,無菌取其內臟、鰓及魚肉等。上海市南匯新蘆苑農貿市場購買新鮮的南美白對蝦,共30份。20份貽貝購于浙江嵊泗,先用自來水將其外殼上的污泥沖掉,用75%乙醇消毒外殼邊緣,敲開外殼,以無菌操作取出內臟或含內臟的全部貝肉和貝液。將不同的水產品于滅菌的研缽中充分研碎,或用滅菌剪刀充分剪碎,取10 g樣品,放于裝有90 mL的3%NaCl的堿性蛋白胨水中,37℃增菌24 h。
1.2.2 細菌的分離培養增菌后,接種于3%NaCl的TCBS上,37℃培養18~24 h,每平板上挑取1個黃色菌落轉接至科瑪嘉弧菌顯色培養基,37℃培養18~24 h,挑取單個無色菌落經2~3次純化后,轉接于3%NaCl營養瓊脂斜面20~25℃保存。
1.2.3 溶藻弧菌的初篩挑取可疑菌株進行革蘭染色及氧化酶試驗[8],依次將可疑菌株分別接種于3%NaCl三糖鐵瓊脂斜面以及無鹽蛋白胨水和3%、6%、10%鹽蛋白胨水,37℃培養18~24 h。
1.2.4 溶藻弧菌的生化鑒定對于初篩試驗中疑似溶藻弧菌的菌株進一步做生化鑒定,包括蔗糖、乳糖、MR試驗、V-P試驗、賴氨酸、精氨酸、鳥氨酸、明膠、脲酶、阿拉伯糖、D-甘露糖、D-甘露醇、D-纖維二糖及ONPG試驗。試驗方法參照文獻[8],以溶藻弧菌標準菌株ATCC 17749作對照。1.2.5溶藻弧菌的PCR鑒定挑取可疑菌株的單菌落,接種到TSB液體培養基中,37℃搖床培養12~16 h,取3 mL菌液按照柱式基因組DNA提取試劑盒的方法提取DNA,-20℃保存備用。根據文獻[9],HSP60基因序列是鑒定溶藻弧菌的特征基因,在GenBank中存取號為AY332570,PCR可擴增出560 bp的條帶,若能在菌中檢測到此序列,則為溶藻弧菌。
2 結果與分析
2.1 溶藻弧菌的初步分離

圖1 溶藻弧菌在TCBS瓊脂上的菌落形態Fig.1 Colonial morphology of V.a on TCBS agar
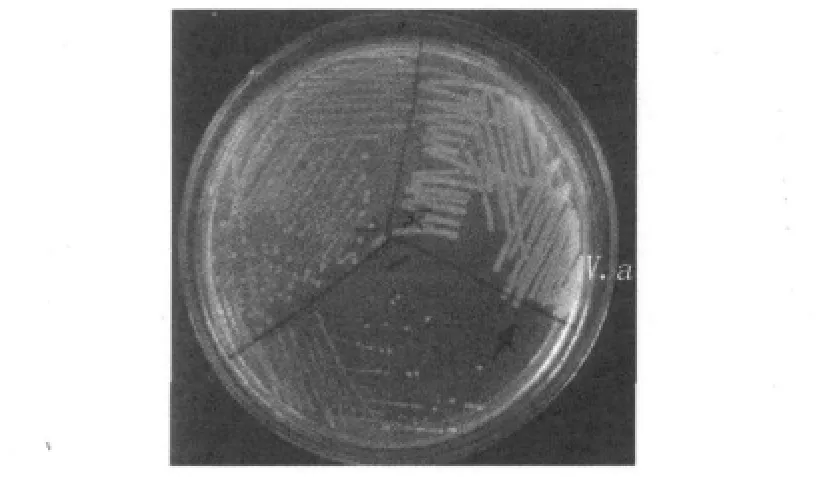
圖2 溶藻弧菌在科瑪嘉弧菌顯色培養基上的菌落形態Fig.2 Colonial morphology of V.a on CHROMager vibrio
樣品選擇性增菌后,在3%NaCl TCBS上的典型菌落為圓形黃色、大而光滑、濕潤、較扁平(圖1);在3%NaCl科瑪嘉上的典型菌落為圓形無色、較小且濕潤(圖2)。其中145份增菌液在TCBS瓊脂上得到黃色單菌落的有52份,從52份TCBS瓊脂上各挑取1個黃色單菌落轉接至科瑪嘉弧菌顯色培養基上,得到無色菌落34份。這34株菌轉接斜面常溫保存1份,作為初步分離的菌株,做進一步的初篩試驗。
2.2 溶藻弧菌的初篩
將在科瑪嘉弧菌顯色培養基上得到的34株可疑菌株進行鏡檢,34株均為革蘭陰性菌,排列不規則,常呈短狀,略顯弧狀。將鏡檢后的34株菌株依次做氧化酶、三糖鐵及嗜鹽性試驗后。溶藻弧菌氧化酶呈陽性;在3%NaCl三糖鐵瓊脂斜面上產酸變黃,底層產酸變黃,不產H2S,不產氣;在無鹽蛋白胨水中不生長,在3%、6%、8%、10%鹽蛋白胨水中生長,其中在3%及6%鹽胨水中生長較明顯。其中34株可疑菌株經過氧化酶試驗、3%NaCl三糖鐵試驗和嗜鹽性試驗后有1株在10%鹽蛋白胨水中不生長,初篩得到33株可疑菌株。
2.3 溶藻弧菌的生化鑒定
對照溶藻弧菌標準菌株的主要特征進行生化試驗鑒定,結果見表1。所有鑒定項目中除MR試驗(+/-為27/6)和精氨酸脫羧酶試驗(-/+為30/3)外,其他生化試驗均與溶藻弧菌標準菌株V.a ATCC17749相符合,所以根據生化鑒定結果來看,初篩得到的33株均疑似為溶藻弧菌。
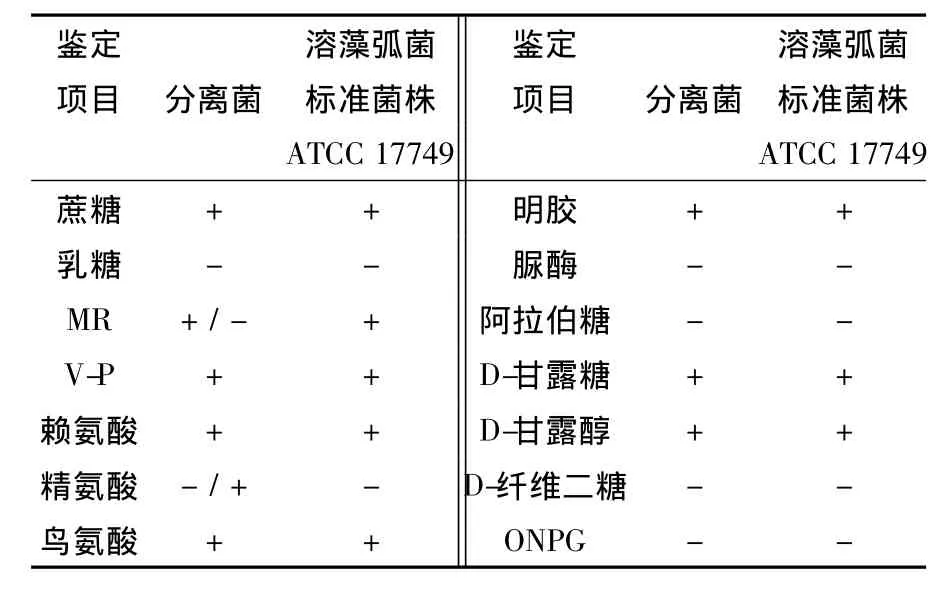
表1 分離菌生化特征及其與標準溶藻弧菌的比較Table 1 Comparison of isolated strains with standard V.a in biochemistry tests
2.4 溶藻弧菌的PCR鑒定
從海水及海產品中分離的33株經過生化方法鑒定后,PCR均擴增出560 bp的溶藻弧菌HSP60基因。部分溶藻弧菌PCR擴增結果見圖3,其中條帶3、4、5、9、10、11比較亮,條帶6、7、8較暗,進而從分子水平驗證了分離得到的33株菌株均為溶藻弧菌。
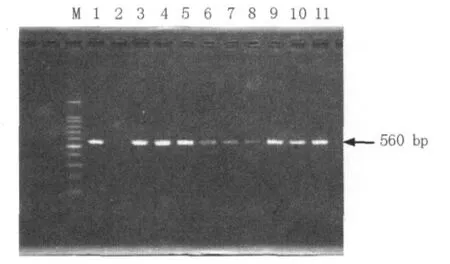
圖3 部分分離的溶藻弧菌PCR擴增電泳圖譜Fig.3 PCR products of part V.a
2.5 溶藻弧菌的分離率
從海水及海產品中分離得到33株溶藻弧菌(表2),其中海水中檢出9株,大黃魚檢出10株,南美白對蝦中檢出9株,貽貝中檢出5株,其中南美白對蝦中檢出率最高,高達30.0%。
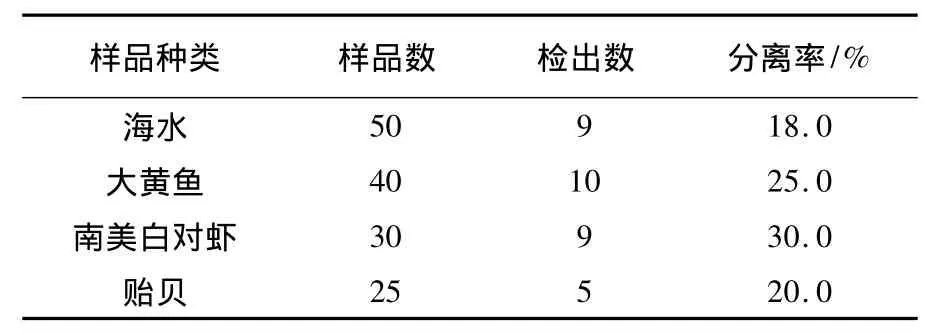
表2 溶藻弧菌的分離率Table 2 The isolating rate of V.a from samples
3 討論
溶藻弧菌選擇性培養基和顯色培養基的選擇:145份樣品增菌后在TCBS瓊脂上分離得到的52份黃色菌株,轉接到科瑪嘉弧菌顯色培養基得到34份無色菌落,經過生理生化及分子水平上鑒定有33株為溶藻弧菌。TCBS雖然是一種選擇性培養基,但是在其長成黃色菌落除了溶藻弧菌,還有霍亂弧菌,而霍亂弧菌在科瑪嘉顯色培養基是土耳其蘭色,溶藻弧菌是無色的。所以在分離溶藻弧菌時選用TCBS選擇培養基的同時,結合科瑪嘉弧菌顯色培養基分離,淘汰初篩階段的其他弧菌,可以較大的提高檢驗的準確性。因此,可以將科瑪嘉弧菌顯色培養基用于分離溶藻弧菌檢驗的國家標準及其他標準中。
溶藻弧菌分離鑒定方法的優化:分離不同樣品中溶藻弧菌時,可將其進行增菌后選用選擇性培養基TCBS進行分離,挑取黃色可疑單菌落接種于科瑪嘉弧菌顯色培養基上,挑取無色單菌落進行生化鑒定,根據溶藻弧菌、副溶血性弧菌及霍亂弧菌間不同的生化特征,可選用V-P、蔗糖、阿拉伯糖、ONPG及嗜鹽性試驗簡化驗證,最后用分子生物學方法進一步鑒定。
海水及水產品中溶藻弧菌帶菌率分析:從50份海水中分離鑒定得到9株溶藻弧菌,檢出率為18.0%。該結果略低于韓善橋等[10]報道的海水中溶藻弧菌的檢出率為25.9%,原因可能與本研究采樣的時間和地點有關,對于海水中溶藻弧菌的攜帶率,應該引起海洋養殖戶和專業技術人員的重視,采取必要的措施來預防溶藻弧菌疾病的爆發和流行。從95份海產品中分離得到24株溶藻弧菌,檢出率為25.2%。其中南美白對蝦的檢出率較高于大黃魚與貽貝,這說明海產品中攜帶溶藻弧菌的幾率比較高,在食用海產品或海產品加工過程中應采取有效的滅菌方法。
近年來我國的食品安全問題愈發突出,而食品安全問題之一便是微生物問題,而作為海水類弧菌數量之首的溶藻弧菌,對我國的海水養殖構成了很大的威脅。因此,溶藻弧菌的分離鑒定顯得愈發重要,其方法的優化對更方便、快速、準確的鑒定溶藻弧菌具有重要的意義。
[1] 封會茹,游京蓉,劉玉堂,等.溶藻弧菌引起暴發型食物中毒的病原學研究[J].中國食品衛生雜志,2003,15(4):331-334.
[2] 潘曉藝,沈錦玉,尹文林,等.水生動物的弧菌病及其致病機理[J].大連水產學院學報,2006,21(3):272-277.
[3] Ripabelli G,Sammarco M L,Grasso G M,et al.Occurrence of Vibrio and other Pathogenic bacteria in Mytilus galloprovincialis(mussels)harvested from Adriatic Sea,Italy[J].International Journal of Food Microbial,1999,49(1-2):43-48.
[4] Lee K K,Liu P C,Chen Y C,et al.The implication of ambient temperature with the outbreak of vibriosis in cultured small abalone Haliotis diversicolor supertexta Lischke[J].Journal of Thermal Biology,2001,26(6):585-587.
[5] 溫崇慶,薛明,何紅,等.兩株對蝦幼體弧菌病病原的分離和鑒定[J].微生物學通報,2008,35(3):346-352.
[6] Thompson F L,Iida T,Swings J.Biodiversity of Vibrios[J].Microbiology and Molecular Biology Reviews,2004,68(3):403-431.
[7] Ardic N,Ozyurt M.Case report:Otitis due to Vibrio alginolyticus[J].Microbiology Bul,2004,38:145-148.
[8] 東秀珠,蔡妙英.常見細菌系統鑒定手冊[M].北京:科學出版社,2001:370-384.
[9] 李寧求,白俊杰,吳淑勤,等.斜帶石斑魚3種致病性弧菌的分子生物學鑒定[J].水產學報,2005,29(3):356-361.
[10] 韓善橋,虞積耀,姜濤,等.海水中致病弧菌分離及抗藥物敏感性分析[J].中國抗生素雜志,2008,33(4):239-241.

