幽門螺桿菌VacA N端片段通過線粒體途徑誘導GES-1細胞凋亡①
楊 卓 張 艷 黎村艷 于 文 曹 斌 余敏君
(南華大學醫學院病原生物學研究所,衡陽421001)
幽門螺桿菌(Helicobacter pylori,H.pylori)是慢性胃炎、消化性潰瘍和胃癌等上消化道疾病的相關病原體,空泡細胞毒素(Vacuolating cytotoxin,VacA)是其主要致病因子之一,因能使多種體外培養的真核細胞形成空泡而得名。VacA是一種AB型毒素,位于N端的A亞單位(p33,1-311氨基酸殘基)是毒素活性亞單位,位于C端的B亞單位(p55,312-821氨基酸殘基)是與宿主細胞結合的部位。Y e等[1]的研究表明,用表達N端478個或更多的氨基酸殘基的重組質粒轉染Hela細胞時VacA出現空泡活性,且VacA引起空泡樣變性的最小片段為422個氨基酸殘基。
為了進一步明確VacA單一毒力決定簇對GES-1細胞凋亡的影響,本研究將課題組先前構建的VacA N端真核表達載體轉入GES-1細胞,觀察其對GES-1細胞凋亡的影響,以了解 H.pylori入侵宿主后對宿主的損傷作用,并為在分子水平上闡明其致病性及其可能的致病機制提供理論和實驗依據。
1 材料與方法
1.1主要材料 E.coli JM109、pDsRed-Monomer-C1及其VacA N端真核表達載體均為本室保存,GES-1胃黏膜上皮細胞系購自中南大學湘雅中心實驗室細胞庫,倒置顯微鏡系日本Nikon公司產品,透射電鏡為日產/H7500型,DNA聚合酶、限制性核酸內切酶、T4連接酶購自Promega公司,質粒轉染試劑脂質體2000購自Invitrogen公司,兔抗 H.pylori多克隆抗體購自Chemicon公司,FITC標記羊抗兔IgG購自碧云天公司,Hoechst 33342、Rho123染料系Sigma公司產品 ,Annexin-V-FITC-PI試劑盒、Caspass-3、Caspase-9 活性檢測試劑盒購自南京凱基生物公司,人細胞色素C ELISA試劑盒購自廣州欣博盛生物公司。
1.2方法
1.2.1重組質粒在GES-1細胞中的表達與鑒定 人胃黏膜上皮細胞(GES-1)培養于10%胎牛血清(FBS)的高糖DMEM培養基,置于37℃、含5%CO2、飽和濕度的溫箱中培養用于實驗。分為空質粒組、重組質粒組,同時設置空白對照。參照LipofectamineTM2000轉染試劑盒說明書以每孔4.0μg質粒和10μl的LipofectamineTM2000轉染每孔細胞。37℃、5%CO2孵箱中孵育5小時后,吸去培養基,換新鮮的含10%FBS的DMEM培養基2 ml,繼續培養,每6小時觀察細胞內紅色熒光,于熒光較多時收集細胞,加入160 μl細胞裂解液4℃放置60分鐘,10 000 r/min 4℃離心5分鐘,收獲細胞裂解上清液經SDS-PAGE后,以兔抗H.pylori多克隆抗體為一抗作Western blot鑒定。
1.2.2VacA空泡活性鑒定
1.2.2.1中性紅攝取實驗 按上述方法轉染細胞后,37℃、5%CO2孵箱中孵育5小時后,吸去培養基,換新鮮的含10%FBS的DMEM培養基1 ml,并加入 100μl 5 mmol/L NH4Cl。分別于轉染后 0、6、12、24小時,棄去培養基,100μl 0.05%中性紅染液染色,100μl 1%乙酸乙醇洗脫液洗脫后離心取上清在96孔板比色,在540 nm波長處測洗脫液吸光度。
1.2.2.2電子顯微鏡下觀察 按上述方法分組并轉染細胞后,37℃、5%CO2孵箱中孵育5小時后,吸去培養基,換新鮮的含10%FBS的DMEM培養基1 ml,并加入5 mmo/L NH4Cl。轉染后24小時,棄去培養基,用2.5%戊二醛固定細胞24小時,按電鏡觀察要求處理細胞,觀察細胞形態。
1.2.3重組質粒高表達對GES-1細胞凋亡的影響
1.2.3.1Hoechst 33342染色方法檢測細胞凋亡 按上述方法分組并接種GES-1細胞數1.0×105于6孔板,設PBS組為陰性對照,轉染細胞24小時后按如下方法操作:細胞培養基中加入Hoechst33342染液,使終濃度為5μg/ml;之后將6孔板放入37℃避光孵育染色10分鐘,熒光顯微鏡下觀察細胞形態變化。
1.2.3.2Annexin V-FITC-PI染色法檢測細胞凋亡按上述方法分組并轉染細胞,同時設置PBS組作為陰性對照,每組設3個復孔。于轉染后24小時收集 GES-1細胞于1.5 ml EP管中,按Annexin V-FITCPI凋亡檢測試劑盒說明書處理細胞,取1×106重懸的細胞,2 000 r/min離心5分鐘,棄上清,加入500μl Binding Buffer懸浮細胞,加入5μl Annexin V-FITC混勻后,加入5μl Propidium Iodide,混勻后室溫避光孵育15分鐘,立即用流式細胞儀檢測。
1.2.4線粒體跨膜勢能的檢測 當細胞呈單層生長鋪滿培養瓶80%左右時按實驗要求轉染細胞,24小時后進行檢測,同時設立PBS陰性對照組及100 μg/L的TNF-α陽性對照組:胰酶消化并收集細胞,加入預冷的PBS漂洗沉淀,加入Rho123染液,使其終濃度為10μg/ml,輕微震蕩使細胞懸浮,37℃避光孵育30分鐘,離心去除上清液,用PBS洗滌沉淀兩次,加入500μl PBS重懸細胞,流式細胞儀檢測細胞平均熒光強度(Mean fluorescence intensity,MFI)。

圖1 Western blot鑒定 VacA蛋白在 GES-1細胞中的表達Fig.1 Western blot analysis of VacA protein from transfected GES-1 cell
1.2.5重組質粒高表達對GES-1細胞活化Caspase-9、Caspase-3的影響 按上述方法分組并轉染細胞,同時設置PBS組作為陰性對照,每組設3個復孔,同時設置0、6、12、24、48五個時相點。離心收集各組經不同時間處理的細胞(約5×105個),用PBS洗滌,加入50μl冰Lysis buffer,冰上裂解 20分鐘,4℃10 000 r/min離心1分鐘,上清轉移至新EP管中置冰上,用BCA試劑盒測蛋白濃度,取含有同等量蛋白的上清,分別加入50μl 2×reaction buffer和5μl caspase substrate,37℃避光反應4小時,酶標儀測波長405 nm處的吸光值,以Lysis buffer和2×reaction buffer作參比,計算與對照組吸光度的比值,確定活化程度。
1.2.6重組質粒高表達對GES-1細胞釋放細胞色素C的影響 按上述方法轉染細胞,分為 GES-1細胞空白對照組、空質粒組、重組質粒組,每組設3個復孔。分別于轉染后6、12、24、48小時時,按照欣博盛公司ELISA試劑盒的說明操作,測定樣本450 nm處OD值,求出Cyt-C的含量(ng/L)。
1.3統計學分析 所有重復實驗數據均以±s表示,用SPSS11.0軟件進行統計分析,各實驗組與對照組比較行單因素方差分析,P<0.05表示差異有顯著性。
2 結果
2.1重組質粒在GES-1細胞中的表達 提取轉染48小時細胞總蛋白進行SDS-PAGE,以兔抗 H.pylori多克隆抗體為一抗,Western blot分析鑒定表達產物免疫反應性,結果發現重組質粒轉染組出現一條免疫反應帶,而空質粒轉染組和 GES-1細胞組未見免疫反應帶(圖1)。
2.2VacA空泡活性鑒定
2.2.1VacA高表達對GES-1細胞攝取中性紅的影響 中性紅攝取實驗顯示,轉染后6小時,重組質粒組的吸光度升高,與對照組相比差異有統計學意義(P<0.05);轉染24小時后,重組質粒組的吸光度達到最高(0.36±0.07);6、12、24小時三個時相點空質粒組的吸光度也有所升高,但與對照組相比,差異均無統計學意義(P>0.05),見圖2。
2.2.2電鏡觀察結果 轉染后24小時,電子顯微鏡觀察重組質粒組可見部分細胞內有大小不等的空泡。大多數發生空泡化的細胞其細胞核無明顯異常改變,空泡多集中于胞漿及線粒體,另有部分空泡化細胞出現細胞質溶解、細胞器破碎、細胞膜破裂等病理改變;同時細胞發生凋亡改變,其表面微絨毛部分脫落、核固縮、碎裂、染色質濃集和邊緣化,呈典型的細胞凋亡特征(圖3)。
2.3 重組質粒高表達對GES-1細胞凋亡的影響
2.3.1Hoechst 33342染色檢測結果 按照前述試驗方法轉染處理細胞24小時后,如圖4A所示可見,陰性對照組胞膜完整,胞質豐富,核形態飽滿,表現為彌散均勻的藍色熒光;空質粒組(B)有極個別細胞呈現凋亡現象:而重組質粒(C)處理組可見核體積縮小,熒光染色增強,染色質呈致密濃染的塊狀或顆粒狀熒光形成。
2.3.2Annexin V-FITC-PI雙染檢測結果 流式細胞儀分析各組凋亡情況(表1,圖5),結果顯示重組質粒組細胞凋亡率較高(43.71%±6.87%),與陰性對照組(17.59%±5.84%)和空質粒組(22.66%±5.61%)相比,差異有統計學意義(P<0.05);空質粒組凋亡率與陰性對照組相比也有輕微升高,但差異無統計學意義(P>0.05);說明重組質粒pDsRed-Monomer-C1/VacA誘導GES-1細胞凋亡增加。
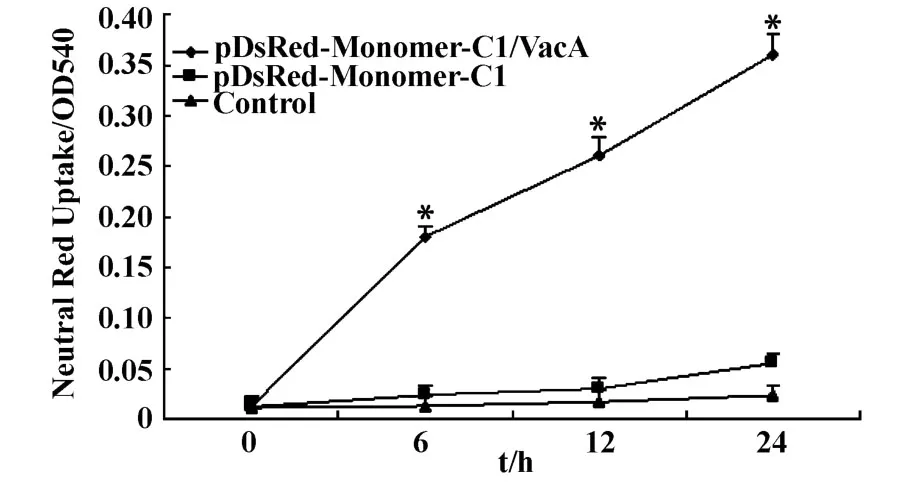
圖2 中性紅攝取實驗Fig.2 Neutral Red Uptake
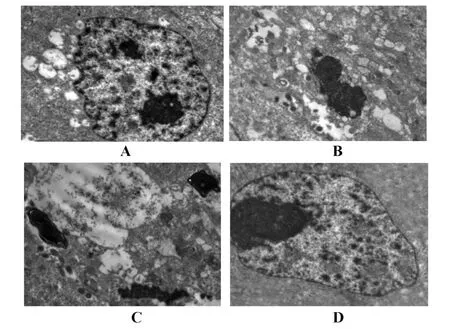
圖3 電子顯微鏡觀察細胞形態(×10 000)Fig.3 Cell morphology observed by electron microscopy(×10 000)
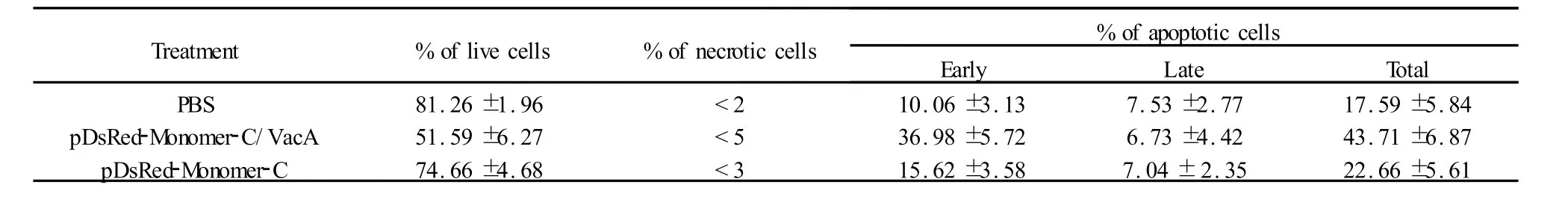
表1 Annexin V-FITC-PI染色法檢測各組細胞的凋亡率Tab.1 Apoptosis rate of the GES-1 cell induced by VacA with Annexin V-FITC-PI staining method

圖4 Hoechst 33342染色觀察細胞凋亡情況(×200)Fig.4 The apoptosis of GES-1 cell line stained by Hoechst 33342(×200)

圖5 Annexin V-FITC-PI染色流式細胞儀檢測 VacA誘導GES-1細胞凋亡Fig.5 Detection of apoptosis of the GES-1 cell induced by VacA with Annexin V-FITC-PI staining method by FCM
2.4重組質粒高表達對GES-1細胞線粒體跨膜勢能的影響 檢測結果發現陽性對照組(TNF-α誘導組)的膜電位勢能最低(156.0±8.7),而重組質粒VacA組(168.0±8.1)略微高于 TNF-α組(P>0.05),低于空質粒組(215.2±9.3)以及 PBS組(224.1±11.6)。重組質粒組與PBS組、空質粒組相比皆具有統計學意義(圖6,P<0.05)。
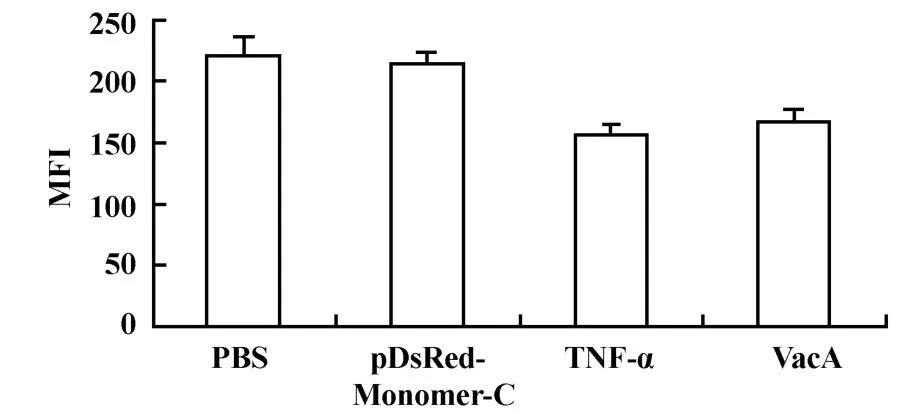
圖6 VacA對 GES-1細胞線粒體跨膜勢能的影響Fig.6 Effect of mitochondrial transmembrane potential induced by VacA
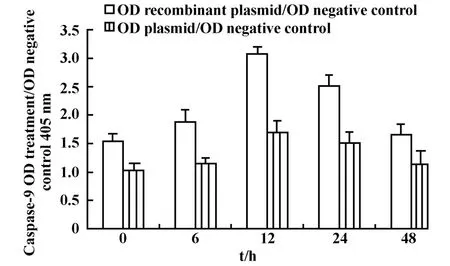
圖7 VacA對 GES-1細胞Caspase-9活化的影響Fig.7 The effect of VacA on the activation of Caspase-9 in GES-1 cells
2.5重組質粒高表達對GES-1細胞Caspase-9、Caspase-3活化程度的影響 檢測結果顯示重組質粒組Caspase-9的活化程度呈一定的時間依賴性,并在處理后12小時的時候達到最高點(3.09±0.09),隨后逐漸降低;而空載體組Caspase-9活化程度并不明顯(圖7,P>0.05);重組質粒組Caspase-3的活化程度亦呈一定的時間依賴性,且在處理后24小時達到最高點(2.86±0.20),空載體組Caspase-3活化程度亦不明顯(圖8,P>0.05)。
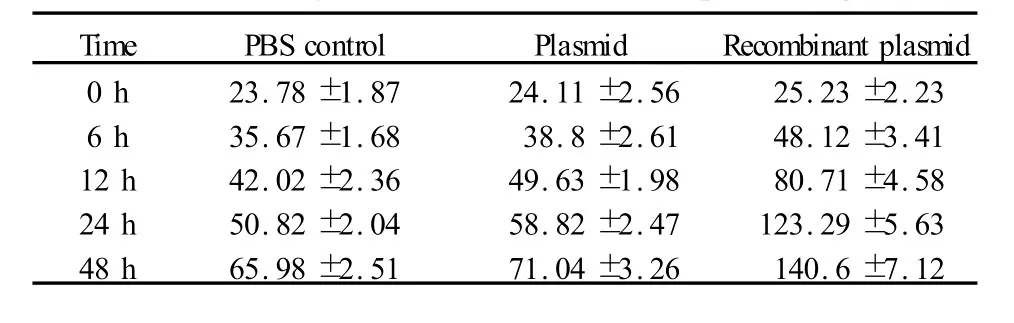
表2 VacA誘導 GES-1細胞釋放Cyt-C(ng/ml)Tab.2 The concentration of Cyt-C released from GES-1 cells induced by VacA at different time points(ng/ml)

圖8 VacA對 GES-1細胞Caspase-3活化的影響Fig.8 The effect of VacA on the activation of Caspase-3 in GES-1 cells

圖9 VacA對 GES-1細胞釋放Cyt-C的影響Fig.9 The effect of V acA on the release of Cyt-C in GES-1 cells Note:*.P<0.05 vs pDsRed-Monomer-C1,PBS control.
2.6重組質粒高表達對GES-1細胞釋放Cyt-C的影響 按照Human Cytochrome-C ELISA測定試劑盒的說明書對各組細胞進行Cyt-C釋放的測定,發現重組質粒組釋放的Cyt-C的濃度呈時間依賴性正相關(表2),即隨著轉染時間的延長,細胞釋放的Cyt-C濃度逐漸增高,同空質粒組及陰性對照組相比均有統計學意義(P<0.05),空質粒組的Cyt-C的釋放也有所升高,但與陰性對照組相比,差異無統計學意義(圖 9,P>0.05)。
3 討論
VacA是 H.pylori的主要毒力因子,諸多報道顯示,VacA蛋白可能與 H.pylori的體內長期定植有關,可以造成胃上皮細胞直接損傷,最終導致消化性潰瘍和腫瘤的發生[2]。研究VacA單一毒力決定簇對靶細胞的作用機制,一種方法是構建VacA原核表達載體,用重組蛋白刺激細胞[3,4];還有一種方法是構建真核表達載體,將其轉入細胞中,研究它對細胞的作用。研究發現,向Hela細胞中單獨加入VacA p33或p55重組蛋白細胞不產生空泡變性,而加入p33或p55重組蛋白混合物后可以產生明顯的空泡活性,證明p55 N端的部分氨基酸殘基是p33功能所必需[5]。
盡管目前研究者已經對VacA蛋白的分子結構、基因信息及其致病性了解較多,但對VacA蛋白的致病機制的研究還不是很清楚。本實驗中,我們將課題組前期構建的VacA N末端真核重組質粒轉染GES-1細胞后,Western blot證實它具有很好的免疫反應性,電鏡下和中性紅攝取實驗均顯示VacA在細胞質內表達后能使 GES-1細胞產生空泡樣變;多數空泡化的細胞其細胞核形態無明顯異常,結構完整,細胞表面還保留微絨毛結構,少數細胞在細胞質內出現多個空泡的同時,細胞核染色質濃縮并發生邊緣化,微絨毛部分脫落,呈特征性凋亡改變。VacA可使多種體外培養的真核細胞系發生空泡樣變,而空泡樣變又是細胞凋亡早期的一項顯著特征,因此我們可以設想通過阻斷空泡樣變來抑制VacA所引起的細胞凋亡[5]。
目前認為細胞凋亡的途徑主要有2條:死亡受體途徑和線粒體途徑。死亡受體途徑是指細胞膜上的死亡受體Fas、TNFR和TRA ILR等,與相應的配體FasL、TNF-α和TRA IL等結合后,并通過一系列半胱天冬氨酸蛋白酶(Caspase)的級聯激活反應誘導凋亡的發生;線粒體途徑則是指細胞在諸如DNA損傷、缺氧或細胞毒性藥物等凋亡刺激信號作用下,使線粒體膜透性增加,線粒體內某些與凋亡相關的物質,如凋亡誘導因子(Apoptosis-inducing factor,AIF)、凋亡蛋白酶激活因子-1(Apoptosis protease activating factor-1,Apaf-1)和Cyt-C等被釋放出來,Apaf-1和Cyt-C能激活Caspase-9,進一步激活細胞凋亡的執行者Caspase-3,產生細胞凋亡效應;而AIF可以以非Caspase依賴性方式介導染色質濃集和DNA片段化,從而促進凋亡。目前認為,這兩條途徑可能均參與了H.pylori所致的胃上皮細胞凋亡[6-8]。線粒體能量代謝障礙會導致膜電位下降,線粒體跨膜電位在維持線粒體膜的完整性和功能方面起著重要作用,線粒體跨膜電位的降低將使細胞不可逆轉的走向凋亡的結局。
Cyt-C的釋放使呼吸鏈中斷和ATP終止,導致細胞凋亡發生;AIF可轉位至細胞核誘導染色體凝聚直至降解,導致細胞凋亡。實驗中我們采用ELISA法定量檢測GES-1細胞胞漿中Cyt-C蛋白濃度的變化,結果證實隨著轉染時間的延長,細胞釋放的Cyt-C濃度逐漸增高,這與Ayala等的研究結果相一致[9]。
在線粒體后凋亡的執行階段,目前最受關注的是Caspase活性的調節,這包括Cyt-C激活Caspase-9,激活后的Caspase-9直接激活Caspase-3,從而實現細胞凋亡。由于Caspase活化而降解作用底物產生的終未效應事件即是引起形態上有著特征改變的細胞凋亡。因此,Caspase有“凋亡步兵”或“凋亡劊子手”之稱。本實驗中,重組質粒組轉染后用分光光度計法檢測Caspase-9、Caspase-3的活化程度,發現前者在較早的時相點(12小時)活化程度到達最高值,后者在下一個時相點(24小時)活化程度隨之到達最高點,與相關文獻中關于線粒體途徑的報道相符合[10]。
自從 H.pylori被分離培養成功以來,其與胃部疾病的關系已引起國內外學者的廣泛關注,就目前研究狀況看,在其致病機制上尚有許多不相一致或者矛盾的結論有待進一步深入探討;不同毒力因子,不同宿主環境以及不同背景的體外培養細胞系均可導致不同甚至相反的結果,因此選用合適的研究模型研究單因素作用顯得尤為重要。本研究證實H.pyloriVacA N端片段可活化Caspase-9和Caspase-3,且可能主要通過線粒體途徑誘導 GES-1細胞凋亡。這也許是 H.pylori誘導胃相關疾病發生的一個重要機制,這為進一步研究 H.pylori在體內的致病機制提供了實驗依據,為研制與 H.pylori相關胃上皮細胞凋亡異常的新藥打下一定基礎。
1 Ye D,Willhite D C,Blanke S R.Identification of the minimal intracellular vacuolating domain of the Helicobacter pylori vacuolating toxin[J].J Biol Chem,1999;274(14):9277-9282.
2 T orresJ,Backert S.Pathogenesis of Helicobacter pylori infection[J].Helicobacter,2008;13(1):13-17.
3 McClain M S,Cover T L.Expression of Helicobacter pylori vacuolating toxin in Escherichia coli[J].Infect Immun,2003;71(4):2266-2271.
4 T orres V J,Ivie S E,McClain M Set al.Functional properties of the p33 and p55 domains of the Helicobacter pylori vacuolating cytotoxin[J].J Biol Chem,2005;280(22):21107-21114.
5 Ivie S E,McClain M S,Algood HMet al.Analysisof a beta-helical region in the p55 domain of Helicobacter pylori vacuolating toxin[J].BMC Microbiol,2010;23(10):60-60.
6 Zhang H,Fang D C,Lan C Het al.Helicobacter pylori infection induces apoptosis in gastric cancer cells through the mitochondrial pathway[J].J Gastroenterol Hepatol,2007;22(7):1051-1056.
7 K imJ M,K imJ S,Lee J Yet al.Dual effects of Helicobacter pylori vacuolating cytotoxin on human eosinophil apoptosis in early and late periods of stimulation[J].Eur J Immunol,2010;40(6):1651-1662.
8 K otlowska-Km′iecA,Bakowska A,Szarszewski Aet al.Helicobacter pylori increases expression of proapoptotic markers Fas and FasL on CD4 lymphocytes in children[J].Acta Biochim Pol,2009;56(3):433-438.
9 Ayala G,T orresL,Espinosa Met al.External membrane vesiclesfrom Helicobacter pylori induce apoptosis in gastric epithelial cells[J].FEMS Microbiol Lett,2006;260(2):178-185.
10 Yamasaki E,Wada A,Kumatori Aet al.Helicobacter pylori vacuolating cytotoxin induces activation of the proapoptotic proteins Bax and Bak,leading to cytochrome c release and cell death,independent of vacuolation[J].J Biol Chem,2006;281(16):11250-11259.