葡聚糖-卵粘蛋白親和超濾載體的制備及應(yīng)用*
李存芝 黃雪松 唐書(shū)澤 李琳 張廣文 胡長(zhǎng)鷹
(1.暨南大學(xué) 食品科學(xué)與工程系,廣東 廣州510632;2.華南理工大學(xué)輕工與食品學(xué)院,廣東廣州510640)
親和-膜過(guò)濾技術(shù)也稱作親和錯(cuò)流過(guò)濾,由Adamsi-Medda等[1]于 1981年提出,它將水溶性或非水溶性高分子親和載體與目標(biāo)蛋白進(jìn)行特異性可逆反應(yīng),然后用膜進(jìn)行錯(cuò)流過(guò)濾,兼具生物親和與膜分離的優(yōu)勢(shì).目前研究非水溶性親和載體的較多,即通過(guò)對(duì)濾膜改性,使其具有親和吸附目標(biāo)物質(zhì)的特性,宜于操作[2-3].水溶性親和載體與目標(biāo)分子在均相中吸附和洗脫,反應(yīng)速度快,達(dá)到平衡時(shí)間短,與非水溶性親和載體比較具有顯著優(yōu)勢(shì).目前相關(guān)的報(bào)道集中在水溶性載體的應(yīng)用[4-8],在載體的制備及機(jī)理上的較少.
文獻(xiàn)[9]中以合成的相對(duì)分子質(zhì)量為10萬(wàn)的聚丙烯酰胺為水溶性載體分離胰蛋白酶.考慮到聚丙烯酰胺的潛在不安全性且卵粘蛋白是胰蛋白酶的抑制劑[10],本研究采用對(duì)人體安全的相對(duì)分子質(zhì)量為200萬(wàn)的水溶性葡聚糖,對(duì)其活化后連接卵粘蛋白為配基,制備卵粘蛋白-葡聚糖親和載體,以卵粘蛋白作為胰蛋白酶的特異抑制劑,分析載體活化過(guò)程的相關(guān)機(jī)理,并將制備的親和超濾載體應(yīng)用于胰蛋白酶的純化.
1 實(shí)驗(yàn)材料與方法
1.1 主要材料和設(shè)備
葡聚糖 T2000(相對(duì)分子質(zhì)量為200萬(wàn)).卵粘蛋白、胰凝乳蛋白酶(結(jié)晶純),均購(gòu)自Sigma公司;胰蛋白酶(1∶250,即每克酶制劑含250個(gè)酶活力單位),購(gòu)自上海伯奧生物科技公司;其它試劑為國(guó)產(chǎn)分析純.
UV-2102 PC型紫外-可見(jiàn)分光光度計(jì),由上海UNICO公司生產(chǎn);傅里葉變換紅外光譜儀Vector33,由德國(guó)Bruker公司生產(chǎn);WZZ-1SS數(shù)字式自動(dòng)糖度旋光儀,由上海物理光學(xué)儀器廠生產(chǎn);攪拌式超濾杯(450mL),由北京中科院膜技術(shù)開(kāi)發(fā)中心生產(chǎn);聚偏氟乙烯(PVDF)超濾膜,截流相對(duì)分子質(zhì)量為10萬(wàn)、14萬(wàn),由中國(guó)科學(xué)院上海原子核研究所生產(chǎn);ALPHA2-4真空冷凍干燥機(jī),由德國(guó)Christ公司生產(chǎn).
1.2 親和載體的制備及定量分析
在配料杯中加入葡聚糖T2000和氫氧化鈉,使葡聚糖含量達(dá)到4%(質(zhì)量分?jǐn)?shù)),氫氧化鈉濃度達(dá)到0.4mol/L,磁力攪拌器攪拌使溶解完全,加入4%(體積分?jǐn)?shù))的環(huán)氧氯丙烷,攪拌分散均勻;將料液置于60℃恒溫?fù)u床中避光反應(yīng)2h;反應(yīng)液用截留相對(duì)分子質(zhì)量為10萬(wàn)的PVDF膜超濾除去溶液中剩余的環(huán)氧氯丙烷、氫氧化鈉小分子,冷凍干燥得活化葡聚糖.膜截留物先用蒸餾水洗至pH=8.0,再用pH=9.5的碳酸鈉-碳酸氫鈉緩沖液清洗,將卵粘蛋白溶解在上述濾膜截留液中,使卵粘蛋白含量為6g/L,在40℃恒溫?fù)u床中避光反應(yīng)24 h;反應(yīng)后的溶液用截留相對(duì)分子質(zhì)量為14萬(wàn)的PVDF膜除去未被偶聯(lián)的卵粘蛋白,真空冷凍干燥,獲得葡聚糖-卵粘蛋白水溶性親和超濾載體.
胰蛋白酶和胰凝乳蛋白酶活力的測(cè)定分別采用以 N-苯甲酰-L-精氨酸乙酯(BAEE)、N-乙酰-L-酪氨酸乙酯ATEE為底物的酶活力測(cè)定法[11].卵粘蛋白配基密度采用考馬斯亮藍(lán)G-250染色紫外吸收法在595nm 處測(cè)定[11].
1.3 載體的光譜分析
1.3.1 紫外-可見(jiàn)光吸收光譜分析
分別配制一定濃度的葡聚糖、活化葡聚糖、葡聚糖-卵粘蛋白親和超濾載體,以蒸餾水為空白,在200~500nm波長(zhǎng)范圍內(nèi)進(jìn)行掃描測(cè)試[12].
1.3.2 紅外光譜分析
分別取約0.2g干燥的樣品(葡聚糖、活化葡聚糖、葡聚糖-卵粘蛋白親和超濾載體)與200 mg KBr粉末混勻,研磨后,抽真空10min,壓片,在波數(shù)4000~500cm-1范圍內(nèi)進(jìn)行測(cè)試.
2 結(jié)果與討論
2.1 葡聚糖載體的活化及分析
葡聚糖載體需要經(jīng)過(guò)活化才能與卵粘蛋白配基進(jìn)行偶聯(lián)形成親和載體.其中卵粘蛋白是胰蛋白酶的特異抑制劑,其特異吸附胰蛋白酶后,再通過(guò)洗脫,可實(shí)現(xiàn)胰蛋白酶的分離純化.
環(huán)氧氯丙烷活化法簡(jiǎn)便易行[13],容易操作,毒性低.含有羥基的載體常采用該方法活化.活化時(shí)葡聚糖分子鏈上產(chǎn)生能與卵粘蛋白結(jié)合的活化基團(tuán),活化過(guò)程中葡聚糖還能產(chǎn)生交聯(lián)反應(yīng),增加了載體的濾膜截留率[6].
本研究采用環(huán)氧氯丙烷活化葡聚糖T2000,結(jié)合紅外光譜(IR)和紫外-可見(jiàn)光譜等分析方法,闡述活化過(guò)程的相關(guān)機(jī)理.
2.1.1 活化載體的紅外光譜
圖1為葡聚糖T2000與活化的葡聚糖T2000的IR譜圖.活化后的葡聚糖在1272 cm-1和870 cm-1處的吸收峰明顯增強(qiáng),這2處為環(huán)氧基的特征吸收峰,說(shuō)明活化葡聚糖中存在環(huán)氧基;此外,在1649cm-1處出現(xiàn)羧酸離子的特征吸收峰.因此活化后的葡聚糖T2000上不僅含有環(huán)氧基,還含有羧基.
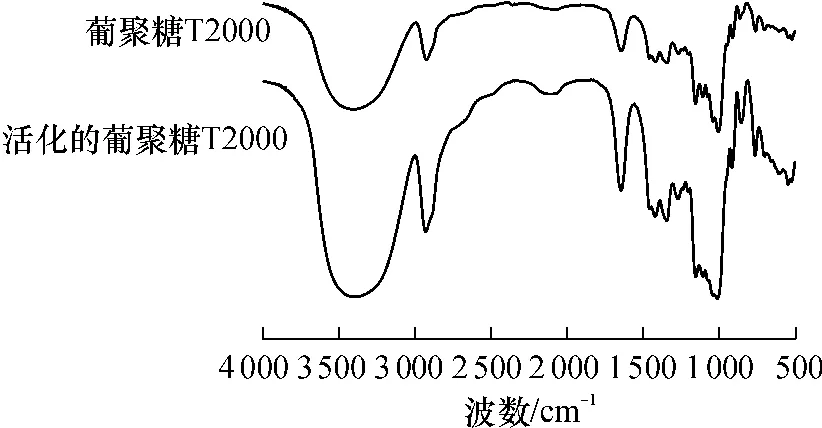
圖1 葡聚糖T2000與活化的葡聚糖T2000的IR譜圖Fig.1 IR spectra of dextran T2000 and activated dextran T2000
2.1.2 活化載體的紫外-可見(jiàn)吸收光譜
圖2是葡聚糖 T2000和活化后葡聚糖T2000的紫外-可見(jiàn)(UV-Vis)吸收光譜.從圖2可以看出,葡聚糖的紫外吸收在224nm,其最大吸光值僅為0.16.經(jīng)活化后的葡聚糖的紫外最大吸收變?yōu)?05nm左右的強(qiáng)吸收,最大吸光值達(dá)1.71,這是由于活化的葡聚糖上產(chǎn)生的羧基發(fā)生π→π*躍遷從而表現(xiàn)出的紫外強(qiáng)吸收[12].環(huán)氧基團(tuán)屬π→σ*躍遷,其吸收波長(zhǎng)小于190 nm,超出紫外檢測(cè)波長(zhǎng)范圍,因此在圖2(b)的活化葡聚糖紫外光譜圖上看不到環(huán)氧基團(tuán)的明顯吸收峰.
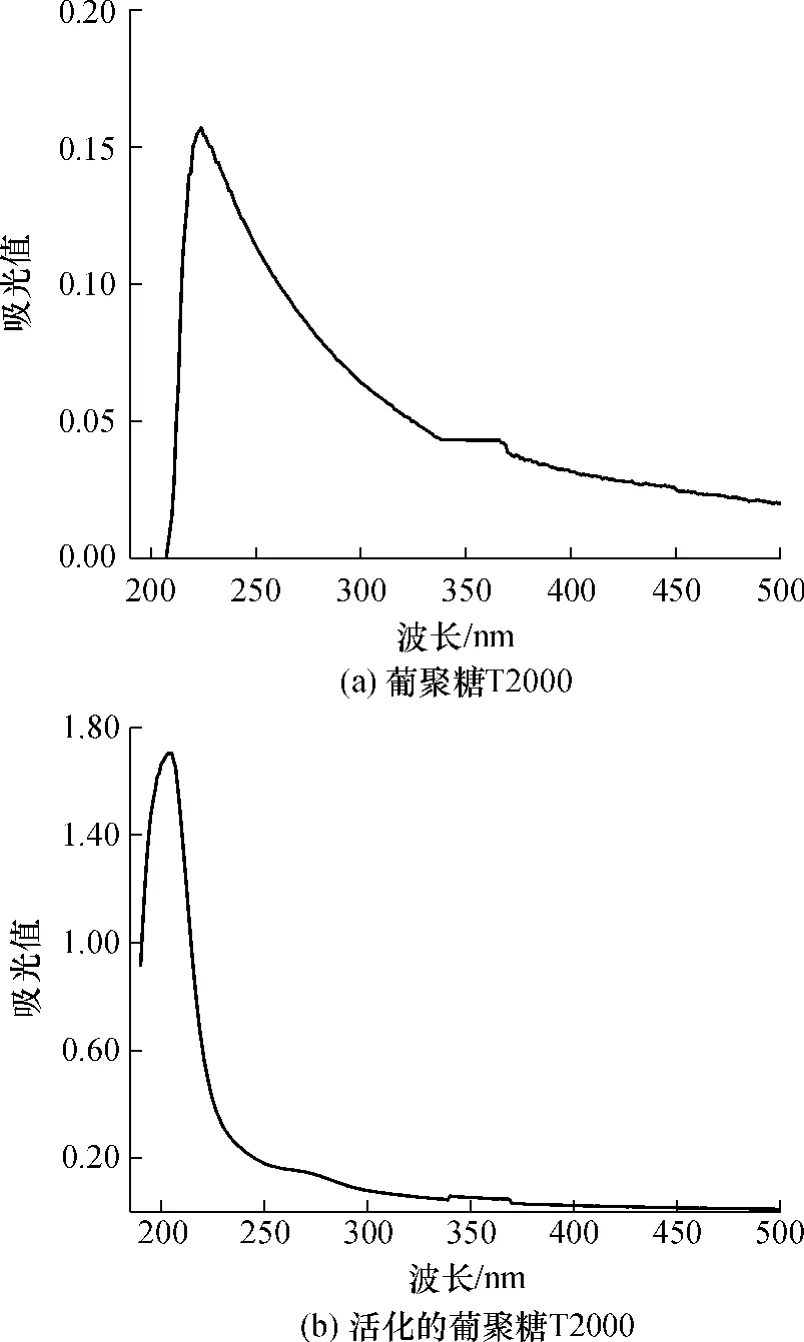
圖2 葡聚糖T2000與活化的葡聚糖T2000的UV-Vis光譜Fig.2 UV-Vis spectra of dextran T2000 and activated dextran T2000
2.1.3 葡聚糖載體環(huán)氧活化反應(yīng)機(jī)理分析
環(huán)氧氯丙烷具有三元環(huán)結(jié)構(gòu),以彎曲鍵相互連接,分子中存在一種張力環(huán),極易與多種試劑反應(yīng),被用在有機(jī)合成中合成多種化合物;環(huán)氧氯丙烷中氯原子的電負(fù)性很強(qiáng),誘導(dǎo)效應(yīng)使C—Cl的電子偏向鹵原子,碳上帶有部分正電荷,容易受到帶負(fù)電荷的親和試劑進(jìn)攻;在堿性的條件下,葡聚糖的羥基呈弱酸性,形成負(fù)離子游離基[13].本研究認(rèn)為負(fù)離子游離基作為親核試劑進(jìn)攻環(huán)氧氯丙烷,由于環(huán)氧氯丙烷中處于三元環(huán)的兩個(gè)碳原子所取的空間結(jié)構(gòu)不同,負(fù)離子親核試劑選擇進(jìn)攻取代基較少的環(huán)碳原子,以減少空間位阻效應(yīng);當(dāng)葡聚糖負(fù)離子游離基進(jìn)攻環(huán)氧氯丙烷時(shí),環(huán)氧氯丙烷環(huán)上的C—O斷裂,同時(shí)葡聚糖負(fù)離子游離基上的O與環(huán)氧氯丙烷上的C形成C—O,進(jìn)行雙分子親核取代反應(yīng)(SN2),其反應(yīng)歷程如下:

圖3為SN2反應(yīng)中的勢(shì)能變化示意圖,當(dāng)反應(yīng)物形成過(guò)渡態(tài)時(shí),需要吸收活化能ΔEa=Ea1-Ea2,其中Ea1為過(guò)渡態(tài)勢(shì)能最高點(diǎn),Ea2為反應(yīng)物勢(shì)能.過(guò)渡態(tài)為勢(shì)能最高點(diǎn),即最難達(dá)到的最高能量狀態(tài),一旦形成過(guò)渡態(tài),即釋放能量,形成產(chǎn)物,反應(yīng)物與產(chǎn)物之間的能量差為ΔH=H1-H2.過(guò)渡態(tài)時(shí)親和試劑與環(huán)氧氯丙烷上碳原子的鍵尚未完全形成,但親和試劑上的一對(duì)電子已與碳原子共享,離去基團(tuán)與碳原子之間的鍵尚未完全斷裂,碳原子上的部分負(fù)電荷已轉(zhuǎn)移給離去基團(tuán)[13].

圖3 Sn2反應(yīng)中的勢(shì)能變化Fig.3 Variation of potential energy in Sn2 reaction
連接有環(huán)氧基團(tuán)的葡聚糖Ⅰ可以與堿性條件下形成的葡聚糖負(fù)離子繼續(xù)反應(yīng)[13],形成交聯(lián)結(jié)構(gòu),如反應(yīng)式(3)所示.交聯(lián)分子還可以進(jìn)一步被環(huán)氧氯丙烷活化,形成更大分子的葡聚糖交聯(lián)分子,其反應(yīng)歷程同樣是是雙分子親核取代歷程(SN2).
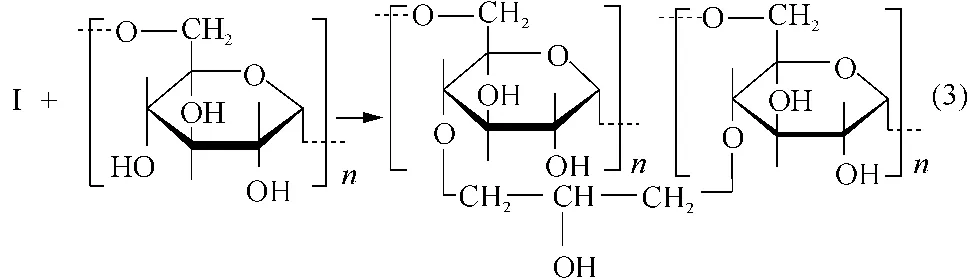
在活化和交聯(lián)過(guò)程中,葡聚糖分子也可被氧化形成羧基,其可能的反應(yīng)為
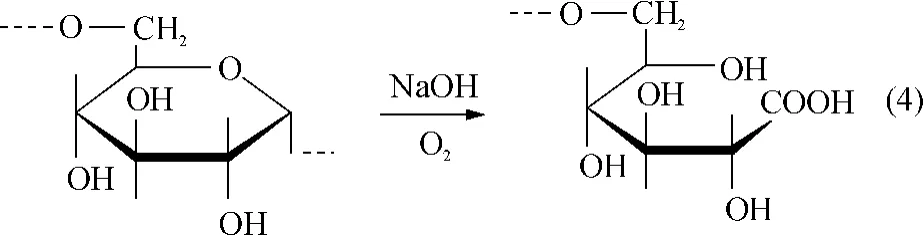
經(jīng)環(huán)氧氯丙烷活化后的交聯(lián)葡聚糖載體分子上既存在羧基,還存在未發(fā)生交聯(lián)及水解反應(yīng)的環(huán)氧基.環(huán)氧基活潑,不穩(wěn)定,極易化學(xué)分解.為了在偶聯(lián)配基過(guò)程中很好地利用環(huán)氧基活性基團(tuán),活化后的葡聚糖T2000活化載體應(yīng)盡快進(jìn)行親和配基的偶聯(lián)反應(yīng).配基卵粘蛋白含有—NH2,可以與環(huán)氧基和羧基發(fā)生偶聯(lián)反應(yīng),形成水溶性親和載體.
2.2 活化載體偶聯(lián)配基形成的卵粘蛋白親和載體
2.2.1 親和載體的紫外-可見(jiàn)吸收光譜

圖4 親和載體的UV-Vis光譜Fig.4 UV-Vis spectra of affinity escort
圖4是以卵粘蛋白為配基的親和-超濾載體的紫外-可見(jiàn)吸收光譜.在280nm出現(xiàn)明顯的蛋白吸收峰,說(shuō)明親和載體中含有卵粘蛋白親和配基.
2.2.2 親和載體的紅外光譜
圖5示出了葡聚糖-卵粘蛋白親和載體與葡聚糖的紅外光譜.一個(gè)明顯的特征是葡聚糖-卵粘蛋白親和載體在1514cm-1處出現(xiàn)一個(gè)新峰,為明顯的氨基酸特征吸收,證明親和載體中含有卵粘蛋白,1635cm-1和1514cm-1之間吸收峰明顯增加.在765 ~525 cm-1、2340 cm-1處吸收明顯弱化,甚至消失.這些說(shuō)明卵粘蛋白在葡聚糖上取代的位置不同,造成有的特征峰消失,有的特征峰加強(qiáng)或新的特征峰出現(xiàn).
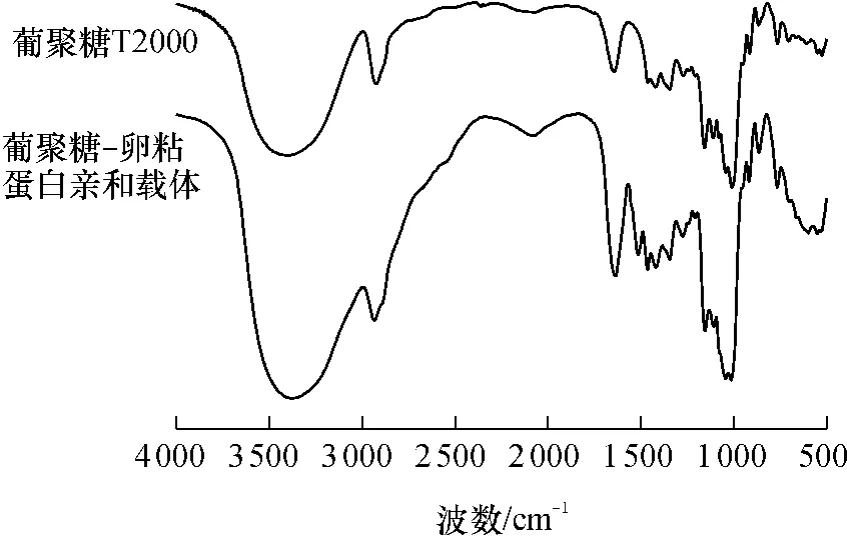
圖5 親和載體與葡聚糖T2000的IR譜圖Fig.5 IR spectra of dextran T2000 and affinity escort
2.3 葡聚糖-卵粘蛋白親和載體在胰蛋白酶純化中的應(yīng)用
以胰蛋白酶和胰凝乳蛋白酶的混合物系為研究對(duì)象,胰蛋白酶的相對(duì)分子質(zhì)量為23400,而胰凝乳蛋白酶的相對(duì)分子質(zhì)量為22500,由于二者的理化性質(zhì)相似,相對(duì)分子質(zhì)量相近,常規(guī)超濾分離很難將二者彼此分離開(kāi).本研究利用卵粘蛋白親和超濾載體選擇性地吸附胰蛋白酶,在親和超濾過(guò)程中實(shí)現(xiàn)胰蛋白酶的分離純化.
圖6示出了4℃時(shí)卵粘蛋白親和載體親和吸附胰蛋白酶的吸附等溫線,擬合所得Qm為27.80mg/g(即每克親和載體最大吸附胰蛋白酶量為27.80mg),解吸平衡常數(shù)Kd為15.10 μg/mL.卵粘蛋白親和載體親和吸附胰蛋白酶的Langmuir吸附等溫方程為
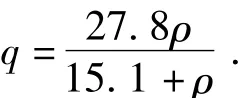
式中:q為胰蛋白酶在親和載體上的吸附量,mg/g;ρ為溶液中胰蛋白酶的濃度,μg/mL.

圖6 親和載體對(duì)胰蛋白酶的吸附等溫線Fig.6 Adsorption isotherm of affinity escort on trypsin
實(shí)驗(yàn)中通過(guò)對(duì)胰蛋白酶的特異吸附及適宜的吸附洗脫條件的選擇,實(shí)現(xiàn)胰蛋白酶的分離純化.經(jīng)親和純化后,胰蛋白酶純化倍數(shù)為45,回收率達(dá)80%.
胰蛋白酶與載體上親和配基的作用是一種復(fù)雜的生物現(xiàn)象,除具備“鎖鑰”關(guān)系外,還需存在特殊的相互作用力,如氫鍵、靜電、疏水等相互作用[14].此外,當(dāng)?shù)鞍踪|(zhì)分子發(fā)生親和結(jié)合時(shí),蛋白質(zhì)的分子形態(tài)往往發(fā)生變化,這些因素導(dǎo)致親和作用具有高度的特異性[14].本實(shí)驗(yàn)利用這種特異性通過(guò)親和與超濾的結(jié)合將相對(duì)分子質(zhì)量相近的胰蛋白酶與胰凝乳蛋白酶分離開(kāi)來(lái).
3 結(jié)語(yǔ)
本研究以胰蛋白酶的特異抑制劑卵粘蛋白為配基,合成了卵粘蛋白-葡聚糖親和超濾載體,分析認(rèn)為,載體環(huán)氧氯丙烷活化反應(yīng)機(jī)理為雙分子的親核反應(yīng)歷程(SN2).以胰蛋白酶和胰凝乳蛋白酶的混合物系為對(duì)象,以胰蛋白酶的純化為目標(biāo),利用合成的親和載體對(duì)胰蛋白酶進(jìn)行純化,結(jié)果表明,親和載體對(duì)胰蛋白酶的吸附符合Langmuir吸附等溫線方程,純化倍數(shù)為45,活性回收率為80%.對(duì)親和吸附的機(jī)理分析認(rèn)為,由于親和分子對(duì)的鎖鑰關(guān)系及特殊的相互作用力如靜電引力等因素共同作用導(dǎo)致親和作用具用高度的特異性.
[1] Adamsi-Medda D,Nguyen Q T,Dellacherie E.Biospecific ultrafiltration:a promising purification technique for proteins[J].Journal of Membrane Science,1981,9(3):337-342.
[2] Suma Rao,Andrew L Zydney.High resolution protein separations using affinity ultrafiltration with small charged li-gands[J].Journal of Membrane Science,2006,280(9):781-789.
[3] Sumana Mukherjee,Debashis Roy,Pinaki Bhattacharya.Comparative performance study of polyethersulfone and polysulfone membranes for trypsin isolation from goat pancreas using affinity ultrafiltration[J].Separation and Purification Technology,2008,60(3):345-351.
[4] Kenzo Kanemaru,Tatsuya Oshima,Yoshinari Baba.Selective recovery of histidine-containing dipeptides based on metal affinity interactions using chemically modified dextran in combination with ultrafiltration [J].Reactive and Functional Polymers,2010,70(2):103-109.
[5] Edwie F,Li Yi,Chung T S.Exploration of regeneration and reusability of human serum albumin as a stereoselective ligand for chiral separation in affinity ultrafiltration[J].Journal of Membrane Science,2010,362(10):501-508.
[6] 朱家文,曹學(xué)君,武斌,等.水溶性親和超濾載體的制備和應(yīng)用[J].華東理工大學(xué)學(xué)報(bào),1999,25(6):563-566.Zhu Jia-wen,Cao Xue-jun,Wu Bin,et al.Preparation of dextran-based water soluble macroligand and its application[J].Journal of East China University of Science and Technology,1999,25(6):563-566.
[7] Mustafa Teke,Azmi Telefoncu.Purification of bovine pancreatic phospholipase A2 by an affinity ultrafiltration technique[J].Separation and Purification Technology,2008,63(11):716-720.
[8] Jonathan Romero,Andrew L Zydney.pH and salt effects on chiral separations using affinity ultrafiltration[J].Desalination,2002,148(9):159-164.
[9] Luong J H T,Male K B,Nguyen A L.Synthesis and characterization of a water-soluble affinity polymer for trypsin purification[J].Biotechnology and Bioengineering,1988,31(5):439-446.
[10] 方林求,褚楠,薛靜.雞卵清蛋白對(duì)蛋白酶抑制作用的研究[J].中國(guó)生化藥物雜志,1995,16(6):261-265.Fang Lin-qiu,Chu Nan,Xue Jing.Study on inhibition of proteinase activity by chicken ovalbumin[J].Chinese Journal of Biochemical Pharmaceutics,1995,16(6):261-265.
[11] 張龍翔.生化實(shí)驗(yàn)方法和技術(shù)[M].北京:高等教育出版社,1997:170-186.
[12] 彭師奇.藥物的波譜解析[M].北京:北京醫(yī)科大學(xué)出版社,2002:55-78.
[13] 岳保珍,李潤(rùn)濤.有機(jī)合成基礎(chǔ)[M].北京:北京醫(yī)科大學(xué)出版社,2000:15-20.
[14] 孫彥.生物分離工程[M].北京:化學(xué)工業(yè)出版社,1998:193.

