青年腦梗死患者血清尿素氮和短期預后關系
張 斌 高 聰
廣州醫學院第二附屬醫院神經內科,廣東廣州 510260
青年腦梗死是重要的致殘原因之一,因此研究青年腦梗死的發病機制以及預后是非常重要的。傳統的動脈硬化的危險因素并不能夠完全解釋青年腦梗死患者發病機制,例如性別、吸煙、糖尿病、肥胖和高膽固醇血癥。因此,其他危險因素將可能導致青年腦梗死的發病[1]。對比研究發現對于心衰的患者,血尿素氮可能是一個強大的心血管預后以及死亡的重要預測指標[2-3]。本研究探討入院時血尿素氮的水平和青年腦梗死患者短期預后之間的關系,報道如下。
1 資料與方法
1.1 一般資料
所有患者都是18~45歲的第一次腦梗死患者,于2001~2010年入住筆者所在醫院,均不存在影響血尿素氮的疾病和從未服用影響血尿素氮的藥物,并排除顱內相關疾病。腦梗死患者根據TOAST系統進行區分。出院時mRS評分被區分為兩個級別:獨立(0~2分)或者依賴/死亡(3~6分)。同時,收集所有患者的基本人口數據(性別和年齡)以及傳統血管病危險因素,并進行常規的血生化等檢查。所有患者都同意參與本研究,并且該項研究得到了醫院倫理委員會的認可。
1.2 統計學處理
統計分析應用SPSS 11.1軟件進行。x2檢驗用于分類變量資料統計,Mann–WhitneyU檢驗用于連續變量資料檢驗。所有統計結果均用()來表示。腦梗死預后和血尿素氮以及其他臨床指標之間的關系首先采用單因素回歸分析,接著通過二元logistic回歸進行分析對混雜因素進行校正,在進行二元回歸分析時,所有變量入選標準是P<0.01,說明這些變量和卒中的嚴重程度有微弱的相關性。
2 結果
2.1 臨床特征
總共439例青年腦梗死患者出院時有著比較好的預后(mRS=0~2分),另外174名有著比較差的預后(mRS=3~6分)。表1顯示,那些預后較差的患者有更大的糖尿病,房顫,代謝綜合征的風險,入院時間更長,而且他們很少有卒中或者TIA的風險。血清檢測發現預后較差的患者,血糖含量,血膽固醇水平,血纖維蛋白原,膽紅素,血清尿素氮,白細胞明顯升高。相對應的,預后較好的腦梗死患者血清前白蛋白和尿酸含量明顯降低。
2.2 不同卒中類型之間的尿素氮含量對比
血清尿素氮在不同卒中組別之間明顯不同(P<0.05),心源性腦梗死患者血清尿素氮含量最高為(5.74±2.91) mmol/L,預后最差。小血管閉塞引起腦梗死的患者有著最低的血清尿素氮的濃度為(4.82±1.67)mmol/L。盡管大血管閉塞和小血管閉塞引起腦梗死的患者血清尿素氮含量沒有明顯區別,但是,大血管閉塞引起腦梗死患者的血清尿素氮和出院時mRS評分仍然較高。見表2。
2.3 血清尿素氮和卒中嚴重程度的關系
相對于預后較好的患者,預后較差的患者血清尿素氮含量在較高的四分位數區域(P<0.01)。見表3。
2.4 血清尿素氮與臨床預后的關系
多元logistic回歸分析證明較高的入院血清尿素氮水平與出院時較差的預后有明顯的相關性。而且,較高的纖維蛋白原和間接膽紅素與較好的臨床預后有關,同時筆者發現,較高的血清尿素氮和前白蛋白也預示著較好臨床預后。見表4。
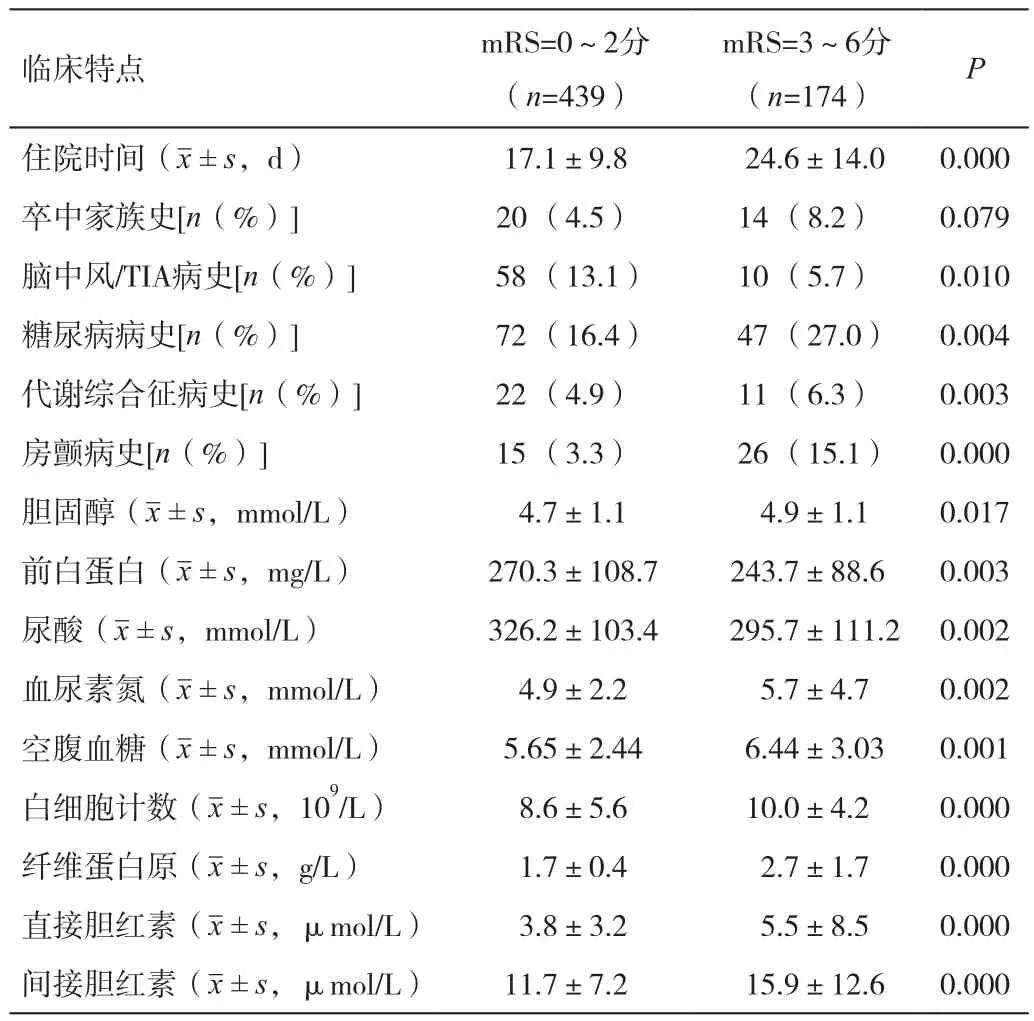
表1 根據mRS 評分研究人群基本臨床特點
表2 不同卒中類型之間血清尿素氮水平對比(±s)

表2 不同卒中類型之間血清尿素氮水平對比(±s)
組別 大動脈 小動脈 心源性 P血尿素氮 (mmol/L) 5.04±2.41 4.82±1.67 5.74±2.91 0.017 mRS (分) 2.2±1.5 0.9±1.0 2.7±1.8 0.000

表3 根據出院時mRS評分比較血清尿素氮與卒中嚴重程度關系[n(%)]

表4 青年腦梗死患者臨床短期預后的預測因素
3 討論
筆者研究發現,入院時患者血清尿素氮含量是一個強有力的獨立的較差臨床預后的預測因子。筆者的研究與先前的研究相一致,首先,動物試驗已經證明升高的尿素氮濃度與降低的腦血流有關[4],因此,青年腦梗死患者升高的血清尿素氮可能導致腦梗死區域內的腦灌注降低,缺血半暗帶擴大,不利于缺血損傷的神經元功能恢復。其次,筆者的研究顯示青年腦梗死患者主動脈和小動脈硬化是腦梗死的主要原因。眾所周知,頸動脈內膜厚度與動脈硬化性疾病密切相關,包括腦血管和心血管疾病[5]。因此,明顯升高的血尿素氮顯示增高的頸動脈內膜厚度和動脈硬化程度,因此可以解釋血清尿素氮水平與腦血管疾病之間的關系。最后,血清尿素氮水平能夠反應完整的蛋白質代謝過程。血尿素氮升高說明增強的蛋白質代謝和尿素含量升高。因此,血尿素氮是一個重要的營養不良指標。更重要的是,研究證明,對于青年腦梗死患者,營養不良是較差臨床預后的獨立的預測指標[6-7]。因此,筆者推測入院血尿素氮水平越高,營養狀態越差,出院時短期預后越差。
[1] True AL, Olive M, Boehm M, et al. Heme oxygenase-1 deficiency accelerates formation of arterial thrombosis through oxidative damage to the endothelium, which is rescued by inhaled carbon monoxide[J]. Circ Res, 2007, 101(9):893-901.
[2] Kirtane AJ, Leder DM, Waikar SS, et al. Serum blood urea nitrogen as an independent marker of subsequent mortality among patients with acute coronary syndromes and normal to mildly reduced glomerular filtration rates[J]. J Am Coll Cardiol, 2005, 45(11): 1781-1786.
[3] Smith GL, Shlipak MG, Havranek EP, et al. Serum urea nitrogen, creatinine,and estimators of renal function: mortality in older patients with cardiovascular disease[J]. Arch Intern Med, 2006, 166(10):1134-1142.
[4] Yuen N, Anderson SE, Glaser N, et al. Cerebral Blood Flow and Cerebral Edema in Rats With Diabetic Ketoacidosis[J]. Diabetes, 2008,57(10):2588-2594.
[5] Mizutani A, Okajima K, Murakami K, et al. Activation of sensory neurons reduces is chemia/reperfusion-induced acute renal injury in rats[J].Anesthesiology, 2009,110(2):361-369.
[6] Takahashi H, Kato A, Onodera K, et al. Fasting plasma ghrelin levels reflect malnutrition state in patients with liver cirrhosis[J]. Hepatol Res, 2006, 34(2):117-123.
[7] Sung HY, Jong SK, Sun UK, et al. Undernutrition as a Predictor of Poor Clinical Outcomes in Acute Ischemic Stroke Patients[J]. Arch Neurol, 2008, 65(1) : 39-43.

