黑皮素-1受體在瘢痕疙瘩中的表達及基因沉默黑皮素-1受體對成纖維細胞增殖的影響
呂川 戴海英 張敬德 王曉蕓
黑皮素-1受體在瘢痕疙瘩中的表達及基因沉默黑皮素-1受體對成纖維細胞增殖的影響
呂川 戴海英 張敬德 王曉蕓
目的檢測黑皮素-1受體(MC-1R)在瘢痕疙瘩中的表達,同時研究基因沉默黑皮素-1受體對成纖維細胞增殖的影響。方法用MTT法比較α-MSH對正常皮膚成纖維細胞(hDF)和瘢痕疙瘩成纖維細胞(hKF)增殖能力的影響;用qPCR法檢測正常皮膚及瘢痕疙瘩組織中MC-1R的表達水平;用MTT法檢測RNA干擾MC-1R基因后對α-MSH抑制hDF增殖能力的影響。結果α-MSH可抑制hDF的增殖,而未對hKF的增殖產生明顯影響;與正常皮膚組織相比,瘢痕疙瘩組織中MC-1R的mRNA表達水平明顯下降,而α-MSH的表達增加;最后,將hDF轉染MC-1R siRNA后,α-MSH對其增殖能力的抑制程度顯著降低。結論瘢痕疙瘩中MC-1R表達降低,導致α-MSH抑制hKF增殖的功能無法實現,促進了瘢痕疙瘩的形成。
瘢痕疙瘩黑皮素-1受體促黑素細胞激素成纖維細胞增殖
瘢痕疙瘩多發生于選擇性手術或創傷術后,組織學上以成纖維細胞的過度增殖和膠原過度合成為特征,但目前對其復雜的機制了解甚少,尚無有效治療方法[1]。促黑素細胞激素(Melanocyte-stimul-ating hormone,MSH)是一種內源性神經免疫調節肽,可分為α-MSH、β-MSH、γ-MSH等3種。近年來,越來越多的研究表明,α-MSH通過作用于其受體黑皮素-1受體(MC-1R)參與調節瘢痕的形成過程。本實驗通過對比瘢痕疙瘩成纖維細胞和正常皮膚成纖維細胞中MC-1R的表達,以及基因沉默正常成纖維細胞中的MC-1R,研究α-MSH及其受體在瘢痕疙瘩形成中的作用。
1 材料與方法
1.1 材料與試劑
siRNA由上海吉瑪生物制藥公司合成,序列為5'-CGUGAUCACCUGCAGCUCCUU-3',5'-AAGGAGCTGCAGGTGATCACG-3'。siRNA脂質體轉染試劑(Interferin)購自法國Polyplus公司,四甲基偶氮唑藍(MTT)購自美國Sigma公司,Trizol試劑和RT-PCR試劑盒購自美國Invitrogen公司,α-MSH為德國Biosciences公司產品。
1.2 實驗對象
正常皮膚和瘢痕疙瘩組織各8例,供者均系本科患者,并征得患者知情同意。患者年齡16~48歲,男7例,女9例。標本切取后一部分應用組織塊法進行成纖維細胞原代培養;其余部分在30 min內放入液氮中,置入-80℃冰箱中保存,待提取細胞總RNA。
1.3 實驗方法
1.3.1 組織塊培養法
無菌切取正常皮膚標本、瘢痕疙瘩標本,75%乙醇浸泡2 min,PBS沖洗2次后,剪成約1 mm3碎塊,置于25 cm2的培養瓶,加入含10%胎牛血清的DMEM培養基,倒置放入孵箱,7 h左右輕輕翻正,在37℃、5%CO2和95%濕度條件下培養。以后每3天換液1次。待成纖維細胞從組織塊邊緣長出,達80%亞匯合狀態時,按1∶3傳代培養。第4~7代的細胞用于實驗。
1.3.2realtime RT-PCR檢測
使用Trizol(購自Invitrogen公司)試劑提取細胞總RNA,使用反轉錄試劑盒(購自Toyobo公司)反轉錄為cDNA。定量PCR引物序列為,MC-1R:5'-CCTGCTGGTGAGCGGGA-3'(上游),5'-ACGGCCATGAGCACCAG-3'(下游);α-MSH:5'-TAAGGACAGAGGAGCGCGGGA-3'(上游),5'-TCTCCTGGTGGAACAGCCACTG-3'(下游);β-actin:5'-GGCGGCACCACCATGTACCCT-3'(上游),5'-AGGGGCCGGACTCGTCATACT-3'(下游)。反應條件為94℃預變性1 min,94℃變性30 sec,55℃退火30 sec,72℃延伸30 sec,共循環40次,由羅式Lightcycler 1.5定量PCR儀檢測并計算分析Ct值,相對定量采用2-ΔΔCt法計算。
1.3.3MTT法檢測
取對數生長期的成纖維細胞,以每孔2×103個細胞接種于96孔培養板,每組設6個重復孔。培養液中加入MTT,放入培養箱繼續培養4 h后,每孔加入DMSO 150 μL,振蕩10 min溶解。波長570 nm下,用酶聯免疫檢測儀測定各孔光吸收值,檢測成纖維細胞的增殖情況。
1.3.4RNA干擾
1×104個細胞鋪入96孔板中并培養過夜,次日使用脂質體轉染試劑Interferin轉染siRNA,按說明書標準操作,轉染終濃度為40 nM。
1.3.5Western blot檢測
蛋白濃度檢測使用BCA蛋白定量試劑盒(購自Pierce公司)。Western blot按標準操作步驟進行,MC-1R、β-actin及相應HRP酶標二抗均購自Santa Cruz公司。
1.4 統計學處理
組間差異采用Student’s t檢驗計算,P<0.05認為有統計學意義。
2 結果
2.1 α-MSH對正常皮膚和瘢痕疙瘩兩種來源成纖維細胞的作用
將正常皮膚成纖維細胞(hDF)和瘢痕疙瘩成纖維細胞(hKF)分別分為2組,一組為對照組,用正常培養基培養,另一組為α-MSH處理組,在培養基中加入終濃度為10-6mmol/L的α-MSH處理細胞。處理0 h、48 h和96 h后,用MTT法檢測細胞增殖情況。結果顯示,α-MSH可抑制hDF的增殖能力(圖1左),而未對hKF的增殖產生明顯影響(圖1右)。
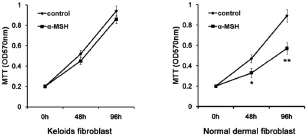
圖1 α-MSH對正常皮膚和瘢痕疙瘩成纖維細胞增殖的影響Fig.1The effect of α-MSH on the proliferation of fibroblasts derived from normal skin and keloids

圖2 qPCR檢測正常皮膚和瘢痕組織中MC-1R和α-MSH的mRNA表達水平Fig.2The expression of MC-1R and α-MSH mRNA in normal skin and keloids by qPCR
2.2qPCR檢測正常皮膚和瘢痕疙瘩組織中MC-1R和α-MSH的mRNA表達水平
與正常皮膚相比,瘢痕疙瘩組織中MC-1R表達水平降低(圖2A),而α-MSH水平升高(圖2B),差異有統計學意義(P<0.01),提示hKF表型發生了改變,MC-1R表達減少,而α-MSH代償性升高。
2.3 MC-1R RNA干擾的效果分析
hDF細胞經轉染MC-1R siRNA 48 h及72 h后,通過檢測MC-1R mRNA發現:MC-1R siRNA能夠顯著抑制MC-1R mRNA的表達(圖3A)。通過轉染后72 h檢測MC-1R蛋白水平發現,MC-1R的蛋白表達水平也能被MC-1R的siRNA抑制(圖3B)。這些結果證明了MC-1R RNA干擾的有效性。

圖3 MC-1R RNA干擾的效果分析Fig.3The knockdown efficacy of MC-1R siRNA
2.4MC-1R RNA干擾對α-MSH抑制hDF增殖作用的影響
hDF經轉染MC-1R siRNA后,用α-MSH分別處理0 h、48 h和96 h,然后用MTT法檢測細胞增殖情況。結果顯示,將hDF的MC-1R基因沉默后,α-MSH不能發揮對hDF增殖能力的抑制作用。在α-MSH處理后,與轉染對照組相比,轉染MC-1R siRNA的hDF增殖能力強,差異顯著(P<0.05)(圖4)。

圖4 MC-1R RNA干擾對α-MSH抑制hDF增殖作用的影響Fig.4The influence of MC-1R siRNA on the α-MSH inhibitory effect of hDF proliferation
3 討論
異常的創傷愈合會導致瘢痕疙瘩的形成,典型癥狀為超出原傷口界限向周圍組織侵入性生長,表面光滑,存在時間長,不能自愈,切除后易復發,可造成局部瘙癢、疼痛以及攣縮,給患者帶來生理和心理上的痛苦[2-3]。瘢痕疙瘩的形成經過3個病理階段,分別為炎癥期、增殖期和成熟期,成纖維細胞是這一過程中的效應細胞,成纖維細胞的過度增殖和功能活躍導致細胞外基質(ECM)的過度沉積是瘢痕疙瘩的組織學基礎[4]。
MSH是一種內源性神經免疫調節肽,可分為α-MSH、β-MSH、γ-MSH 3種。最早發現α-MSH的生物功能主要是調控皮膚色素沉著過程。黑皮素受體(Melanocortin receptor,MCR)共有5種亞型:MC-1R、MC-2R、MC-3R、MC-4R和MC-5R,正常黑素細胞可表達多種MCR,而成纖維細胞僅表達MC-1R[5]。
瘢痕疙瘩的形成可能與MSH的異常代謝有關,且眾多臨床現象也支持這一結論:①黑種人瘢痕疙瘩發生率高,該人種的黑素細胞對MSH的刺激反應敏感;②白化病患者很少發生瘢痕疙瘩;③瘢痕疙瘩主要發生在身體黑素細胞較多的部位,而在黑素細胞較少的部位如手掌、足底等處,則罕見瘢痕疙瘩發生;④瘢痕疙瘩在垂體功能活躍期,如青春期和妊娠期發病率高,該期伴隨著皮膚色素增加;⑤氫化可的松類藥物可抑制瘢痕疙瘩的生長,這種類固醇藥物具有抑制MSH產生的作用[6-7]。也有研究顯示,瘢痕疙瘩組織中α-MSH水平明顯高于正常瘢痕及正常皮膚組織[8]。上述結果提示,α-MSH與瘢痕疙瘩的形成有正向調控關系。
同時又有更多文獻證實,α-MSH可能對瘢痕形成具有抑制性的調控作用。α-MSH可誘導成纖維細胞分泌膠原酶,而膠原酶是分解細胞外基質的重要蛋白酶,是抑制瘢痕形成的重要環節[9];α-MSH還可通過轉錄后調控機制抑制TGF-β誘導的成纖維細胞膠原的合成[10]。白介素-1(IL-1)可誘導成纖維細胞分泌IL-8,α-干擾素可激活成纖維細胞中轉錄因子激活蛋白-1(AP-1)并誘導其生成細胞間黏附因子-1(ICAM-1),而α-MSH可通過抑制以上機制而進行免疫調控,拮抗炎癥反應,最終抑制膠原合成和促進膠原降解[11]。由于成纖維細胞發生表型改變是瘢痕形成過程中的關鍵事件,與正常成纖維細胞相比,瘢痕中的成纖維細胞高表達生長因子受體,使其更迅速對PDGF和TGF-β等生長因子做出應答,從而有利于瘢痕形成[12]。因此,我們假設瘢痕疙瘩成纖維細胞(hkF)中α-MSH受體異常,從而使得α-MSH無法實現對瘢痕形成的抑制性調控。
本實驗研究了α-MSH對成纖維細胞增殖的作用。MTT結果顯示,α-MSH可抑制hDF的增殖,而對hKF增殖的影響沒有統計學意義;通過qPCR檢測了瘢痕疙瘩和正常皮膚中MC-1R和α-MSH的表達。結果顯示,與正常皮膚組織相比,瘢痕疙瘩組織中MC-1R的mRNA表達水平明顯下降,而α-MSH的表達增加;將hDF轉染MC-1R siRNA后,α-MSH對其增殖能力的抑制程度顯著降低。以上結果驗證了我們的假設,說明α-MSH通過與其受體MC-1R結合,發揮對成纖維細胞增殖的負向調控;而hkF中MC-1R表達降低,導致α-MSH功能無法實現,并出現代償性高表達,最終成纖維細胞增殖過快促進瘢痕疙瘩的形成。本實驗為深入了解瘢痕疙瘩的形成提供了新的證據,并為瘢痕疙瘩的有效治療提供了實驗依據。
[1]Gauglitz GG,Korting HC,Pavicic T,et al.Hypertrophic scarring and keloids:pathomechanisms and current and emerging treatment strategies[J].Mol Med,2011,17(1-2):113-125.
[2]Peacock EE Jr,Madden JW,Trier WC.Biologic basis for the treatment of keloids and hypertrophic scars[J].South Med J,1970,
The Expression of Melanocortin 1 Receptor in Keloids and the Effects of Its Gene Silencing in Fibroblasts Proliferation
ObjectiveTo investigate the expression of melanocortin 1 receptor(MC-1R)in keloids and the effects of its gene silencing in fibroblasts proliferation.MethodsThe effects of α-MSH on the proliferation of normal dermal fibroblast (hDF)and keloids fibroblast(hKF)were detected by MTT assay;The expression of MC-1R mRNA was detected by qPCR in normal skin tissue and keloids;After the gene silencing of MC-1R,the proliferation of hDF inhibited by α-MSH was detected by MTT assay.Resultsα-MSH could inhibit the proliferation of hDF rather than hKF;Compared with normal skin tissue,the expression of α-MSH mRNA was increased in keloids while the expression of MC-1R mRNA was decreased; After the transfection of MC-1R siRNA,the inhibitory effect of α-MSH on hDF proliferation was decreased obviously. Conclusion The expression of MC-1R is decreased in keloids,which leads to malfunction of proliferation-inhibitory effect of α-MSH and finally results in keloids formation.
Keloids;Melanocortin 1 receptor;Α-melanocyte-stimulating hormone;Fibroblast;Proliferation
R619+.6
A
1673-0364(2011)03-0147-04
LU Chuan,DAI Haiying,ZHANG Jingde,WANG Xiaoyun.
Department of Plastic Surgery,Changhai Hospital,The Second Military Medical University,Shanghai 200433,China.Corresponding author:ZHANG Jingde(E-mail: E-mail:zhangjd789@sohu.com).
10.3969/j.issn.1673-0364.2011.03.007
上海市自然科學基金項目(09ZR1400600)。
200433上海市第二軍醫大學附屬長海醫院整形外科。
張敬德(E-mail:zhangjd789@sohu.com)。

