以次黃嘌呤單核苷酸脫氫酶為靶點的新型抗結核藥物高通量篩選模型的建立及應用
熊小椒,周爽,楊延輝,關艷,肖春玲
·論著·
以次黃嘌呤單核苷酸脫氫酶為靶點的新型抗結核藥物高通量篩選模型的建立及應用
熊小椒,周爽,楊延輝,關艷,肖春玲
目的建立以結核分枝桿菌次黃嘌呤單核苷酸脫氫酶為靶點的新型抗結核藥物高通量篩選模型。
抗結核藥; 次黃嘌呤類; 藥物評價,臨床前
www.cmbp.net.cn 中國醫藥生物技術, 2011, 6(6):445-449
近年來,結核病發病率的不斷攀升使其又一次成為威脅人類健康的重大傳染病之一。結核分枝桿菌(Mycobacterium tuberculosis,MTB)的耐藥問題日趨嚴重,結核病與艾滋病共感染現象不斷增加,使結核病疫情的防控面臨著更為嚴峻的問題[1-2],也使新型抗結核藥物的開發迫在眉睫。
次黃嘌呤單核苷酸脫氫酶(IMPDH)是 MTB從頭合成鳥嘌呤核苷酸(GMP)途徑的關鍵酶。IMPDH 能夠以煙酰胺腺嘌呤二核苷酸(NAD+)作為受氫體,將次黃嘌呤核苷酸(IMP)氧化生成黃嘌呤核苷酸(XMP),而 XMP 正是生命體從頭合成 GMP 的前體物質。所以,抑制 IMPDH 的活性可以阻止 GMP 的合成,從而抑制 MTB 的生長和增殖。Sassetti 等[3]的研究也證明,編碼 IMPDH 的基因為 MTB 生長所必需。而 MTB 的 IMPDH和人源 IMPDH 在其 IMP 結合位點上的核苷酸抑制因子結合區有很大不同[4]。所以,MTB IMPDH是新型抗結核藥物的潛在靶點,使研發選擇性抑制MTB 的藥物成為可能。
MTB H37Rv 基因組中包含有 3 個編碼IMPDH 的基因[5]:guaB1(Rv1843c)、guaB2 (Rv3411c)和 guaB3(Rv3410c)。轉座子突變研究已經表明,MTB 的 guaB2 基因是這 3 個基因中唯一的必需基因[3]。
本研究通過在體外測定重組表達的 MTB GuaB2 蛋白活性,建立了 MTB GuaB2 抑制劑的高通量篩選(HTS)模型,為發現潛在的具有 MTB GuaB2 抑制作用的新型藥物提供了一種快速有效的方法。
1 材料與方法
1.1 儀器與材料
Hi-trap Fast Flow 親和層析柱、PD-10 脫鹽柱(SephadexTMG-25)AKTA 蛋白純化儀均為美國GE 公司產品;PCR 儀(DNA Engine peltier Thermal Cycler)為美國 Biorad 公司產品;AH 高壓勻漿儀(AH-Basic)為加拿大 Ats engineering Inc. 公司產品;Envision 酶標儀為美國 Perkin Elmer 公司產品。
NAD+購自美國 Sigma 公司;IMP 購自英國Acros Organics 公司;IPTG 購自美國 Merck 公司;DNA 分子量標準購自北京全式金生物技術有限公司;蛋白質分子量標準購自加拿大 Fermentas公司;引物合成和質粒序列測定由上海生工生物工程技術服務有限公司完成。表達載體 pBEV 由美國 Vertex 制藥公司提供;大腸桿菌 DH5α 和大腸桿菌 BL21(DE3)pLysS 質粒受體菌購自北京天根生物公司。
1.2 方法
1.2.1MTB GuaB2 的表達與純化 以 MTB H37Rv 基因組為模板,GuaB2nt1:5′ AATGGCATA TGTCCCGTGGCATGTC 3′ 和 GuaB2nt2:5′ TAAA CCTCGAGTTAGCGCGCGTAGT 3′ 為引物(下劃線為酶切位點),經 PCR 擴增,條件為:94 ℃ 預變性 3 min;94 ℃ 變性 30 s,55 ℃ 復性 30 s,72 ℃ 延伸 3.5 min,32 個循環;最后 72 ℃ 反應10 min。NdeI 和XhoI 雙酶切后與表達載體pBEV連接,轉化入E.coliDH5α,用含 100 mg/L氨芐青霉素(Amp)LB 平板篩選陽性克隆子。將測序正確的質粒轉化入E.coliBL21(DE3)pLysS,在含 100 mg/L Amp 和 34 mg/L 氯霉素的 BHI 平板上篩選得到 GuaB2 蛋白穩定表達菌株。基本操作參見分子克隆實驗指南[6]。挑取單菌落于 BHI液體培養基中 37 ℃、200 r/min 過夜培養,以 1∶50的比例接種于 BHI 培養基中,培養至OD600= 0.4 ~ 0.6。加入 IPTG 至終濃度為 1 mmol/L,28 ℃,200 r/min 誘導 10 h。低溫離心收集菌體,用細胞壓力破碎儀在 8 × 107Pa 條件下破碎菌體 2 遍,用 Ni2+親和色譜法進行蛋白純化。聚丙烯酰胺凝膠電泳(SDS-PAGE)后,用考馬斯亮藍染色,觀察蛋白表達、純化情況。將凝膠內蛋白條帶電轉至硝酸纖維素膜上,5% 脫脂奶粉封閉 2 h,加入His-tag 單克隆抗體,4 ℃ 過夜。加入 lgG-HRP 二抗,室溫 2 h,增強型化學發光試劑(enhanced chemilum inescence,ECL)發光,顯影。
1.2.2酶活性測定及篩選條件的優化 于 96 孔酶標板中加入 GuaB2 活性測定緩沖體系[100 mmol/L Tris-HCl(pH 8.0),100 mmol/L KCl,2.5 mmol/L EDTA及1 mmol/L DTT],100 mmol/L 的 IMP 0.5 μl 和 100 mmol/L 的 NAD+2.5 μl,GuaB2 1 μg,使每孔終體積為 100 μl。在 25 ℃ 條件下檢測 340 nm 波長的光吸收值(OD340)變化。優化參數包括:反應底物 IMP(1.5 ~ 0.0117 μmol/L,對倍稀釋)和 NAD+的濃度(10 ~ 0.0781 μmol/L,對倍稀釋),25 ℃ 下酶促反應時間(10 ~ 70 min,間隔 10 min),酶量(8.24 ~ 0.26 U,對倍稀釋)。
1.2.3酶抑制劑的高通量篩選 以優化后的反應條件進行篩選,每塊 96 孔酶標板上設 80 個待篩樣品孔及 4 個陽性對照孔和 4 個陰性對照孔。由于目前沒有已報道的 MTB GuaB2 酶抑制劑,本研究以加入熱變性酶作為陽性對照。每孔加入待測樣品終濃度為 10 μg/ml,在 25 ℃ 條件下檢測30 min 內反應體系OD340的變化,計算酶的反應速率。利用反應速率計算樣品對 GuaB2 的抑制率(R):R(%)=(1 - VS/VN)× 100%。其中 VS代表待測樣品孔的酶反應速率;VN代表陰性對照孔的平均酶反應速率。
根據以上條件,我們對本所藥用化合物樣品庫中的 1765 個化合物進行了初篩,選擇抑制率 ≥50% 的樣品作為活性樣品,按照初篩的反應條件和方法進行復篩。根據復篩結果,確定 GuaB2 抑制劑的抑制率。
1.2.4高通量篩選模型的評價 Z’ 因子法是評價HTS 模型的一種重要方法。根據公式計算 Z’ 因子值:Z’ = 1 - 3(SDn + SDp)/(Vn - Vp)。其中 Vn 和 SDn 分別為陰性對照孔的酶反應速率平均值和標準差;Vp 和 SDp 分別代表陽性對照孔的酶反應速率平均值和標準差。
2 結果
2.1 GuaB2 表達載體的構建
PCR 產物經 1% 的瓊脂糖凝膠電泳鑒定,得到了長度為 1590 bp 的guaB2 基因(圖1)。選取經PCR 驗證為陽性的菌落,提取質粒,用雙酶切的方法進一步驗證(圖2)。酶切鑒定正確的質粒進行測序分析經比對與 GeneBank 中 MTB 的guaB2 基因序列一致。
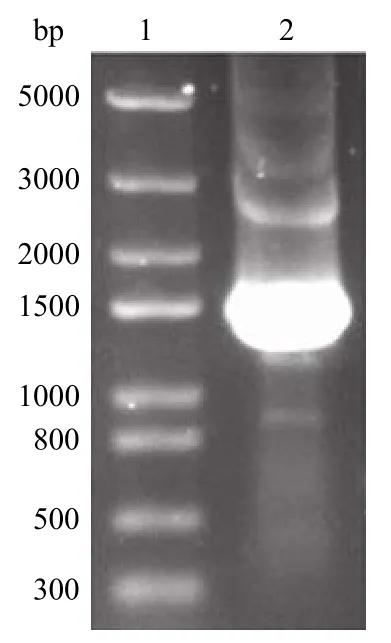
圖1 guaB2 的 PCR 擴增結果Figure 1 PCR product ofguaB2

圖2 pBEV::guaB2 的雙酶切驗證Figure 2 Restriction enzymatic analysis of pBEV::guaB2
2.2 GuaB2 的表達及純化
對表達純化得到的 GuaB2 蛋白進行 SDSPAGE 分析,相對分子質量約為 57 kD,與理論預期值一致。純化得到的融合蛋白可見單一條帶。經western blot 鑒定,結果表明該蛋白條帶確為 GuaB2融合蛋白(圖3)。

圖3 His-GuaB2 蛋白的純化及 western blot 檢測 His-GuaB2 的表達Figure 3 Purification of His-GuaB2 and western blot analysis of the expression of His-GuaB2

圖4 篩選條件的優化Figure 4 Optimization of screening conditions
2.3 酶活性測定及篩選條件優化
GuaB2 酶活測定原理是應用吸光光度法檢測酶催化反應產物 NADH。GuaB2 酶活力的定義:25 ℃ 條件下反應,每分鐘內催化生成 1 μmol/L底物的酶量設定為 1 U。純化脫鹽后的 GuaB2 為0.2 mg/ml,酶比活力為 736 U/mg。對篩選體系進行優化,最佳的篩選條件是 IMP 的濃度為0.5 mmol/L;NAD+濃度為 2.5 mmol/L;酶促反應時間 30 min;GuaB 酶量為 4 U/孔(圖4)。
2.4 篩選方法的評估
目前廣泛使用的 HTS 模型的穩定性和可靠性評估參數是 Z’ 因子[7],它是一個統計學參數,與篩選源無關,僅與篩選方法本身有關。一般認為,如果 Z’ > 0.5,說明該篩選模型是比較理想的適合于 HTS 的方法;如果 Z’ < 0.5,則說明篩選方法還需要調整。本實驗中 HTS 的 Z’ 因子值為 0.68(圖5)。因此,所建立的篩選方法是一種穩定性和靈敏度都較好的 HTS 方法。

圖5 評價 GuaB2 抑制劑高通量篩選方法(Z’ ≈ 0.68)Figure 5 Evaluation of the HTS method for inhibitors of GuaB2 (Z’ ≈ 0.68)
2.5 GuaB2 抑制劑的篩選
采用建立的 HTS 模型,對本所藥用化合物庫中 1765 個化合物進行篩選。初篩發現抑制率 >50% 的樣品 23 個,進行復篩得到抑制活性較好的5 個化合物,其化合物編號及其對重組 MTB GuaB2 的抑制率見表 1。

表1 各活性化合物在 10 μg/ml 濃度下對 GuaB2 的抑制率Table 1 The inhibition ratio of recombinant H37Rv GuaB2 activity by 10 μg/ml active compounds
3 討論
近年來已有研究證明,抑制 IMPDH 的活性可以阻止生命體在生長和增殖過程中所需 GMP 的供應,從而達到治療癌癥、自身免疫性疾病、病原微生物(病毒、原蟲以及細菌)感染疾病的目的[8]。目前,微生物體內的 IMPDH 作為抗菌藥物發現的潛在靶點越來越受到重視。例如,已經通過 HTS的方法得到了微小隱孢子蟲(Cryptosporidium parvum)IMPDH 的有效抑制劑[9-10]。相關研究已經表明,MTB IMPDH 是研發新型抗結核藥物的優良潛在靶點,建立以 MTB IMPDH 為靶點的 HTS模型以發現具有 GuaB2 抑制作用的藥物對于結核病的治療將具有重要的意義。
本實驗構建了 MTB GuaB2 的表達質粒pBEV::guaB2,純化得到了可溶性蛋白,依據反應產物 NADH 的吸收特性對 MTB GuaB2 蛋白的活性進行測定。通過對反應體系的優化,建立了GuaB2 抑制劑的 HTS 模型,其 Z’ 因子值達到了0.68。應用該模型,對 1765 個化合物進行了篩選。結果表明,該模型具有微量、快速、靈敏、穩定等特點,為尋找和發現 MTB GuaB2 抑制劑提供了一種新的技術和方法。建立 GuaB2 抑制劑 HTS 模型的最終目的是發現活性先導化合物,利用該模型在我所化合物庫中發現了有較強 GuaB2 活性抑制作用的化合物 2 個(抑制率 > 80%),具有進一步深入研究的意義。但是,利用該方法篩選獲得的活性化合物,僅能證明其在體外具有 GuaB2 抑制作用,還需要進行更多的研究以全面評價其體內外活性,以便將這些活性化合物開發成新的抗結核藥物。
[1] Zhang Y. The magic bullets and tuberculosis drug targets. Annu Rev Pharmacol Toxicol, 2005, 45:529-564.
[2] Das P, Horton R. Tuberculosis--time to accelerate progress. Lancet, 2010, 375(9728):1755-1757.
[3] Sassetti CM, Boyd DH, Rubin EJ. Genes required for mycobacterial growth defined by high density mutagenesis. Mol Microbiol, 2003, 48(1):77-84.
[4] Shu Q, Nair V. Inosine monophosphate dehydrogenase (IMPDH) as atarget in drug discovery. Med Res Rev, 2008, 28(2):219-232.
[5] Cole ST, Brosch R, Parkhill J, et al. Deciphering the biology of Mycobacterium tuberculosis from the complete genome sequence. Nature, 1998, 393(6685):537-544.
[6] Sambrook J, Fritsch EF, Maniatis T. Molecular cloning. Jin DY, Li MF, Translation. 2nd ed. Beijing: Science Press, 1992:34-55. (in Chinese)薩姆布魯克, E.F沸里奇, 曼尼阿蒂斯. 分子克隆實驗指南. 金冬燕,黎孟楓, 譯. 2版. 北京: 科學出版社, 1992:34-55.
[7] Zhang JH, Chung TD, Oldenburg KR. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. J Biomol Screen, 1999, 4(2):67-73.
[8] Hedstrom L. IMP dehydrogenase: structure, mechanisum, and inhibition. Chem Rev, 2009, 109(7):2903-2928.
[9] Umejiego NN, Gollapalli D, Sharling L, et al. Targeting a prokaryotic protein in a eukaryotic pathogen: identification of lead compounds against cryptosporidiosis. Chem Rev, 2008, 15(1):70-77.
[10] Maurya SK, Gollapalli DR, Kirubakaran S, et al. Triazole inhibitors of Cryptosporidium parvum inosine 5’-monophosphate dehydrogenase. J Med Chem, 2009, 52:4623-4630.
Establishment and application of a novel high-throughput scr eening model targeting to inosine monophosphate dehydrogenase for antitubercular drugs
XIONG Xiao-jiao, ZHOU Shuang, YANG Yan-hui, GUAN Yan, XIAO Chun-ling
ObjectiveTo establish a high-throughput (HTS) screening model targeting inosine monophosphate dehydrogenase (IMPDH) for the discovery of novel antitubercular drugs.MethodsThe H37Rv IMPDH coding gene guaB2 was amplified and cloned into pBEV expression vector. The recombinant GuaB2 protein was expressed in Escherichia coli BL21(DE3)pLysS and itsactivity was measured at 340 nm wavelength absorbance. HTS screening model was established based on the activity of GuaB2 and Z’ factor was used to evaluate the quality of the HTS model. Total of 1765 compounds were screened for the inhibition of GuaB2 activity with the model.ResultsRecombinant H37Rv GuaB2 vector was successfully constructed and expressed, with the optimal enzymatic activity being 736 U/mg for the GuaB2 protein. The parameter Z’ factor was 0.68, suggesting that the HTS model was highly feasible and stable for drug screening. In order to test the HTS model, 1765 compounds were screened and 5 compounds were found to inhibit GuaB2 activity, showing the 0.28% positive rate.ConclusionA steady and sensitive HTS model for potential GuaB2 inhibitors was established. The hits of GuaB2 inhibitors were meaningful to further study.
Anitubercular agents; Hypoxanthines; Drug evaluation, preclinical
XIAO Chun-ling, Email: xiaocl318@163.com
10.3969/cmba.j.issn.1673-713X.2011.06.011
國家“重大傳染病防治”科技重大專項(2008ZX10003-006)
100050 北京,中國醫學科學院醫藥生物技術研究所重點室
肖春玲,Email:xiaocl318@163.com
2011-09-28
方法以結核分枝桿菌 H37Rv 基因組為模板,pBEV 表達質粒為載體,將 guaB2 基因克隆至 pBEV 以構建pBEV::guaB2 重組表達質粒,表達并純化重組的結核分枝桿菌次黃嘌呤單核苷酸脫氫酶;建立以測定反應體系 340 nm吸光值變化速率來評價該酶活性的檢定方法;構建次黃嘌呤單核苷酸脫氫酶抑制劑的高通量篩選模型,對該模型的可靠性進行評價并應用該模型對 1765 個化合物進行篩選。
結果成功構建了結核分枝桿菌 guaB2 基因的表達載體;最佳反應條件下重組結核分枝桿菌次黃嘌呤單核苷酸脫氫酶酶比活力為 736 U/mg;所建立的高通量篩選模型 Z’ 因子為 0.68,可用于次黃嘌呤單核苷酸脫氫酶抑制劑篩選;應用此模型對 1765 個化合物樣品進行篩選,得到 5 個具有酶抑制活性的樣品,陽性率為 0.28%。
結論建立了穩定性好、靈敏度較高的結核分枝桿菌次黃嘌呤單核苷酸脫氫酶抑制劑高通量藥物篩選模型,應用該模型篩選得到的陽性藥物具有進一步深入研究的意義。
Author Affiliation:State-Key Laboratory for Drug Screening, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences, Beijing 100050, China
www.cmbp.net.cn Chin Med Biotechnol, 2011, 6(6):445-449

