從鉬酸鹽溶液中分離微量鎢的機理研究
肖 超,肖連生,曹佐英
(中南大學冶金科學與工程學院,湖南長沙 410083)
0 概述
鎢鉬是極為重要的戰略有色金屬,常常共生于礦物中,由于鎢鉬的性質極為相似,所以鎢鉬分離一直是分離科學領域的難題。目前從鎢酸鹽中除鉬較為成熟,而且在工業中廣為應用的方法還是利用鉬容易硫代化形成硫代鉬酸根,而鎢依然以鎢酸根形式存在,擴大鎢鉬性質差異,然后采用萃取、離子交換或者選擇沉淀等方法除鉬。從鉬酸鹽中分離微量鎢同樣是鉬冶金中的難題,卻沒有成熟的分離理論和工藝。據報導從鉬酸鹽中分離鎢方法有:萃取法[1]、沉淀吸附法[2]、離子交換法[3]等。比較上述方法,沉淀吸附法是目前報導較多的方法,但是其操作麻煩、需要控制條件較多、鉬鎢分離系數不是很大、除鎢過程鉬的損失比較大;溶劑萃取或者離子交換法都能夠深度除鎢,但是離子交換法在鉬鎢分離深度、環境友好程度均優于溶劑萃取法。就目前鉬中除鎢技術在工業中的應用看,離子交換法應該會成為主流工藝。
目前從鉬酸鹽溶液中除鎢,主要原理是利用鎢、鉬同多酸形成條件的差異。但是,卻鮮有文獻從熱力學方面對其分離理論進行研究。為了深入理解鉬中除鎢原理,更好地開發鉬中除鎢技術,本文通過熱力學分析,在特定 pH值段繪制了W-H2O系和Mo -H2O系的 CX/C0-pH圖,建立了鎢鉬分離的理論,同時通過試驗,驗證該理論的合理性。
1 鎢鉬溶液熱力學分析
1.1 W-H2O系的熱力學分析
鎢的離子形態極為復雜,對其研究目前還沒有一個定論,大體來說,在溶液 pH>9左右,鎢以WO24-存在,隨著溶液 pH值的減低鎢離子逐漸酸化、聚合,依次形成不同聚合度的多聚鎢酸根離子[4]。由于鎢聚合陰離子的形態還沒有研究透徹,其對應的熱力學數據更是缺乏或者不準確。本文主要研究的是鎢、鉬同多酸聚合能力的差異,所有著重考察聚合為同多酸的過程。本文查閱總鎢濃度為 0.005 mol/L(即WO3為 1.15 g/L)時,聚合的反應,對應的熱力學數據[5]見表 1。
表 1 聚合平衡式及平衡常數 (25℃)

表 1 聚合平衡式及平衡常數 (25℃)
序號 反應平衡 平衡常數pK 1 12WO2-4 +14H+=H2W12O10-42 +6H2O 111.5 2 6WO2-4 +6H+=H2W6O6-22+2H2O 48.4 3 7WO2-4 +9H+=HW7O-24+4H2O 71.24 4 WO2-4+H+=HWO-4 3.62 5 WO2-4 +8H+=W7O6-24+4H2O 65.19 6 WO2-4 +2H+=WO3(H2O)(aq) 8.7
據已有的文獻[5]可知:當溶液 pH>9.0時,鎢主要以存在;當溶液 pH<5.5時,基本轉化為聚鎢酸根離子。所以,在此我們考察溶液 pH于 10~5.5范圍鎢的離子形態。根據表 1提供的熱力學平衡關系可知,進行熱力學計算,由于溶液鎢離子濃度低,所以采用濃度代替活度。由熱力學理論,可得出以下數學關系式:

由以上化學方程式可知溶液中總鎢濃度:

當溶液總鎢濃度[W]=0.005 mol/L,根據以上數據求得溶液 pH值范圍為 10~5.5時,鎢離子存在形態與溶液 pH值的關系,如圖 1所示。
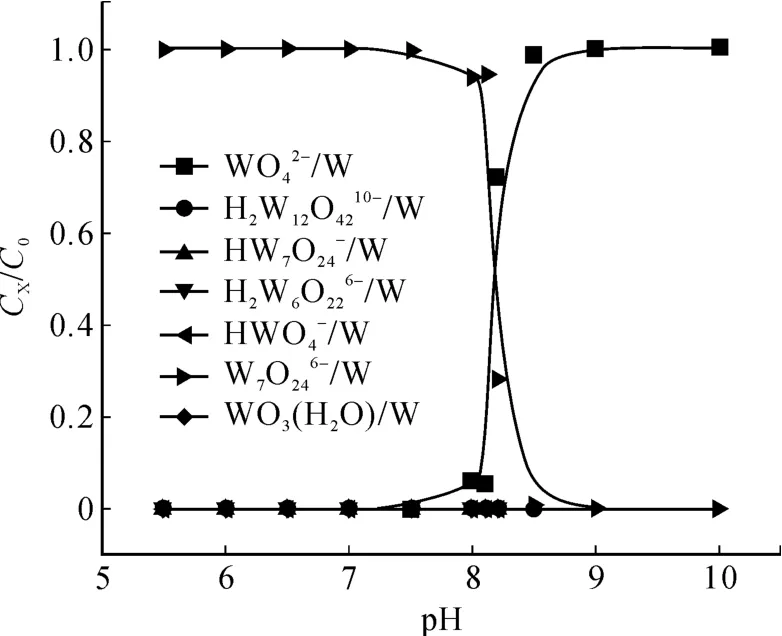
圖1 0.005 mol/L鎢的 CX/C0-pH曲線
1.2 Mo-H2O系的熱力學分析
鉬在溶液中的熱力學情況同樣復雜[7],當溶液的 pH>9時,鉬在溶液中以存在,當pH<6時,鉬基本上以聚離子存在,所以考察鉬于 pH為 10~5.5時,鉬離子存在的形式。本文查閱總鉬濃度為 2 mol/L(即Mo為 192 g/L)時聚合的反應,對應的熱力學數據[8]見表 2。
由表 2提供的熱力學平衡關系可知,進行熱力學計算,由于溶液鉬離子活度系數沒有詳細的數據,所以采用濃度代替活度。由熱力學理論,可得出以下數學關系式:
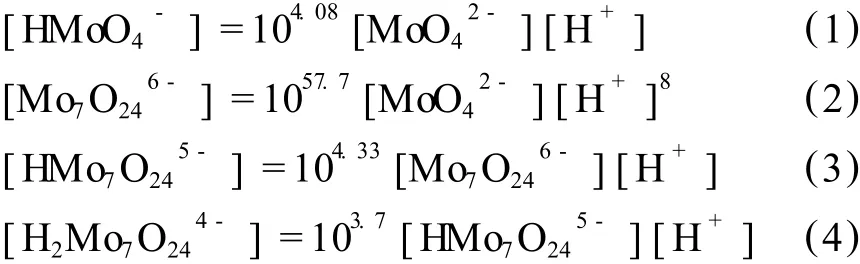
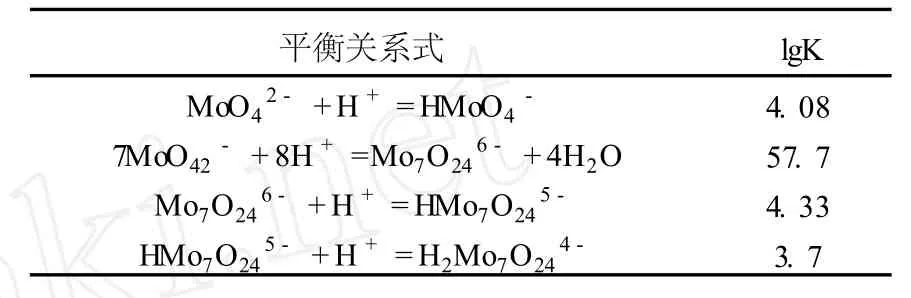
表 2 MoO2-4聚合平衡式與對應的平衡常數 (25℃)
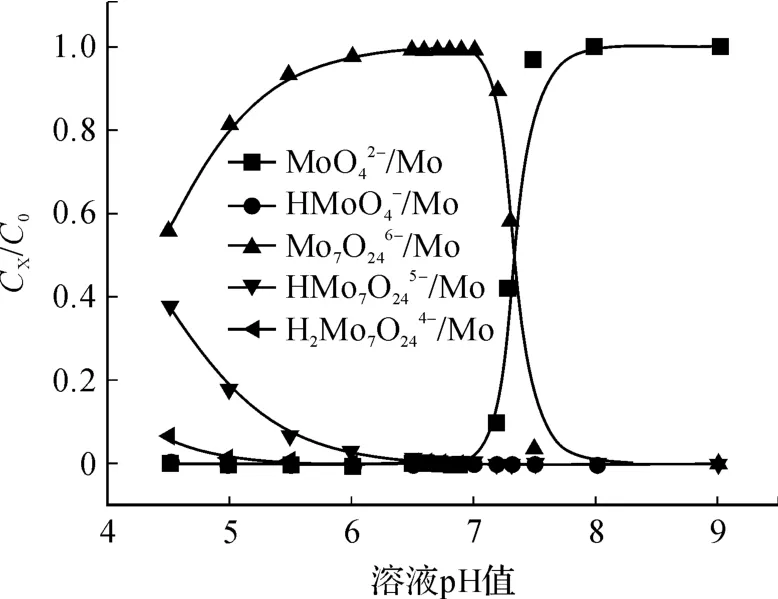
圖2 2 mo l/L鉬的 CX/C0-pH圖
2 鎢鉬分離原理
2.1 鎢鉬離子存在形態
由鎢的熱力學計算可知:當溶液中總鎢濃度為0.005 mol/L時,在 pH為 8.5時W開始聚合;在pH值為 8.0時 90%的W聚合為 W7O246-。由鉬的熱力學分析可以得出:當溶液中總鉬濃度為2 mol/L時,于 pH為 8.0時開始聚合,pH為7.0時,90%的聚合為。如果將含鎢、鉬溶液的 pH值從堿性向酸性調整時,顯然鎢首先聚合為,而鉬在 pH為 7.5之前主要仍以存在。
2.2 典型體系鎢鉬分離機理
以工業中常見的鉬酸鹽溶液中除鎢體系為參照,設定溶液中鉬為2 mol/L,鎢為0.005 mol/L,鎢、鉬存在形態分別以為研究對象,研究該體系鉬中除鎢的機理。
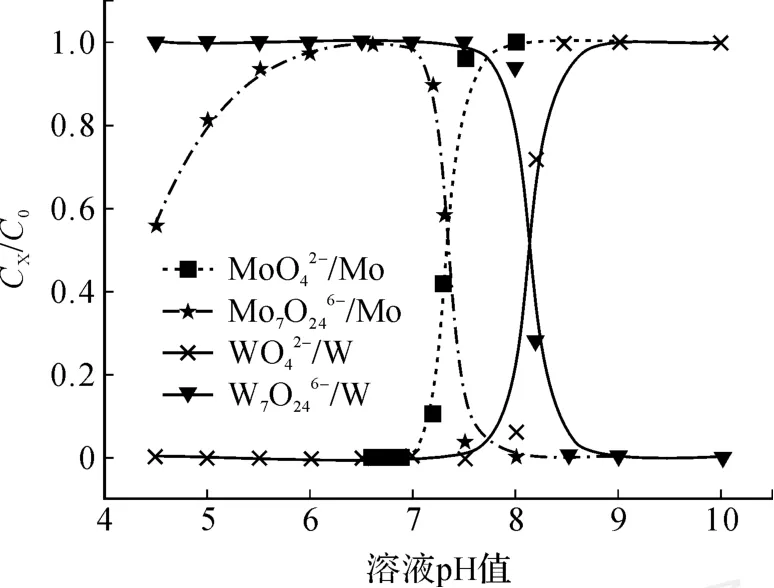
圖 3 鉬酸鹽中分離鎢原理
3 離子交換法從鉬酸鹽中吸附鎢
試驗采用工業含鎢鉬酸銨溶液為除鎢試驗對象,每次取某堿性樹脂 15 mL,加入 80 mL調好 pH值的含鎢鉬酸銨溶液,靜態吸附 2 h,試驗結果見表 3。
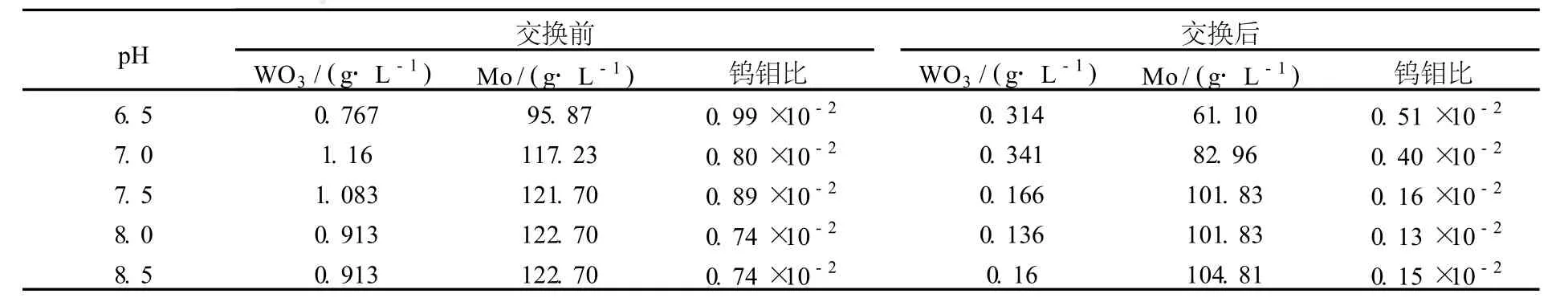
表 3 某堿性樹脂靜態交換試驗結果
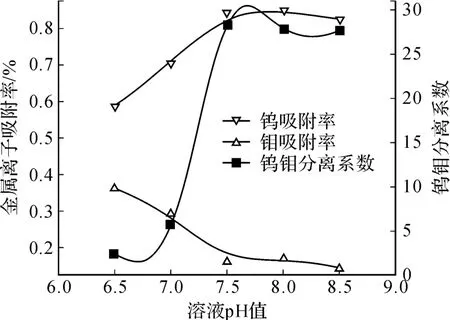
圖 4 溶液 pH值對鉬酸鹽中除鎢的影響
試驗結果表明,鎢在 pH值于 7.5~8.0吸附率最高,當溶液 pH>8.0時,部分鎢開始以WO42-存在;當溶液 pH<7.5時,鉬開始以存在,由于溶液中鉬的濃度遠高于鎢,所以 pH<7.5時鎢鉬聚陰離子發生競爭吸附,鎢的吸附率也開始快速降低;鉬隨著溶液 pH值的增大,吸附率減低,該規律與鉬離子形態變化規律一致;且當溶液 pH>7.5時,鉬的吸附率基本保持不變,因為此時溶液中的鉬絕大部分以存在,且不再隨著溶液 pH值的增大而改變;在溶液 pH值為 7.5~8.0之間,鎢鉬分離系數達到最大值,與之前熱力學理論分析得出結論一致。
4 結論
(2)鉬在 pH>7.5時主要以MoO42-存在,鉬于pH為 7.0時絕大多數聚合為Mo7O246-。
(3)通過熱力學分析,可以利用鎢鉬同多酸聚合條件差異進行鎢鉬分離,其中,采用離子交換法分離鎢鉬的機理為:6RCl+?R6W7O24+6Cl-和 3R2MoO4?R6W7O24+。
(4)最佳的分離 pH值點為 7.5,工業生產可以取 pH范圍為 7.5~8.0,理論與試驗結果相符合。
[1] Peng-ge Ning,Hong-bin Cao,Yi Zhang.Selective extraction and deep removal of tungsten from sodium molybdate solution by primary amine N1923[J].Separation and Purification Technology,2009,70:27-33.
[2] 呂瑩,孫放.Fe(OH)3吸附法從高鎢鉬酸鈉溶液中分離鎢鉬的研究 [J].稀有金屬與硬質合金,2005,3:1-3.
[3] 肖連生,龔柏藩.一種從高濃度鉬酸鹽溶液中深度凈化除去微量鎢的方法:中國.CN101264933[P].2008 -9-17.
[4] John W.van Put.Crystallisation and processing of ammonium paratungstate(APT)[J].Refractory Metals &HardMaterial,1995,13(6):1-76.
[5] A.Koutsospyros,W.Braida,C.Christodoulatos,D. Der matas,N.Strigul.A review of tungsten:from environmental obscurity to scrutiny[J].Journal of Hazardous Materials.20 06,136:1-19.
[6] 陸淑引(譯).離子平衡及其數學處理[M].天津:南開大學出版社,1989:378-381.

