中國抗癌協(xié)會乳腺癌診治指南與規(guī)范(2011版)
中國抗癌協(xié)會乳腺癌專業(yè)委員會
一 乳腺癌篩查指南
1 乳腺癌篩查的定義、目的以及分類
⑴腫瘤篩查,或稱作普查,是針對無癥狀人群的一種人群防癌措施,而針對有癥狀人群的醫(yī)學檢查稱作診斷。
⑵乳腺癌篩查是通過有效、簡便、經濟的乳腺檢查措施,對無癥狀婦女開展篩查,以期早期發(fā)現(xiàn)、早期診斷以及早期治療。其最終目的是要降低人群乳腺癌的死亡率。
⑶篩查分為機會性篩查(opportunistic screening)和群體普查(mass screening)2種。機會性篩查是婦女個體主動或自愿到提供乳腺篩查的醫(yī)療機構進行相關檢查;群體普查是社區(qū)或單位實體有組織地為適齡婦女提供乳腺篩查。
2 婦女參加乳腺癌篩查的起始年齡
⑴機會性篩查一般建議40周歲開始,但對于一些乳腺癌高危人群可將篩查起始年齡提前到20周歲。
⑵群體普查推薦年齡為50~69周歲。
3 用于乳腺癌篩查的措施
3.1 乳腺X線檢查
⑴乳腺X線檢查對降低40歲以上婦女乳腺癌死亡率的作用已經得到了國內外大多數(shù)學者的認可。
⑵建議每側乳房常規(guī)應攝2個體位,即頭足軸(CC)位和側斜(MLO)位。
⑶乳腺X線影像應經過≥2位專業(yè)放射科醫(yī)師獨立閱片。
⑷乳腺X線篩查40歲以上亞洲婦女準確性高。但乳腺X線對年輕致密乳腺組織穿透力差,故一般不建議對40歲以下、無明確乳腺癌高危因素或臨床體檢未發(fā)現(xiàn)異常的婦女進行乳腺X線檢查。
⑸常規(guī)乳腺X線檢查的射線劑量低,不會危害婦女健康。
3.2 乳腺臨床體檢
⑴單獨作為乳腺癌篩查的方法效果不佳,尚無證據(jù)顯示該方法可以提高乳腺癌早期診斷率和降低死亡率。
⑵一般建議作為乳腺X線篩查的聯(lián)合檢查措施,可能彌補乳腺X線篩查的遺漏。
3.3 乳腺自我檢查
⑴不能提高乳腺癌早期診斷檢出率和降低死亡率。
⑵由于可以提高婦女的防癌意識,故仍鼓勵基層醫(yī)務工作者向婦女傳授每月1次乳腺自我檢查的方法,絕經前婦女應建議選擇月經來潮后7~10 d進行。
3.4 乳腺超聲檢查
⑴單獨作為乳腺癌篩查的措施尚有待證實。可能對致密型乳腺的篩查有價值。
⑵可以作為乳腺X線篩查的聯(lián)合檢查措施或乳腺X線篩查結果為BI-RADS-0級者的補充檢查措施。
3.5 乳腺核磁共振(MRI)檢查
⑴可作為乳腺X線檢查、乳腺臨床體檢或乳腺超聲檢查發(fā)現(xiàn)的疑似病例的補充檢查措施。
⑵設備要求高,價格昂貴,檢查費時,需靜脈注射增強劑。
⑶可與乳腺X線聯(lián)合用于某些乳腺癌高危人群的乳腺癌篩查。
3.6 其他檢查
目前的證據(jù)不支持近紅外線掃描、核素掃描、導管灌洗等檢查作為乳腺癌篩查方法。
4 一般人群婦女乳腺癌篩查指南
4.1 20~39周歲
不推薦對非高危人群進行乳腺篩查。
4.2 40~49周歲
⑴適合機會性篩查。
⑵每年1次乳腺X線檢查。⑶推薦與臨床體檢聯(lián)合。
⑷對致密型乳腺推薦與B超檢查聯(lián)合。
4.3 50~69周歲
⑴適合機會性篩查和人群普查。⑵每1~2年1次乳腺X線檢查。⑶推薦與臨床體檢聯(lián)合。
⑷對致密型乳腺推薦與B超檢查聯(lián)合。
4.4 70周歲或以上
⑴適合機會性篩查。
⑵每2年1次乳腺X線檢查。⑶推薦與臨床體檢聯(lián)合。⑷對致密型乳腺推薦與B超檢查聯(lián)合。
5 乳腺癌高危人群篩查意見
建議提前進行篩查(40歲前),篩查間期推薦每半年1次,篩查手段除了應用一般人群常用的臨床體檢、B超、乳房X線檢查之外,可以應用MRI等新的影像學手段。
6 乳腺癌高危人群的定義
⑴有明顯的乳腺癌遺傳傾向者(具體參見附錄Ⅰ)。
⑵既往有乳腺導管或小葉中重度不典型增生或小葉原位癌患者。
⑶既往行胸部放療的淋巴瘤患者。
二 常規(guī)乳腺X線檢查和報告規(guī)范(附錄Ⅱ)
1 乳腺X線檢查技術規(guī)范
1.1 投照前準備工作
醫(yī)技人員耐心給被檢查者解釋拍片過程以及拍片時夾板壓迫乳房給被檢查者帶來的不適,使之放松,從而使受檢者理解并予以配合。
1.2 常規(guī)投照體位
正確擺位是獲得一張高質量乳腺X線片的基礎。乳腺X線攝片的常規(guī)投照體位為雙側內外側斜(MLO)位及頭足軸(CC)位。1張好的MLO位片顯示如下:乳房被推向前上,乳腺實質充分展開,胸大肌可見,較松弛,下緣達乳頭水平,乳頭在切線位,部分腹壁包括在片中,但與下部乳腺分開,絕大部分乳腺實質顯示在片中。1張好的CC位片顯示如下:乳房在片子的中央,乳頭切線位,小部分胸大肌可見,外側乳腺組織可能不包括在片中。
1.3 補充投照體位和投照技術
對于MLO位及CC位顯示不良或未包全的乳腺實質,可以根據(jù)病灶位置的不同選擇以下體位予以補充:外內側(LM)位、內外側(ML)位、內側頭足軸(MCC)位、外側頭足軸(LCC)位、尾葉(CLEO)位及乳溝位。為了進一步評價在以上常規(guī)攝影中顯示出的異常改變,可進行一些特殊攝影技術,其可在任何投照位上進行。包括局部加壓攝影、放大攝影或局部加壓放大攝影。目的是使病灶得以更好地顯示而明確病變性質。
2 診斷報告規(guī)范
參照美國放射學會的乳腺影像報告和數(shù)據(jù)系統(tǒng)標準(Breast Imaging Reporting and Data System,BI-RADS),描述乳腺內腫塊和鈣化等異常表現(xiàn)的X線征象。
2.1 腫塊
在2個相互垂直(或近似垂直)的投照位置上均能見到的有一定輪廓的占位性病變,僅在1個投照位置上見到的可疑腫塊影稱“致密影”,無明顯邊緣的稱“不對稱”改變。X線所見腫塊并不一定與臨床所觸診的腫塊完全一致。X線圖像上所發(fā)現(xiàn)的腫塊,臨床不一定能夠觸及(因病灶太小或質軟);臨床所觸及的腫塊,X線圖像上亦可能因為患者乳腺實質豐富而未能顯示。部分患者腫塊周邊伴有浸潤和水腫,觸診常比X線圖像所顯示的腫塊范圍要大。腫塊的描述包括邊緣、形態(tài)和密度3個方面,其中腫塊的邊緣征象對判斷腫塊的性質最為重要。
2.1.1 腫塊邊緣描述
⑴清晰:超過75%的腫塊邊界與周圍正常組織分界清晰、銳利。
⑵模糊:超過75%的腫塊邊界被鄰近的正常組織遮蓋而無法對其作進一步判斷。
⑶小分葉:腫塊邊緣呈小波浪狀改變。⑷浸潤:邊界不規(guī)則。
⑸星芒狀:從腫塊邊緣發(fā)出放射狀線影。
2.1.2 腫塊形態(tài)描述
包括圓形、卵圓形、分葉形和不規(guī)則形。
2.1.3 腫塊密度的描述
以腫塊與其周圍相同體積的乳腺組織相比分為高、等、低(不含脂肪)和脂肪密度4種。
2.2 鈣化
對鈣化的描述從形態(tài)和分布2方面進行。
2.2.1 形態(tài)
分為典型良性鈣化、可疑鈣化、高度惡性可能的鈣化。良性鈣化可不描述,但當這些鈣化可能會引起臨床醫(yī)生誤解時,這些良性鈣化需要描述。
⑴典型良性鈣化有以下多種表現(xiàn):①皮膚鈣化(粗大、典型者呈中心透亮改變);②血管鈣化(管狀或軌道狀);③粗糙或爆米花樣鈣化(纖維腺瘤蛻變的特征表現(xiàn));③粗棒狀鈣化(連續(xù)呈棒桿狀,偶可呈分支狀,直徑通常>1 mm,沿導管分布,聚向乳頭,常為雙側乳腺分布,多見于分泌性病變);⑤散在圓形和點狀鈣化;⑥環(huán)形或蛋殼樣鈣化(短徑<1 mm,見于脂肪壞死或囊腫);⑦中空狀鈣化(短徑>1 mm,壁的厚度大于環(huán)形或蛋殼樣鈣化,常見于脂肪壞死、導管內鈣化的殘骸,偶可見于纖維腺瘤);⑧牛奶樣鈣化(為囊腫內鈣化,在CC位表現(xiàn)不明顯,為絨毛狀或不定形狀,在90度側位上邊界明確,根據(jù)囊腫形態(tài)的不同而表現(xiàn)為半月形、新月形、曲線形或線形,形態(tài)隨體位而發(fā)生變化是這類鈣化的特點);⑨縫線鈣化(由于鈣質沉積在縫線材料上所致,尤其在放療后常見,典型者為線形或管形,繩結樣改變常可見到);⑩營養(yǎng)不良性鈣化(常出現(xiàn)于放療后或外傷后的乳腺,鈣化形態(tài)不規(guī)則,多>0.5 mm,呈中空狀改變)。
⑵可疑鈣化通常表現(xiàn)為不定形、粗糙不均質鈣化。
⑶高度惡性可能鈣化的表現(xiàn)為多形性不均質鈣化(顆粒點狀)、線樣分支狀(鑄形)鈣化2種形式。
2.2.2 鈣化分布
⑴彌漫或散在分布:鈣化隨意分散在整個乳腺。雙側性彌漫分布的點樣鈣化多為良性改變。
⑵區(qū)域狀分布:指較大范圍內(>2 cm3)分布的鈣化,但又不能用以下特指的分布類型來描述,常超過1個象限的范圍,這種鈣化分布的性質需結合鈣化形態(tài)綜合考慮。
⑶簇狀分布:指至少有5枚鈣化占據(jù)在1個較小的空間內(<2 cm3),良、惡性病變都可以有這樣的表現(xiàn)。
⑷線樣分布:鈣化排列成線形,可見分支點,提示源于1個導管,多為惡性改變。
⑸段樣分布:常提示病變來源于1個導管及其分支,也可能發(fā)生在1葉或1個段葉上的多灶性癌。盡管良性分泌性病變也會有段樣鈣化,但如果鈣化的形態(tài)不是特征性良性時,首先考慮其為惡性鈣化。
2.3 結構扭曲
指正常結構被扭曲但無明確的腫塊可見,包括從一點發(fā)出的放射狀影和局灶性收縮,或者在實質的邊緣扭曲。結構扭曲也可以是一種伴隨征象,可為腫塊、不對稱致密或鈣化的伴隨征象。如果沒有局部的手術和外傷史,結構扭曲可能是惡性或放射狀疤痕的征象,應提請臨床切除活檢。
2.4 特殊征象
2.4.1 非對稱性管狀結構/單個擴張的導管
管狀或分支樣結構可能代表擴張或增粗的導管。如果不同時伴有其他可疑的臨床或影像征象,其意義不大。
2.4.2 乳腺內淋巴結
典型表現(xiàn)為腎形,可見淋巴結門脂肪所致的透亮切跡,常<1 cm。當淋巴結較大,但其大部分為脂肪替代時,仍為良性改變。可以是多個,也可能是1個淋巴結由于明顯的脂肪替代看上去像多個圓形結節(jié)影。對于乳腺外上部的特征性改變可以做出正確診斷。偶爾也可出現(xiàn)在其他區(qū)域。
2.4.3 球形不對稱
與對側乳腺組織比較方能做出判斷,范圍較大至少達1個象限。包括1個較大的乳腺組織,密度較正常乳腺組織為高或有較明顯的導管可見,無局灶性腫塊形成,無結構扭曲,無伴隨鈣化。常代表了正常變異,或為替代性激素治療的結果。但當與臨床觸及的不對稱相吻合時,則可能有意義。
2.4.4 局灶性不對稱
不能用其他形狀精確描述的致密改變。2個投照位置均顯示,但缺少真性腫塊特有的邊緣改變,較球形不對稱范圍要小。它可能代表的是1個正常的乳腺島,尤其當其中含有脂肪時。但由于其缺乏特征性的良性征象,往往需要對其作進一步檢查,由此可能會顯示1個真性腫塊或明顯的結構扭曲改變。
2.5 合并征象
包括皮膚凹陷、乳頭凹陷、皮膚增厚、小梁增粗、皮膚病變投照在乳腺組織、腋淋巴結腫大。
3 病灶的定位
1個明確的病灶必須是三維立體的存在于乳腺內,這需要病灶在2個投照位上均被看到而得以證實,尤其在2個相互垂直的投照位均顯示時則更精確。需要明確3點。①哪一側:左側或右側。②部位:共7個區(qū)域。患者面對檢查者,根據(jù)鐘面或象限定位或者兩者結合定位。象限定位包括外上象限、外下象限、內上象限和內下象限4個區(qū)域。另外還有3個區(qū)域不要求鐘面定位,即乳暈下區(qū)、中央?yún)^(qū)和尾葉區(qū)。③深度:前1/3、中1/3、后1/3。乳暈下、中央?yún)^(qū)和尾葉區(qū)不要求深度定位。
4 乳腺X線報告的組成
應包括病史,與既往檢查片對比,投照體位,乳腺分型,任何相關的影像發(fā)現(xiàn),最后是評估類別和建議。報告措辭應當簡潔,使用術語詞典里的標準詞匯。應清楚描述任何1個有意義的發(fā)現(xiàn),如有前片,則描寫有無變化,最有意義的是新發(fā)現(xiàn)的病灶。
4.1 乳腺分型
乳腺分型是X線透過乳腺組織衰減后,對整個乳腺構成的簡明描述,有助于判斷X線診斷的可靠程度,即病灶隱藏在正常乳腺組織中的可能性。對X線致密型乳腺,X線片對小病灶的檢出能力隨著乳腺腺體致密的程度上升而下降,臨床醫(yī)生應清楚地認識到這一點。可分為4種:①脂肪型:乳腺組織幾乎完全被脂肪組織所替代。②少量腺體型:有散在的纖維腺體影。③多量腺體型:乳腺組織分布不均勻,呈密度不均勻改變。這一類型會降低病灶檢出的敏感性。④乳腺組織非常致密型:可能會掩蓋其中的病灶。
4.2 評估分類
應給每1個病變作完整的分類和評估。常用的是BI-RADS分級法。
4.2.1 評估是不完全的
BI-RADS 0:需要召回(recall)補充其他影像檢查,進一步評估或與前片比較。常在普查情況下應用,在完全的影像學檢查后則很少用。推薦的其他影像檢查方法包括局部加壓攝影、放大攝影、特殊投照體位、超聲等。在我國,一些婦女乳腺脂肪較少,實質豐富,乳腺組織缺乏自然對比,也需要采用其他影像學方法(如超聲、MRI)進一步檢查,也可將其歸為0類。
4.2.2 評估是完全的——最后分類
⑴BI-RADS 1:陰性,無異常發(fā)現(xiàn)。乳腺是對稱的,無腫塊、結構扭曲和可疑鈣化可見。
⑵BI-RADS 2:良性改變,肯定的乳腺良性腫塊(如纖維腺瘤、脂肪瘤、單純囊腫、積乳囊腫、積油囊腫及混合密度的錯構瘤)、肯定的良性鈣化(如環(huán)狀鈣化、邊界清晰的短條狀鈣化、粗的斑點狀鈣化、稀疏的大小較單一的圓點狀鈣化、多發(fā)的分泌性鈣化等)均屬此類。乳房內淋巴結、血管鈣化、植入體以及符合手術部位的結構扭曲等亦歸為此類。總的來說并無惡性的X線征象。
⑶BI-RADS 3:可能是良性改變,建議短期隨訪。有很高的良性可能性,放射科醫(yī)生期望此病變在短期(<1年,一般為6個月)隨訪中穩(wěn)定或縮小來證實他的判斷。這一類的惡性率一般<2%。無鈣化邊界清晰的腫塊、局限性的不對稱、簇狀圓形和(或)點狀鈣化被認為良性可能大。對3類的常規(guī)處理為首先X線片短期隨訪(一般為6個月),再6個月而后常規(guī)隨訪12個月至2年以上,經過連續(xù)2~3年的穩(wěn)定可將原先的3類判讀(可能良性)定為2類判讀(良性)。
⑷BI-RADS 4:可疑異常,要考慮活檢。這一類包括了一大類需臨床干預的病變,此類病變無特征性的乳腺癌形態(tài)學改變,但有惡性的可能性。其惡性的可能性各家報道不一,從2%~50%,一般認為30%左右。可再繼續(xù)分成4A、4B、4C,臨床醫(yī)生和患者可根據(jù)其不同的惡性可能性對病變的處理做出最后決定。①4A:包括一組需活檢但惡性可能性較低的病變。對活檢或細胞學檢查為良性的結果比較可以信賴,可以常規(guī)隨訪或半年后隨訪。此類病變包括一些可捫及的、部分邊緣清楚的實體性腫塊,如超聲提示的纖維腺瘤、可捫及的復雜囊腫或可疑膿腫。②4B:中等惡性可能。對這組病變穿刺活檢結果和放射診斷結果的相關性接近一致,放射科醫(yī)生和病理科醫(yī)生達成共識很重要。部分邊界清楚、部分邊界模糊的腫塊可能是纖維腺瘤或脂肪壞死是可以接受的,但乳頭狀瘤則需要切取活檢。③4C:更進一步懷疑為惡性,但還未達到5類那樣典型的一組病變。此類中包括邊界不清、不規(guī)則形的實體性腫塊或新出現(xiàn)的微細的多形性成簇鈣化。此類病理結果往往是惡性的。
這些更細分類提請臨床醫(yī)生對診斷為BIRADS 4但活檢為良性的病例進行隨訪復查的必要性,同時要求病理科醫(yī)生對放射科診斷為4C而活檢為良性病變應做進一步的分析。
⑸BI-RADS 5:高度懷疑惡性(幾乎肯定的惡性),臨床應采取適當措施。
這一類病變有高度的惡性可能性,檢出可能性≥95%。常為形態(tài)不規(guī)則星芒狀邊緣的高密度腫塊、段樣和線樣分布的細小線樣和分支狀鈣化、不規(guī)則星芒狀腫塊伴多形性鈣化。
⑹BI-RADS 6:已活檢證實為惡性,應采取積極的治療措施。用來描述活檢已證實為惡性但還未進行治療的影像評估。主要是評價先前活檢后的影像改變,或監(jiān)測手術前新輔助化療的影像改變。根據(jù)BI-RADS的描述,BIRADS 6不適合用來對惡性病灶切除(腫塊切除術)后的隨訪。手術后可能沒有腫瘤殘留的征象,其最終的評估應該是BI-RADS 3(可能良性)或2(良性);如殘留有惡性可疑的鈣化,其最終的評估應該是BI-RADS 4(可疑惡性)或5(高度提示惡性),可建議活檢或手術干預。
注:
本規(guī)范的制定,參考了美國放射學會的乳腺影像報告和數(shù)據(jù)系統(tǒng)(Breast Imaging Reporting and Data System,BI-RADS)第4版的內容。
三 乳腺超聲檢查和報告規(guī)范(附錄Ⅲ)
1 超聲檢查的儀器
常規(guī)的檢查采用彩色多普勒超聲儀的實時線陣高頻探頭,探頭頻率為7.5~10 MHz,有條件可用到10~15 MHz。
2 超聲檢查的方法
檢查前一般無需特殊準備,有乳頭溢液者最好不要將液體擠出。根據(jù)需要患者取仰臥或側臥位,如果患者自覺特殊體位有腫塊的感覺,可以讓患者采用特殊體位進行超聲檢查,如直立或者坐位等。檢查時患側手臂盡量上抬外展,充分暴露乳房及腋下,探頭直接放在乳房表面,對乳頭、乳暈及乳房外上、外下、內上、內下4個象限進行全面掃查,次序可由操作者自行確定,尤以乳頭為中心行放射性掃查為佳。注意檢查范圍全面,不要漏檢,同時應檢查腋下淋巴結情況。
3 超聲檢查的程序
3.1 基本要求
檢查時應先對乳腺及周圍組織進行全面的常規(guī)二維超聲檢查,然后對發(fā)現(xiàn)病灶的區(qū)域進行重點的二維超聲檢查,檢查的內容包括:病灶的位置、大小或范圍的測定、邊界、邊緣、形狀、內部及后方回聲、鈣化及周圍組織包括皮膚,胸肌及韌帶等結構的變化等。病灶的大小或范圍的測量應該選取其具最長徑線的切面進行兩條互相垂直的最長徑線即第一及第二徑線的測量,然后在與此切面垂直的具有最長徑線切面上進行第三個徑線的測量。測量時,病灶邊界清晰時按照邊界測量,腫塊邊界模糊時,應該根據(jù)腫塊的最大邊緣部分或周邊的聲暈測量。在二維聲像圖的基礎上應輔助彩色及能量多普勒超聲檢查,觀察彩色血流的走向及分布并在多普勒頻譜上測量各種血流參數(shù)。儀器條件允許的話可采用三維重建成像、彈性成像、造影增強對比成像等技術輔助診斷,并測量相應的參數(shù)。
3.2 圖像的存儲
內容應該包括:患者的姓名、年齡、性別和診療記錄號碼(門診號或住院號,超聲登記號),設備名稱和檢查條件標識,體位標記包括:乳腺的方位(左或右),病灶的位置,包括距乳頭中央的距離、鐘面形式的標記、顯示病灶時的探頭切面標識。病灶圖像存儲至少應記錄2個以上有特征的不同方向切面,應盡量完整存儲記錄病灶各種超聲特點的聲像圖,如:鈣化、血流、能量圖、多普勒頻譜、彈性成像、三維重建及造影增強對比成像等,必要時可存儲動態(tài)圖像。對于超聲檢查沒有異常的乳腺,可以僅存儲各象限的放射狀切面的聲像圖以表明對患者做過全面的超聲檢查。
3.3 報告書寫
以上各項檢查結果及所測參數(shù)均應在超聲報告中加以詳細描述,最后綜合各種檢查結果得出超聲的診斷結論,包括:乳腺正常或異常的判斷,如有異常的局灶性病變應明確病灶的物理性質,對應的診斷分級(參照美國放射學會的BI-RADS),相應的處理建議(在分級中默認),并盡可能做出合理的病理性質診斷。
4 超聲診斷報告的規(guī)范
為了使超聲報告既個體化又標準化,首先對超聲報告中的描述性語言進行統(tǒng)一定義。
4.1 乳腺超聲的回聲模式
個體乳腺的超聲在聲像圖的表現(xiàn)上存在差異,因此,通常將自身腺體內脂肪組織回聲定義為等回聲,沒有回聲定義為無回聲,有回聲的與脂肪組織回聲對比,按照回聲的強弱分別定義為弱回聲、低回聲、等回聲、高回聲及強回聲。
4.2 正常的乳腺組織聲像圖表現(xiàn)
正常乳腺的聲像圖由淺入深依次為①皮膚:呈帶狀強回聲,厚2~3 mm,邊緣光滑整齊。②淺筋膜和皮下脂肪:淺筋膜呈線狀高回聲,脂肪組織呈低回聲,由條索狀高回聲分隔,邊界欠清。③乳腺腺體:因人而異,厚薄不一,老年人可萎縮僅3 mm,腺體呈中強回聲帶夾雜有低回聲,排列較整齊。腺體與皮膚間有三角形的中強回聲韌帶,稱為庫柏(Copper)韌帶,其后方回聲可衰減。④深筋膜:筋膜呈線狀高回聲,光滑整齊,筋膜間脂肪呈低回聲。⑤胸肌及肋骨:胸肌為梭形的均質低回聲區(qū),肋骨為弧形強回聲,其后方衰減為聲影。整體的乳腺超聲表現(xiàn)有均勻和不均勻2種,均勻的乳腺在聲像圖上表現(xiàn)為連續(xù)一致的脂肪、韌帶、纖維及腺體組織回聲,從乳頭、乳暈至周邊組織腺體逐漸變薄。不均勻的乳腺可以表現(xiàn)為局部性或者彌漫性的,聲像圖表現(xiàn)為腺體不規(guī)律的增厚、回聲的增強或者減弱等。
4.3 異常的乳腺組織聲像圖表現(xiàn)
乳腺的異常應從不同的切面上全面觀察以排除正常的組織及結構,如脂肪組織和肋骨等,局灶性的病變聲像圖表現(xiàn)需按照以下征象描述。
4.3.1 形狀
聲像圖上病灶的外形,分為:①規(guī)則:包括圓形、橢圓形或分葉狀等有規(guī)律可循的外形。②不規(guī)則:所有沒有規(guī)律可循的外形。
4.3.2 飽滿度
病灶最長軸和與之垂直的最長短軸的比例關系。①飽滿:所謂病灶外形飽滿或長短軸比例<2∶1甚至接近于1。②不飽滿:所謂病灶外形不飽滿或長短軸比例>2∶1。
4.3.3 邊界
病灶與周圍組織交界的部分在聲像圖上的表現(xiàn)。①清晰:病灶與周圍組織間有明確的界限,包括包膜、聲暈,定義為邊界清晰。②不清晰:病灶與周圍組織間沒有明確的界限定義為不清晰。同一病灶可部分邊界清晰,部分邊界不清晰。
4.3.4 邊緣病灶明確的邊緣部分在聲像圖上的表現(xiàn)。⑴光整:病灶的邊緣光滑整齊,可以有2~3個大的光滑波折。
⑵不光整:病灶的邊緣不光滑不整齊,分為3種模式。①小葉:病灶的邊緣有較多短小的環(huán)形波紋,呈扇貝狀。②成角:病灶的邊緣部分有尖銳的轉角,通常形成銳角,類似蟹足,故亦可稱蟹足狀。③毛刺:病灶的邊緣有銳利的放射狀線條樣表現(xiàn)。
同一病灶的邊緣可并存上述多種表現(xiàn)。
4.3.5 回聲模式
病灶的內部回聲,按照前述乳腺超聲回聲模式定義,內部回聲可以是單一的,也可以是多種回聲復合的,其分布的表現(xiàn)可以分為2種。
⑴均勻:病灶內部回聲為分布均勻的單一回聲,分為無回聲、弱回聲、低回聲、中等回聲、高回聲及強回聲。
⑵不均勻:病灶內部回聲為分布不均勻單一回聲或幾種混合的回聲。
4.3.6 后方回聲
病灶后方回聲是對比周圍同等深度的正常組織出現(xiàn)的聲像圖特征,其代表了病灶在聲學傳導方面的特性。
⑴增強:病灶后方回聲高于周圍同等深度的正常組織,表現(xiàn)為病灶后方回聲增強。
⑵不變:病灶后方回聲與周圍同等深度的正常組織相同,表現(xiàn)為病灶后方回聲無增強或無衰減。
⑶衰減:病灶后方的回聲弱于周圍同等深度的正常組織,表現(xiàn)為病灶后方為低回聲或無回聲,后者即聲影。
⑷混合:部分病灶后方回聲有不止一種的表現(xiàn),說明腫塊內部成分的不均勻性。
4.3.7 周圍組織
部分病灶對周圍組織的影響在聲像圖上的表現(xiàn)。
⑴皮膚及皮下脂肪組織層水腫增厚:局部或者彌漫的皮膚及皮下脂肪組織的增厚,回聲增強,皮下脂肪組織層內可見條帶狀的擴張淋巴管回聲。
⑵皮膚凹陷、高低不平:皮膚表面高低不平或出現(xiàn)局限性的或多處的皮膚表面凹陷。
⑶病灶周圍組織水腫:病灶周圍組織增厚,回聲增強。
⑷結構扭曲:病灶引起周圍正常解剖層次的結構的扭曲或連續(xù)性中斷,包括病灶處皮膚、淺筋膜層、腺體層、深筋膜層及胸肌層的改變。
⑸Cooper韌帶改變:韌帶牽拉或者增厚。
⑹導管:腺體內導管內徑的異常擴張或導管走向的扭曲。
4.3.8 鈣化
乳腺腺體或病灶內顯示的強回聲稱為鈣化,一般認為>0.5 mm的鈣化屬于大鈣化,大鈣化可能會伴有聲影,<0.5 mm的鈣化屬于小鈣化。乳腺組織中的孤立或散在的鈣化因為腺體內纖維結締組織的關系有時難以鑒別。鈣化的形態(tài)可呈泥沙狀、顆粒狀、短段狀或弧形等,鈣化的分布可為單一、成堆、成簇、散在或彌漫等。
4.4 彩色超聲檢查
用于檢測腺體組織及病灶內血管的檢查。病灶的血管分布是一項特征性的分析指標,通常對比對側的相同區(qū)域或者同側乳房的正常區(qū)域。彩色及能量多普勒超聲檢查會受到各種因素的影響:如血流速度較低、彩色多普勒的靈敏度設定等,探頭施壓可以使小血管特別是靜脈閉塞,因此檢查時應避免用力,囊腫內無血流(加壓會出現(xiàn)血流偽像)。良性病灶內血流一般較少,惡性病灶內部及周邊的血流可以明顯增多,且走向雜亂無序,部分病灶有由周邊穿入的特征性血流。除對血流形態(tài)學的觀察,還應對血流的各項多普勒參數(shù)進行測定,診斷意義除阻力指數(shù)(RI)外其他的參數(shù)多存在爭議,一般惡性病變的RI>0.70。
4.5 其他相關技術
可以根據(jù)檢查的需要進行選擇。
4.5.1 三維成像
乳腺病灶的三維超聲最大的作用不是對病灶的三維重建,而是對病灶冠狀面的觀察,此切面二維超聲無法觀測得到。惡性病灶在冠狀面上的最大發(fā)現(xiàn)是類似于二維圖像上病灶邊緣出現(xiàn)“結構斷裂”現(xiàn)象,表現(xiàn)類似于星星或者太陽及周邊的光芒,國內外不同學者稱為匯聚征或者太陽征。
4.5.2 彈性成像
彈性成像是針對不同組織的彈性差別進行的,一般認為惡性腫瘤中的組織大部分具較高的硬度。但是由于目前各廠家儀器的不同設定,目前彈性成像未能形成統(tǒng)一的診斷標準。
4.5.3 造影增強對比成像
造影增強對比成像在乳腺中的應用受到探頭高頻率、造影劑諧振及病灶血管生長等因素的影響,目前沒有很成熟的標準。
5 乳腺超聲評估分類
超聲對病灶特征描述的專業(yè)術語要有統(tǒng)一的規(guī)范標準。超聲描述的專業(yè)術語需要體現(xiàn)對病灶良惡性的判斷和分級的影響,且對多個特征指標進行綜合分析。隨著超聲技術的發(fā)展,相應的專業(yè)術語內涵也將會有所改變。本指南分級標準參照美國放射學會的BI-RADS并結合我國的實際情況制定了以下分級標準:
(1)評估是不完全的。
0級:需要其他影像學檢查(如乳腺X線檢查或MRI等)進一步評估。
在多數(shù)情況下,超聲檢查可對乳腺進行全面評估。當超聲作為初次檢查時,下列情況則需要進一步做其他檢查:一種情況是超聲檢查乳腺內有明顯的病灶而其超聲特征又不足以做出評價,此時必需借助乳腺X線檢查或MRI;另一種情況是臨床有陽性體征,如觸及腫塊、漿液性溢液或乳頭溢血、乳腺癌術后以及放療后疤痕需要明確是否復發(fā)等,超聲檢查無異常發(fā)現(xiàn),也必須借助乳腺X線檢查或MRI對乳腺進行評估。
(2)評估是完全的——最后分級。
1級:陰性。
臨床上無陽性體征,超聲影像未見異常,如:無腫塊、無結構扭曲、無皮膚增厚及無微鈣化等。為使陰性結論更可信,超聲檢查部位盡量與乳腺X線檢查聯(lián)合檢查所關注的乳腺組織區(qū)域對應。
2級:良性病灶。
基本上可以排除惡性病變。根據(jù)年齡及臨床表現(xiàn)可6~12個月隨診。如單純囊腫、乳腺假體、脂肪瘤、乳腺內淋巴結(也可以歸類1級)、多次復查圖像無變化的良性病灶術后改變、有記錄的經過多次檢查影像變化不大的結節(jié)可能為纖維腺瘤等。
3級:可能良性病灶。
建議短期復查(3~6個月)及其他進一步檢查。
根據(jù)乳腺X線檢查積累的臨床經驗,超聲發(fā)現(xiàn)明確的典型良性超聲特征(實性橢圓形、邊界清、不飽滿的腫塊)病灶,很大可能是乳腺纖維腺瘤,它的惡性危險性應該小于2%,如同時得到臨床、乳腺X線檢查或MRI的印證更佳。多中心研究數(shù)據(jù)證實,除了基于超聲檢查發(fā)現(xiàn)的活檢,超聲檢查短期隨訪也是安全的,短期隨訪是一種現(xiàn)在的處理策略。新發(fā)現(xiàn)的纖維腺瘤、囊性腺病、瘤樣增生結節(jié)(屬不確定類)、未捫及的多發(fā)復雜囊腫或簇狀囊腫、病理明確的乳腺炎癥、惡性病變的術后早期隨訪都可歸于該級。
4級:可疑的惡性病灶。
建議活檢。此級病灶的惡性危險性3%~94%。評估4級即建議組織病理學檢查:細針抽吸細胞學檢查、空芯針穿刺活檢、手術活檢提供細胞學或組織病理學診斷。超聲聲像圖上表現(xiàn)不完全符合良性病變或有惡性特征均歸于該級。目前可將其劃分為4A、4B及4C三類。4A級更傾向于良性可能,不能肯定的纖維腺瘤、有乳頭溢液或溢血的導管內病灶、不能明確的乳腺炎癥都可歸于該級,此級惡性符合率在3%~30%;4B級傾向于惡性,此級惡性符合率在31%~60%;4C級提示惡性可能性較高,此級惡性符合率在61%~94%。
5級:高度可能惡性,應積極采取適當?shù)脑\斷及處理。
超聲聲像圖惡性特征明顯的病灶歸于此級,其惡性危險性大于95%,應開始進行積極的治療,經皮活檢(通常是影像引導下的空芯針穿刺活檢)或手術治療。
6級:已經活檢證實為惡性。此級用于在活檢已證實為惡性,但還未進行治療的影像評上。主要是評價先前活檢后的影像改變,或監(jiān)測手術前后和新輔助化療前后的影像改變。
6 乳腺超聲報告的組成
報告用詞應當具體而簡潔,使用不加修飾的術語;各項術語的定義、闡釋性用語不需出現(xiàn)在報告中;報告內容應當盡量詳細,包含全部標準的描述;數(shù)據(jù)測量應該遵守前述規(guī)范。包括下列內容:
6.1 患者信息的記錄
包括姓名,年齡,醫(yī)療號碼等。
6.2 雙側乳腺組織正常或異常聲像圖描述
異常的聲像圖包括:小葉增生,退化不全,妊娠哺乳期改變等。
6.3 有意義的異常及病灶的聲像圖描述
6.3.1 記錄病灶一般信息
記錄病灶所在側、位置(需要一致的和可以重復的系統(tǒng)定位,諸如鐘表定位、距乳頭的皮膚距離)、大小(至少兩個徑線,大者最好3個徑線),同性質的病灶較多時可選取較大及有特征的病灶測量,沒有必要測量所有病灶。
6.3.2 病灶聲像圖的描述
應按照BI-RADS內容標準逐一進行,包括病灶的外形、邊界、邊緣、內部及后方回聲、周圍組織、病灶及周圍的鈣化、血流以及各種特殊技術所見的各項特征,盡量用術語描述,并盡量注意保持與后面的病灶診斷和分級的一致性。
6.3.3 結論
包括乳腺正常或異常,發(fā)現(xiàn)病灶的物理性質,對應的診斷分級,相應的處理建議(在分級中默認),如可能盡量做出適當?shù)呐R床病理診斷。
6.3.4 病灶存儲
病灶應當儲存兩個垂直切面以上的聲像圖,聲像圖上有完整的各種條件及位置標識。
四 常規(guī)乳腺MRI檢查和報告規(guī)范(附錄Ⅳ)
1 乳腺MRI檢查適應證
1.1 乳腺癌的診斷
當乳腺X線攝 影或超聲影像檢查不能確定病變性質時,可以考慮采用MRI進行進一步檢查。
1.2 乳腺癌的分期
由于MRI對浸潤性乳腺癌的高敏感性,有助于發(fā)現(xiàn)其它影像學檢查所不能發(fā)現(xiàn)的多灶病變和多中心病變,有助于 顯示和評價癌腫對胸肌筋膜、 胸大肌、 前鋸肌以及肋間肌的浸潤等。在制定外科手術 計劃之前,特別是當考慮保乳治療時建議進行乳腺增強MRI檢查。
1.3 新輔助化療療效的評估
對于確診乳腺癌進行新輔助化療的患者,在化療前、化療中及化療結束時MRI檢查有助于對病變化療反應性的評估,對化療后殘余病變的范圍的判斷。
1.4 腋窩淋巴結轉移,原發(fā)灶不明者
對于腋窩轉移性淋巴結,而臨床檢查、X線攝影及超聲都未能明確原發(fā)灶時,MRI有助于發(fā)現(xiàn)乳房內隱匿的癌灶,確定位置和范圍,以便進一步治療,MRI陰性檢查 結果可以幫助排除乳房內原發(fā)灶,避免不必要的全乳切除。
1.5 保乳術后復發(fā)的監(jiān)測
對于乳癌保乳手術(包括組織成型術)后,臨床檢查、乳腺X線攝影或超聲檢查不能確定是否有復發(fā)的患者, MRI有助于鑒別腫瘤復發(fā)和術后瘢痕。
1.6 乳房成型術后隨訪
對于乳房假體植入術后乳腺X線攝影評估困難者,MRI有助于乳癌的診斷和植入假體完整性的評價。
1.7 高危人群篩查
最近的臨床試驗表明,MRI在易發(fā)生乳腺癌的高危人群中能發(fā)現(xiàn)臨床、乳腺X線攝影、超聲檢查陰性的乳腺癌。
1.8 MRI引導下的穿刺活檢
2 乳腺MRI檢查的禁忌證
⑴妊娠期婦女。
⑵體內裝置有起搏器、外科金屬夾子等鐵磁性物質以及其他不得接近強磁場者。
⑶患有幽閉恐懼癥者。
⑷具有對任何釓螯合物過敏史的患者。
3 乳腺MRI檢查技術規(guī)范
3.1 檢查前準備
3.1.1 臨床病史
了解患者發(fā)病情況、癥狀和體 征、家族史、高危因素、乳腺良性病變史及手術史,詢問患者有無前片及其他相關檢查(包括乳腺X線攝影,B超)。
3.1.2 檢查前做好乳腺MRI檢查注意事項的解釋和安撫患者的工作
最佳檢查時間:由于正常乳腺組織增強在月經周期的分泌期最為顯著,因而推薦MRI檢查盡量安排在月經周期的7~14 d進行。
3.2 MRI檢查
3.2.1 設備 要求
推薦采用高場1.5T及以上的掃描機進行乳腺 MRI 檢查,以獲得較好的信噪比和脂肪抑制效果。采用專用的乳腺線圈,設備條件許可的情況下,推薦采用相控陣線圈及并行采集技術,有利于雙乳同時成像獲得較好的時間和空間 分辨率。同時推薦采用開放式線圈,利于在側方進行MRI引導的介入操作。
3.2.2 掃描體位
俯臥位,雙側乳房自然懸垂于乳腺線圈中央。
3.2.3 成像序列
一般包括橫斷位、矢狀位、冠狀位定位掃描,T1WI序列、T2WI(加抑脂序列)、增強掃描序列[包括橫斷位掃描(至少連續(xù)掃描3次)和矢狀位的掃描]。成像參數(shù):掃描層厚應≤3 mm,層面內的分辨率應<1.5 mm,單次掃描時間不應當超過2 min。增強掃描要求Gd-DTPA應當團注,標準劑量為0.1~0.2 mmol/kg,于10 s內快速團注,繼而快速推注10 mL 0.9%氯化鈉注射液沖洗。
3.2.4 繪制時間-信號強度增強曲線
注射造影劑,分別于注藥前、注藥后進行連續(xù)6~9次采集。將采集圖像傳送至工作站對病灶進行分析,將病灶最可疑的區(qū)域選為感興趣區(qū)(ROI)(應避開肉眼可見的出血、液化、壞死及囊變區(qū)),并在對側正常乳腺組織內選取相同大小的ROI作為對照,繪制病灶的時間-信號強度增強曲線。時間-信號強度增強曲線分為3種類型:①“流入型曲線”指注射對比劑后病灶早期緩慢強化,延遲期亦隨著時間的延長而繼續(xù)增強。②“平臺型曲線”是指注射對比劑后病灶早期緩慢強化,大約2~3 min后信號強度達到最高值,隨時間的延長曲線不再上升,而是一直保持該水平。③“廓清型曲線”指注射對比劑后病灶早期明顯強化,在2~3 min達到增強最高峰后信號強度迅速下降。
4 診斷報告規(guī)范
參照BI-RADS標準,描述病灶形態(tài)特征和動態(tài)增強曲線特征。對強化病灶性質的分析以形態(tài)分析為首要的判斷依據(jù),對于形態(tài)特征判斷困難者,需要結合時間-信號強度增強曲線進行判斷。形態(tài)特征包括增強前T1WI和T2WI上的信號表現(xiàn)以及增強后的表現(xiàn)。所有圖像征象的描述和分析更多依賴對增強圖像的分析,根據(jù)增強后形態(tài)不同將病灶定義為點、腫塊和非腫塊樣強化3類。
4.1 點
一般來說點狀強化病灶<5 mm,不具有明顯的占位效應,難以對其形狀及邊緣加以描述。可以多發(fā),但不聚集成簇。點狀病灶往往是由腺體局限性增生所引起,也可以是乳頭狀瘤、纖維腺瘤、乳內淋巴結,也可能是微浸潤癌、DCIS等惡性病變。形態(tài)可疑者建議活檢,否則予以隨訪。
4.2 腫塊
具有三維空間的占位性病變,伴或不伴周圍正常組織移位或浸潤。從形態(tài)(圓形、卵圓形、分葉狀和不規(guī)則)、邊緣(光整、不規(guī)則和星芒狀)、內部強化情況(均勻、不均勻、邊緣或環(huán)形強化、分隔、中央強化)3方面來描述。
4.3 非腫塊樣強化
當乳腺內出現(xiàn)既非點狀亦非腫塊的強化時,即為非腫塊樣強化,一般無占位效應。對其分類主要依據(jù)其形態(tài)特征(線狀、導管狀、局灶性、段樣、區(qū)域性、彌散性),內部強化特征(均勻、不均勻、點簇狀、網(wǎng)狀/樹突狀、卵石樣和簇狀小環(huán)形強化等)以及病灶是否雙側對稱,雙側是否對稱對定性診斷有一定的價值。
4.3.1 形態(tài)特征
⑴導管樣強化:為指向乳頭的線樣強化,可呈現(xiàn)出分支樣改變,后者需要活檢,常為惡性特征。
⑵線樣強化:與導管樣強化相似,但不指向乳頭,3維圖像顯示此強化為層狀而非條狀。
⑶段樣強化:呈三角形,三角形的尖指向乳頭,符合導管系統(tǒng)走向。
⑷局灶性強化:指強化灶的范圍小于單個乳房象限的25%,可有正常的乳腺或脂肪組織鑲嵌期間,如為多個則在各強化灶之間有正常的乳腺組織將其分開。
⑸區(qū)域性強化:指較大范圍內的強化,不符合單一的導管系統(tǒng),可能在多導管系統(tǒng)內,且不能用其他征象來描述。多區(qū)域強化指2個及2個以上的區(qū)域強化,多發(fā)散在。
⑹彌漫性強化:整個乳腺內彌漫分布的散在強化。
4.3.2 內部強化特征
⑴均勻強化:均一性的強化。
⑵不均勻強化:非均一性的強化,信號強度多樣化,但又不屬于以下幾種類型。
⑶點簇狀強化:成簇分布的點狀強化灶,大小較一致。
⑷卵石樣強化:一般較點簇狀要大,大小不均一為其特點,形態(tài)類似一串葡萄或珍珠。
⑸網(wǎng)狀/樹突狀:呈網(wǎng)格樣強化。
⑹簇狀小環(huán)形強化:呈簇狀分布的小環(huán)形強化。
4.4 伴隨征象
乳頭收縮;平掃T1WI導管高信號;皮膚收縮、增厚或受侵;小梁增厚、水腫;淋巴結腫大;異常強化累及胸肌或胸壁,肋骨或肋間隙;出血;異常信號,囊腫等。伴隨征象可與其它異常征象一同出現(xiàn),亦可單獨出現(xiàn)。發(fā)現(xiàn)伴隨征象的意義在于:當與其它異常征象一起出現(xiàn)時,可提高乳腺癌的診斷;當確診為乳腺癌時,某些伴隨征象的出現(xiàn)將有助于術前分期以及手術方式的選擇。
4.5 病灶定位
⑴病變位于哪一側乳腺。
⑵定位:外上、外下、內上和內下4個象限,或者面向觀察者的鐘面定位,乳暈后方,中央?yún)^(qū)或腋尾。
⑶病變的深度:與乳頭、皮膚或胸壁的距離。
5 乳腺MRI報告的組成
乳腺的MRI報告應包括病史、與既往檢查片對比、掃描技術、乳房的腺體構成和背景強化、任何相關的影像發(fā)現(xiàn),最后是評估類別和建議。報告措辭應當簡潔,使用術語詞典里的標準詞匯。書寫診斷報告應當結合乳腺X線檢查和超聲檢查結果。MRI診斷報告應當注重與X線和超聲檢查結果相參照,特別是對MRI陽性發(fā)現(xiàn)與觸診、X線和超聲檢查的陽性發(fā)現(xiàn)在空間位置的對應關系是否一致性的評估,對非一致的病灶尤其需要強調,以引起臨床醫(yī)生的關注。注重背景強化對MRI檢出敏感性的影響。與BI-RADS乳腺X線對腺體密度的描述相似,BI-RADS MRI對背景強化程度進行了分類,并建議在報告中進行描述,提示MRI檢查的敏感性。與乳腺X線檢查一樣,BI-RADS MRI對病變的磁共振評價分為0~6類。
⑴評估不完全。
BI-RADS 0:需要進一步影像評估。
建議進一步影像學評估:例如使用合適的掃描技術再做一次MRI檢查,結合乳腺X線和B超征象,或與乳腺既往病史相結合。
⑵評估是完全的。
BI-RADS 1: 陰性。建議常規(guī)隨訪。
BI-RADS 2:良性病變。例如:無強化的纖維腺瘤,囊腫,無強化的陳舊性疤痕,乳腺假體,含脂肪的病變如油性囊腫、脂肪瘤、積液囊腫以及錯構瘤等,無惡性征象。
BI-RADS 3:可能是良性病變,建議短期隨訪。良性可能性比較大,但需要通過隨訪確認其穩(wěn)定性。較可疑者可3個月后隨訪,一般是半年。
BI-RADS 4:可疑惡性,要考慮活檢。不具有乳腺癌的典型表現(xiàn),但不能排除乳腺癌的可能性,需建議臨床醫(yī)生做穿刺活檢。
BI-RADS 5:高度懷疑惡性,應進行臨床干預(幾乎肯定的惡性)。這一類病變有高度的惡性可能性。
BI-RADS 6:已活檢證實為惡性,MRI檢查作進一步評估。
注:
本規(guī)范的制定,參考了美國放射學會的乳腺影像報告和數(shù)據(jù)系統(tǒng)(Breast Imaging Reporting And Data System,BI-RADS)第4版的內容。
五 影像引導下的乳腺組織學活檢指南
影像學引導下乳腺組織學活檢指在乳腺X線、超聲和核磁共振檢查(MRI)影像引導下進行乳腺組織病理學檢查(簡稱活檢),特別適合未捫及乳腺病灶(如腫塊、鈣化灶、結構扭曲等)。具體包括影像引導下空芯針穿刺活檢(CNB)、真空輔助活檢(VAB)和鋼絲定位手術活檢等。
1 適應證
1.1 乳腺超聲影像引導下乳腺活檢
⑴乳腺超聲發(fā)現(xiàn)未捫及的可疑乳腺占位性病變,BI-RADS≥4級;部分3級病灶,如果患者要求或臨床其他考慮,也可考慮活檢。
⑵可捫及乳腺腫塊,且超聲提示相應部位有乳腺內占位性病變,需要行微創(chuàng)活檢或微創(chuàng)切除以明確診斷的。
1.2 乳腺X線影像引導下乳腺活檢
⑴乳腺未捫及腫塊,而乳腺X線檢查發(fā)現(xiàn)可疑微小鈣化病灶,BI-RADS≥4級。
⑵乳腺未捫及腫塊,而乳腺X線發(fā)現(xiàn)其他類型的BI-RADS≥4級的病灶(如腫塊、結構扭曲等),并且超聲下無法準確定位。
⑶部分3級病灶,如果患者要求或臨床其他考慮,也可考慮活檢。
⑷乳房體檢捫及腫塊,而乳腺X線提示相應位置有占位性病變,需要行微創(chuàng)活檢或微創(chuàng)切除以明確診斷。
1.3 其他
對有條件的單位積極提倡在手術前進行影像引導下的微創(chuàng)活檢(CNB或VAB),如不具備條件可考慮直接行影像引導下鋼絲定位手術活檢。
2 對影像引導乳腺活檢設備的需求
2.1 乳腺X線影像引導
乳腺X線立體定位床,或配備定位活檢裝置的乳腺X線機。
2.2 乳腺超聲影像引導
高頻乳腺超聲探頭:頻率7~15 Hz。
2.3 用于手術活檢的定位導絲
單鉤或雙鉤鋼質導絲(推薦規(guī)格20~22 G)。
2.4 微創(chuàng)活檢設備
空芯針彈射式活檢槍(推薦規(guī)格14 G),真空輔助乳腺定向活檢系統(tǒng)(推薦規(guī)格8~11 G)
3 影像引導下鋼絲定位手術活檢
3.1 禁忌證
有重度全身性疾病及嚴重出血性疾病者。
3.2 術前準備
⑴簽署知情同意書。
⑵核對和確認影像資料,用記號筆在乳腺X線片或者乳房上勾畫出病灶大致部位。⑶檢查影像定位設備,確保精度和準度。⑷術前血化驗指標:血常規(guī)和凝血功能。
3.3 術中注意事項
⑴手術操作在影像引導下放置定位鋼絲至病灶部位。
⑵攝片或錄像記錄影像定位下病灶和穿刺針的位置,留檔。
⑶定位鋼絲插入點與手術切口盡量接近,但沒有必要一定在手術切口內。
⑷術中切除以定位鋼絲頂端為中心至少2 cm半徑范圍內的乳腺組織。
⑸微小鈣化灶的活檢標本應當立即攝片,待手術者確認取到病灶后,并將標本片和標本一起送病理檢查。
4 影像引導下的乳腺微創(chuàng)活檢
4.1 禁忌證
有重度全身性疾病,有嚴重出血性疾病者。
4.2 術前準備
⑴簽署知情同意書。
⑵核對和確認影像資料,乳腺X線和乳腺超聲再次定位,并做相應標記。
⑶檢查影像引導設備和微創(chuàng)活檢設備(活檢槍、真空輔助乳腺定向活檢系統(tǒng)等),確保精度和準度。
⑷術前血化驗指標:血常規(guī)和凝血功能。
4.3 術中注意事項
(1)選擇切口,采用就近原則。
(2)攝片或錄像記錄影像定位下病灶和穿刺針的位置,留檔。
(3)取材足量,保證病理診斷。
(4)活檢結束后壓迫手術部位5~15 min。
4.4 術后乳房和標本的處理
⑴術后應加壓包扎至少24 h。
⑵微小鈣化灶的活檢標本應當立即行乳腺X線攝片以確認是否取到病灶。
⑶將含有鈣化的標本條與不含鈣化的標本條分裝不同的容器內,用4%甲醛固定,送檢。
六 乳腺癌術后病理診斷報告規(guī)范(附錄Ⅴ)
1 乳腺癌術后病理診斷報告的基本原則
⑴病理診斷報告應盡可能包括與患者治療和預后相關的所有內容,如腫瘤大小(大體或鏡下必須有一個腫瘤大小或范圍的測量值)、組織學類型、組織學分級、有無并存的導管原位癌、有無脈管侵犯、切緣和淋巴結情況等。還應包括ER、PR、Her-2的情況。
⑵與患者治療和預后相關的組織病理學類型應準確判斷并規(guī)范報告,如黏液癌、小管癌、浸潤性微乳頭狀癌等。
⑶導管原位癌的病理診斷報告應報告核級別(低、中或高級別)和有無壞死(粉刺或點狀壞死)、微小鈣化部位(僅導管原位癌內,僅正常/良性組織內或二者均有)以及手術切緣情況。應注意報告取了多少個組織塊,是否發(fā)現(xiàn)微浸潤等。
⑷保乳標本的取材和報告請參照保留乳房治療臨床指南部分。
⑸若報告癌旁良性病變,應注意按發(fā)生乳腺癌風險的不同,明確報告病變名稱或類型。
2 病理診斷報告書的內容和規(guī)范
2.1 一般項目
⑴病理號(檢索號)。
⑵患者姓名、出生年月(年齡)、性別、床位號、住院號。
⑶手術日期、病理取材日期。
2.2 手術標本情況
⑴左右側。
⑵手術或標本名稱(例如:改良根治術、乳腺局部廣切加腋窩淋巴結清掃術、新輔助化療后改良根治術標本)。
⑶標本肉眼所見(一定要描述腫瘤大小或范圍)。
3 病理形態(tài)學診斷內容
3.1 原發(fā)灶
3.1.1 組織學類型
包括腫瘤主體的組織學類型和瘤周乳腺組織病變的組織學類型,建議采用2003 版WHO乳腺和女性生殖器官腫瘤的病理學分類。
3.1.2 組織學分級
根據(jù)是否有腺管形成、細胞核的形態(tài)及核分裂像3項指標進行分級, 建議采用改良的Scarff-Bloom-Richardson分級系統(tǒng)。
3.1.3 腫瘤大小
若鏡下可測量腫瘤最大徑時,單位使用毫米(mm)(如腫瘤可以用一個石蠟塊全部包埋,鏡下測量是最佳選擇;如果腫瘤需要多個石蠟塊才能包埋,標本的大體測量更為準確)。具體可參照第7版AJCC乳腺癌分期(2010)。
3.1.4 腫瘤累及范圍及手術切緣
包括乳頭、乳暈、皮膚、四周和基底切緣、脈管。
3.2 淋巴結狀態(tài)
3.2.1 區(qū)域淋巴結
應報告各群腋窩淋巴結及內乳淋巴結檢出總數(shù)和轉移數(shù)。
3.2.2 前哨淋巴結活檢
應報告淋巴結內病灶大小,嚴格測量腫瘤大小,確定是否有孤立腫瘤細胞(ITC)、微轉移、宏轉移,需注意僅含有ITC的淋巴結不計入陽性淋巴結數(shù)目中,而應計為pN0(i+) 。
4 免疫組織化學檢測內容
4.1 常規(guī)檢測乳腺癌原發(fā)灶的激素受體
ER、PR檢測結果建議參考ASCO/CAP指南(2010),建議免疫組化染色結果穩(wěn)定的單位可報告強度和陽性百分比。因目前免疫組化強度和百分率計數(shù)差異性和主觀性較大,建議也可只報陽性細胞百分比,且陽性百分比可取整到每10%為1個等級,<10%的可盡量細化。
4.2 常規(guī)采用免疫組化檢測乳腺癌原發(fā)灶Her-2狀態(tài)
檢測結果使用0、1+、2+及3+。免疫組化Her-2(2+)時應行Her-2 FISH檢測。結果判讀及報告形式參考乳腺癌Her-2檢測指南(2009版)。
建議檢測Ki67,參照ER、PR報告結果,可不報強度。
病理科醫(yī)師簽名、報告日期。
七 浸潤性乳腺癌保乳治療臨床指南
1 浸潤性乳腺癌保乳治療的外科技術
1.1 開展保乳治療的必要條件
⑴開展保乳治療的醫(yī)療單位應該具備相關的技術和設備條件以及外科、病理科、影像診斷科、放療科和內科的密切協(xié)作(上述各科也可以分布在不同的醫(yī)療單位)。
⑵患者在充分了解乳腺切除治療與保乳治療的特點和區(qū)別之后,本人具有明確的保乳意愿。
⑶患者客觀上有條件接受保乳手術后的放療以及相關的影像學隨訪,如乳腺X線、B超或MRI檢查等(必須充分考慮患者的經濟條件、居住地的就醫(yī)條件及全身健康狀況等)。
1.2 保乳治療的適宜人群
1.2.1 臨床Ⅰ期、Ⅱ期的早期乳腺癌
尤其適合腫瘤最大直徑不超過3 cm,且乳房有適當體積,術后能夠保持良好乳房外形的早期乳腺癌患者。
1.2.2 Ⅲ期患者(炎性乳腺癌除外)
經術前化療降期后也可以慎重考慮。
1.3 保乳治療的絕對禁忌證
⑴同側乳房既往接受過乳腺或胸壁放療者。
⑵病變廣泛或確認為多中心病灶,難以達到切緣陰性或理想外形。
⑶腫瘤經局部廣泛切除后切緣陽性,再次切除后仍不能保證病理切緣陰性者。⑷患者拒絕行保留乳房手術。⑸炎性乳腺癌。
1.4 保乳治療的相對禁忌證
⑴活動性結締組織病,尤其硬皮病和系統(tǒng)性紅斑狼瘡或膠原血管疾病者, 對放療耐受性差。
⑵腫瘤直徑大于5 cm者。
⑶腫瘤位于乳房中央?yún)^(qū),乳頭Paget’s病。
1.5 保乳治療前的談話
⑴經大樣本臨床試驗證實(超過1萬名患者),早期乳腺癌患者接受保留乳房治療和全乳切除治療后生存率以及發(fā)生遠處轉移的概率相似。
⑵保留乳房治療包括腫瘤的局部廣泛切除加腋窩淋巴結清掃或前哨淋巴結活檢。術后行全乳放療,還需要配合必要的全身治療,例如化療和(或)內分泌治療。
⑶術后全身性輔助治療基本上與乳房切除術相同,但因需配合全乳放療,可能需要增加相關治療的費用和時間。
⑷同樣病期的乳腺癌,保留乳房治療和乳房切除治療后均有一定的局部復發(fā)率,前者5年局部復發(fā)率約2%~3%(含第二原發(fā)乳腺癌),后者約1%。保乳治療患者一旦出現(xiàn)患側乳房復發(fā)仍可接受補充全乳切除術,并仍可獲得很好的療效。
⑸保留乳房治療可能會影響原乳房的外形,影響程度因腫塊的大小和位置而異。
⑹雖然術前已選擇保乳手術,但醫(yī)生手術時有可能根據(jù)具體情況更改為全乳切除術。
⑺≤35歲的年輕患者有相對高的復發(fā)和再發(fā)乳腺癌風險。
1.6 保乳手術
1.6.1 術前準備
⑴乳房的影像學評估:雙側乳腺X線、乳房超聲(有條件者可做患側乳房MRI檢查)。
⑵簽署知情同意書。
⑶有條件者應爭取術前空芯針活檢確診,有利于與患者討論術式的選擇及手術切除的范圍。沒有確診時,患者可能心存僥幸,不能正確、嚴肅的考慮保乳和前哨的優(yōu)缺點。容易在術后表現(xiàn)出對手術方式和復發(fā)風險的不信任。
⑷體檢不能觸及病灶者應在手術前行X線或超聲下病灶定位。
⑸麻醉宜采用全麻或硬膜外麻醉。
⑹其余術前準備同乳腺腫瘤常規(guī)手術。
1.6.2 手術過程
⑴推薦切口:一般建議乳房和腋窩各取一切口,若腫瘤位于乳腺尾部,可采用一個切口。切口方向與大小可根據(jù)腫瘤部位及保證術后美容效果來選擇弧形或放射狀切口。腫瘤表面表皮可不切除或僅切除小片。
⑵乳房原發(fā)灶切除范圍應包括腫瘤、腫瘤周圍1~2 cm的乳腺組織以及腫瘤深部的胸大肌筋膜。活檢穿刺針道、活檢殘腔以及活檢切口皮膚疤痕應包括在切除范圍內。
⑶對乳房原發(fā)灶手術切除的標本進行上、下、內、外、表面及基底等方向的標記。鈣化灶活檢時,應對術中切除標本行鉬靶攝片,以明確病灶是否被完全切除及病灶和各切緣的位置關系。
⑷對標本切緣進行術中快速冰凍切片檢查或印片細胞學檢查,術后需要石蠟病理切片核實。
⑸乳房手術殘腔止血、清洗,放置4~6枚惰性金屬夾(例如鈦夾)作為放療瘤床加量照射的定位標記。逐層縫合皮下組織和皮膚。
⑹腋窩淋巴結清掃(或前哨淋巴結活檢,根據(jù)活檢結果決定是否進行腋窩淋巴結清掃術)。
⑺若術中或術后病理報告切緣陽性,則需擴大局部切除范圍以達到切緣陰性。雖然對再切除的次數(shù)沒有嚴格限制,但當再次擴大切除已經達不到美容效果的要求或再次切除切緣仍為陽性時建議改行全乳切除。
1.6.3 術后病理檢查
⑴病灶切緣的檢查和鏡下切緣距離測量。
⑵其他同常規(guī)病理檢查。
2 保乳標本的病理取材規(guī)范
2.1 病理報告中對保乳標本的評價
病理報告中對保乳標本的評價包括大體檢查中腫瘤距6個手術切面(前、后、上、下、內、外側)的距離、顯微鏡檢查中各切緣距腫瘤的距離、以及距切緣最近處腫瘤的類型(原位癌或浸潤性癌)。
2.2 保乳標本切緣取材
保乳標本切緣取材主要有兩種方法:垂直切緣放射狀取材(radial sections perpendicular to the margin)和切緣離斷取材(shave sections of the margin)。
⑴垂直切緣放射狀取材(圖1):根據(jù)手術醫(yī)生對保乳標本做出的方位標記,垂直于基底將標本平行切成多個薄片(間隔5 mm),觀察每個切面的情況。描述腫瘤大小、所在位置及腫瘤距各切緣的距離,取材時將大體離腫瘤較近處的切緣與腫瘤一起全部取材,大體離腫瘤較遠處的切緣抽樣取材,鏡下觀察時準確測量切緣與腫瘤的距離。該方法的優(yōu)點是能正確測量病變與切緣的距離。
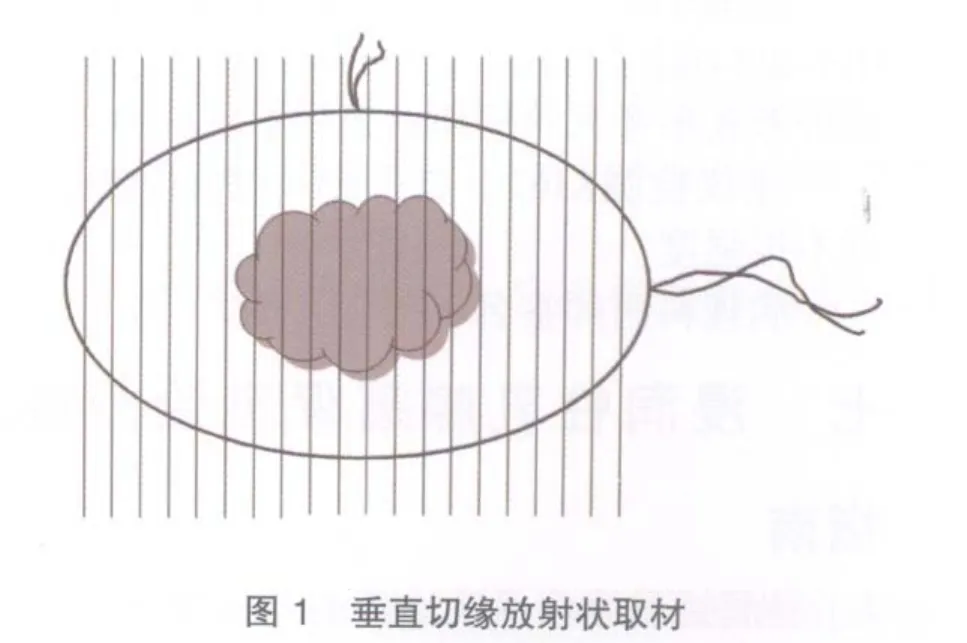
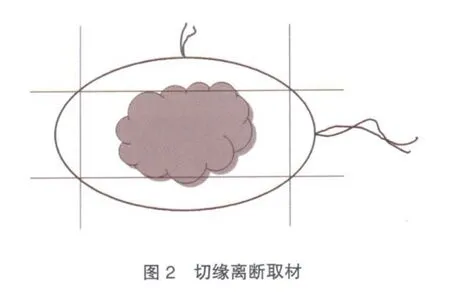
⑵切緣離斷取材:是指將6處切緣組織離斷,離斷的切緣組織充分取材,鏡下觀察切緣的累及、侵犯情況。該方法的優(yōu)點是能對大部分的切緣進行鏡下觀察,缺點是有時不能準確測量病變與切緣的距離(圖2)。
無論采取何種取材方法,建議在取材前將6處標本切緣涂上不同顏色的染料加以區(qū)分,以便在鏡下觀察時能根據(jù)不同顏色對切緣作出準確的定位,并正確測量腫瘤和切緣的距離。
3 乳腺癌保乳術后的放療
3.1 全乳放療
3.1.1 適應證
保乳術后的全乳放療可以將早期乳腺癌保乳手術后的10年局部復發(fā)率從29.2%降低至10%,所以原則上所有保乳手術后的患者都具有術后放療適應證。其中70歲以上,Ⅰ期激素受體陽性的患者鑒于絕對復發(fā)率低,全乳放療后乳房水腫,疼痛等不良反應消退緩慢,可以考慮選擇單純內分泌治療。
3.1.2 與全身治療的時序配合
無輔助化療指證的患者術后放療建議在術后8周內進行。由于術后早期術腔體積存在動態(tài)變化,尤其是含有術腔血清腫的患者,所以不推薦術后4周內開始放療。接受輔助化療的患者應在末次化療后2~4周內開始。內分泌治療與放療的時序配合目前沒有一致意見,可以同期或放療后開展。曲妥珠單抗治療患者只要放療前心功能正常可以與放療同時使用,但一方面這些患者不宜照射內乳區(qū),另一方面,左側患者盡可能采用三維治療技術,降低心臟照射體積,評估心臟照射平均劑量應低于8 Gy。
3.1.3 照射靶區(qū)
①腋窩淋巴結清掃或前哨淋巴結活檢陰性的患者,亦或腋窩淋巴結轉移1~3個但腋窩淋巴結清掃徹底(腋窩淋巴結檢出數(shù)≥10個),且不含有其他復發(fā)的高危因素的患者,照射靶區(qū)只需包括患側乳腺;②腋窩淋巴結轉移≥ 4個,或腋窩淋巴結轉移1~3個但含有其他高危復發(fā)因素,如年齡≤40歲、激素受體陰性、淋巴結清掃不徹底或轉移比例大于20%,Her-2/neu過表達等的患者照射靶區(qū)需包括患側乳腺,鎖骨上、下淋巴引流區(qū)。③腋窩未作解剖或前哨淋巴結宏轉移而未做腋窩淋巴結清掃者,可根據(jù)各項預后因素綜合判斷腋窩淋巴結轉移概率,決定在全乳照射基礎上決定是否需要進行腋窩和鎖骨上、下區(qū)域的照射。3.1.4 照射技術
①常規(guī)放療技術:X線模擬機下直接設野,基本射野為乳房內切野和外切野。內界和外界需要各超過腺體1 cm,上界一般在鎖骨頭下緣,或者與鎖骨上野銜接,下界在乳房皺褶下1~2 cm。一般后界包括不超過2.5 cm的肺組織,前界皮膚開放,留出1.5~2 cm的空隙防止在照射過程中乳腺腫脹超過射野邊界。同時各個邊界需要根據(jù)病灶具體部位進行調整,以保證瘤床處劑量充分。②射線和劑量分割:原則上采用直線加速器6 MV X線,個別身材較大的患者可以考慮選用8~10 MV X線以避免在內外切線野入射出形成高劑量,但不宜使用更高能量的X線,因為皮膚劑量隨著X線能量增高而降低。全乳照射劑量(45~50)Gy,(1.8~2)Gy/次,5次/周。在無淋巴引流區(qū)照射的情況下也可考慮“大分割”方案治療,即2.66 Gy×16次,總劑量42.6 Gy,或其他等效生物劑量的分割方式。對于正常組織包括心臟和肺照射體積大或靶區(qū)內劑量分布梯度偏大的患者,不推薦采用大分割治療。③瘤床加量:大部分保乳術后患者在全乳照射基礎上均可通過瘤床加量進一步提高局部控制率。在模擬機下包括術腔金屬夾或手術疤痕周圍外放2~3 cm,選用合適能量的電子線,在瘤床基底深度超過4 cm時建議選擇X線小切線野以保證充分的劑量覆蓋瘤床并避免高能電子線造成皮膚劑量過高。劑量為(10~16)Gy/(1~1.5)周/(5~8)次。④三維適形和調強照射技術: CT定位和三維治療計劃設計適形照射可以顯著提高靶區(qū)劑量均勻性和減少正常組織不必要的照射,尤其當治療涉及左側患者需要盡可能降低心臟的照射劑量,存在射野的銜接,以及胸部解剖特殊的患者常規(guī)設野無法達到滿意的正常組織安全劑量時,三維治療計劃上優(yōu)化尤其體現(xiàn)出優(yōu)勢,是目前推薦的治療技術。其中全乳靶區(qū)勾畫要求如下:上界為觸診乳腺組織上界上5 mm,下界為乳腺皺褶下1 mm,內界一般位于同側胸骨旁,參照臨床標記點,外界位于觸診乳腺組織外界下5 mm。前界為皮膚下方5 mm,包括脂肪組織,后界為肋骨前方。可以采用楔形濾片技術,正向或逆向調強技術進行劑量優(yōu)化,其中逆向調強技術對各方面技術要求均較高,需要在條件成熟的單位內開展。
3.2 部分乳腺短程照射(accelerated partial breast irradiation,APBI)
3.2.1 適應證
關于APBI的初步研究顯示,對于某些早期乳腺癌患者,保乳術后APBI可能獲得與標準的全乳放療相當?shù)木植靠刂坡剩瑫r具有大幅度降低療程,減少正常組織照射體積-劑量的優(yōu)勢,但隨訪和前瞻性研究尚在進行中。可能通過APBI治療獲得和全乳照射相似的局部控制率的患者應該是屬于低復發(fā)風險的亞群,如根據(jù)北美腫瘤放射治療學會(American Society of Radiation Oncology, ASTRO)的共識,嚴格符合“低危”標準的患者必須同時具備下列條件:年齡≥60歲,T1N0的單灶腫塊,未接受新輔助治療,切緣陰性,無脈管受侵,無廣泛導管內癌成分,激素受體陽性的浸潤性導管癌或其他預后良好的浸潤性癌。雖然不同的共識對真正“低危”的定義不完全一致,但目前尚不推薦在臨床試驗以外將APBI作為常規(guī)治療。
3.2.2 技術選擇
無論何種技術,APBI的核心都包括原腫瘤床及周圍一定范圍的正常乳腺作為臨床腫瘤靶區(qū)(clinical target volume,CTV),而不是傳統(tǒng)的全乳。技術上可行性最高的是三維適形外照射,可以參照RTOG0413的劑量進行分割:38.5 Gy/10次,每天2次,間隔>6 h。其他技術包括插植和水囊導管(mammosite)的近距離治療、術中放療等。
八 乳腺癌前哨淋巴結活檢臨床指南
循證醫(yī)學Ⅰ級證據(jù)證實乳腺癌前哨淋巴結活檢(sentinel lymph node biopsy,SLNB)是一項腋窩準確分期的微創(chuàng)活檢技術:SLNB可準確確定腋淋巴結狀況,其替代腋淋巴結清掃術(axillary lymph node dissection, ALND)可使患者并發(fā)癥顯著降低,前哨淋巴結(sentinel lymph node,SLN)陰性患者SLNB替代ALND腋窩復發(fā)率低,SLN陰性患者可以免除ALND或腋窩放療。
乳腺癌SLNB的流程包括適應證的選擇、示蹤劑的注射和術前淋巴顯像、術中SLN的檢出、SLN的術中和術后病理、細胞學和分子生物學診斷、SLN陽性患者的腋窩處理及SLN陰性替代ALND患者的術后隨訪等。
1 開展SLNB的必要條件
1.1 多學科協(xié)作
SLNB需要外科、影像科、核醫(yī)學科、病理科的多學科的團隊協(xié)作,開展SLNB的醫(yī)療單位應該盡量具備相關的技術和設備條件,上述科室應密切協(xié)作。
1.2 學習曲線
完整的學習曲線對于提高SLNB成功率、降低SLNB假陰性率非常重要,開展SLNB替代ALND的醫(yī)療單位必須通過資料收集和結果分析以確保整個團隊熟練掌握SLNB技術。中國醫(yī)生乳腺癌SLNB學習曲線的研究正在進行中(CBCSG001b),目前,建議在采用SLNB替代ALND前,應完成40例以上SLNB后直接行ALND,使SLNB的成功率達到90%,假陰性率低于10%。
1.3 知情同意
患者在充分了解SLNB較高的成功率和較低的假陰性率及相關的復發(fā)風險之后,自愿接受SLNB替代ALND。
2 SLNB指征
SLNB是早期浸潤性乳腺癌的標準治療手段,具體適應證見表1。隨著乳腺癌SLNB研究的不斷深入,越來越多的相對禁忌證已逐漸轉化為適應證,2009年St.Gallen專家共識會支持除炎性乳腺癌以外的所有臨床腋淋巴結陰性乳腺癌作為SLNB的適應證。
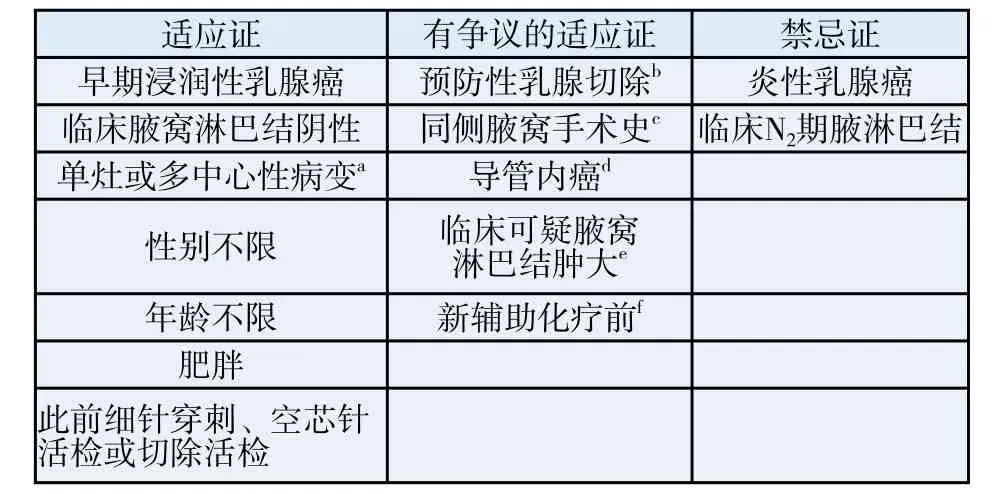
表 1 SLNB指征
3 SLNB操作規(guī)范
3.1 示蹤劑
乳腺癌SLNB的示蹤劑包括藍染料和核素標記物,推薦首選聯(lián)合使用藍染料和核素示蹤劑,可以使SLNB的成功率提高、假陰性率降低。經過嚴格的學習曲線和熟練操作后,可以單用藍染料或核素示蹤劑。
⑴藍染料:國外較多使用專利藍和異硫藍,國內較多使用亞甲藍,上述藍染料示蹤劑具有相似的成功率和假陰性率。
⑵核素示蹤劑:推薦使用的是99mTc標記的硫膠體,要求煮沸5~10 min,標記率>90%,標記核素強度0.5~1.0 mCi/0.5~2.0 mL。是否采用220 nm濾網(wǎng)過濾標記的硫膠體并不影響SLNB的成功率和假陰性率。核素示蹤劑對患者及醫(yī)務人員均是安全的,不需要特別防護。
(3)注射部位:藍染料和核素示蹤劑注射于腫瘤表面的皮內或皮下、乳暈區(qū)皮內或皮下及原發(fā)腫瘤周圍的乳腺實質內均有相似的成功率和假陰性率。
(4)注射時間:核素示蹤劑的注射時間一般要求術前3~18 h,采用皮內注射可以縮短到術前30 min。藍染料示蹤劑術前10~15 min注射。
(5)術前淋巴顯像:乳腺癌SLNB術前可行淋巴顯像,有助于確定腋窩以外的SLN。但術前淋巴顯像對于腋窩SLN的完全檢出并非必須。
3.2 SLN術中確認與檢出
無論是乳房切除手術還是保乳手術,SLNB均應先于乳房手術。術中SLN的確定依示蹤劑而異。染料法要求檢出所有藍染淋巴管進入的第一個藍染淋巴結,仔細檢出所有藍染的淋巴管是避免遺漏SLN、降低假陰性率的關鍵。核素法SLN的閾值是超過淋巴結最高計數(shù)10%以上的所有淋巴結,術中γ探測儀探頭要緩慢移動,有序檢測,貼近計數(shù)。應用藍染料和(或)核素法檢出SLN后應對腋窩區(qū)進行觸診,觸診發(fā)現(xiàn)的腫大質硬淋巴結也應作為SLN單獨送檢。
4 SLN的病理組織學、細胞學和分子生物學診斷
4 .1 SLN的術中診斷
準確、快速的SLN術中診斷可以使SLN陽性患者通過一次手術完成ALND,避免二次手術的費用負擔和手術風險。推薦使用冰凍快速病理組織學和印片細胞學作為SLN術中診斷的檢測方法。術中冰凍病理和印片細胞學二者或任一診斷陽性,均作為SLN陽性而進行ALND。
術中分子診斷技術由于檢測的SLN組織量更多,較冰凍快速病理組織學和印片細胞學有更高的準確性和敏感性。術中分子診斷簡單培訓即可掌握, 可以節(jié)省有經驗病理醫(yī)生的寶貴時間,檢測結果客觀、標準化、重復性好。有條件的單位可以采用經過SFDA批準的術中分子診斷技術。
4.2 SLN的術后診斷
SLN術后病理組織學診斷的金標準是逐層切片病理檢測,推薦將SLN沿長軸切分成2 mm厚的組織塊,對每個組織塊進行逐層或連續(xù)切片HE染色病理檢測,聯(lián)合或不聯(lián)合免疫組化染色,3層切片間距為200~500 μm。不具備開展連續(xù)切片病理檢測條件的醫(yī)療單位仍可采用傳統(tǒng)的SLN評估方法,至少將SLN沿長軸分為兩個組織塊,每個組織塊切一個層面HE染色病理檢測。不推薦常規(guī)應用免疫組化技術以提高SLN微小轉移灶的檢出。
5 SLN轉移灶類型判定標準、預后意義及臨床處理
5.1 SLN轉移灶類型判定標準(AJCC 7th乳腺癌TNM分期)
轉移灶的位置不影響微轉移、孤立腫瘤細胞(isolated tumor cells,ITC)或宏轉移的診斷:轉移灶可以位于淋巴結內、突破被膜或完全淋巴結外侵犯脂肪;轉移灶伴纖維間質反應時,轉移灶大小為腫瘤細胞和相連纖維化的長徑。
⑴宏轉移:淋巴結內存在一個以上 >2 mm腫瘤病灶、其他陽性的轉移淋巴結至少微轉移;僅有ITC的淋巴結不作為pN分期陽性淋巴結,但應另外記錄為ITC。
僅依據(jù)SLNB分期或SLN+nSLN<6個,加標記(sn),如pN1(sn);SLN≥6,不再另加標記(sn)。
不推薦可能含有宏轉移的淋巴結接受分子診斷等其他的試驗或替代檢測,如果其可能使常規(guī)病理診斷漏診宏轉移;如果使用,應予登記。
⑵微轉移:腫瘤病灶最大徑>0.2 mm但≤2.0 mm,或單張組織切片不連續(xù),亦或接近連續(xù)的細胞簇>200個細胞。
記錄只發(fā)現(xiàn)微轉移 (無宏轉移) 的淋巴結數(shù)目,標記為pN1mi或pN1mi(sn);多個轉移灶時,測量最大轉移灶的最大徑,不能累計。
⑶ITC:單個細胞或最大徑≤0.2 mm的小細胞簇;單張組織切片不連續(xù)或接近連續(xù)的細胞簇≤200個細胞,淋巴結不同縱/橫切片或不同組織塊不能累計計數(shù);通常沒有或很少組織學間質反應;可通過常規(guī)組織學或IHC檢出。
記錄ITC受累淋巴結數(shù)目,標記為pN0(i+)或 pN0(i+)(sn);使用分子技術(RT-PCR)檢出組織學陰性淋巴結的微小轉移灶,標記為pN0(mol+)或pN0(mol+)(sn)。
5.2 SLN不同轉移類型的預后意義及腋窩處理
⑴宏轉移:約50%的患者腋窩非前哨淋巴結(nSLN)陽性。ALND是標準治療,特別是通過ALND進一步獲得的預后資料將改變治療決策。如果預后資料不改變治療決策,且患者拒絕進一步腋窩手術,則腋窩放療可以作為替代治療。
⑵微轉移:約20%的患者腋窩nSLN陽性(>5 mm的浸潤性導管癌),且大多數(shù)為宏轉移(80%),ALND可導致15%的患者分期提高,7%的患者輔助治療改變。單個SLN微轉移患者接受保乳治療時,可不施行ALND;其他情況下的腋窩處理同宏轉移患者。
⑶ITC:腋窩nSLN轉移的幾率<8%(>5 mm的浸潤性導管癌),ALND可導致4%的患者分期提高。目前認為ITC對患者預后有不良影響,與微轉移患者一樣可以自輔助全身治療獲益,但ITC患者不接受腋窩治療其腋窩復發(fā)率并無顯著升高,不推薦常規(guī)施行ALND。
⑷SLN陰性:不需進行腋窩處理。
6 SLNB替代ALND患者的隨訪
除常規(guī)復查項目外,常規(guī)行雙側腋窩、鎖骨區(qū)超聲檢查。臨床或超聲檢查異常腋淋巴結應在超聲引導下行細針穿刺或空芯針活檢,必要時行切開活檢手術。
九 乳腺癌全乳切除術后放射治療臨床指南
1 適應證
全乳切除術后放療可以在腋窩淋巴結陽性的患者中將5年局部-區(qū)域從22.8%降低到5.5%。全乳切除術后,具有下列預后因素之一,則符合高危復發(fā),具有術后放療指征,該放療指征與全乳切除的具體手術方式無關:
⑴原發(fā)腫瘤最大直徑≥5 cm,或腫瘤侵及乳腺皮膚、胸壁。
⑵腋淋巴結轉移≥4個。
⑶淋巴結轉移1~3個的T1/T2, 目前的資料也支持術后放療的價值。其中包含至少下列一項因素的患者可能復發(fā)風險更高,術后放療更有意義:年齡≤40歲,腋窩淋巴結清掃數(shù)目<10枚時轉移比例>20%,激素受體陰性,Her-2/neu過表達等。
2 與全身治療的時序配合
具有全乳切除術后放療指征的患者一般都具有輔助化療適應證,所以術后放療應在完成末次化療后2~4周內開始。個別有輔助化療禁忌證的患者可以在術后切口愈合,上肢功能恢復后開始術后放療。內分泌治療與放療的時序配合目前沒有一致意見,可以同期或放療后開展。曲妥珠單抗治療患者只要開始放療前心功能正常可以與放療同時使用,但一方面這些患者不宜照射內乳區(qū);其次,左側患者盡可能采用三維治療技術,降低心臟照射體積,評估心臟照射平均劑量至少低于8 Gy。
3 照射靶區(qū)
⑴由于胸壁和鎖骨上是最常見的復發(fā)部位,占所有復發(fā)部位的約80%,所以該兩區(qū)域是術后放療的主要靶區(qū);但T3N0患者可以考慮單純胸壁照射。
⑵由于內乳淋巴結復發(fā)的比例相對低,內乳野照射的意義現(xiàn)在尚不明確,對于化療前影像學診斷內乳淋巴結轉移可能的患者,原發(fā)腫瘤位于內側象限同時腋窩淋巴結有轉移的患者或其他內乳淋巴結轉移幾率較高的患者需考慮內乳野照射。
4 照射技術和照射劑量
所有術后放療靶區(qū)原則上給予50 Gy/5周/25次的腫瘤量,對于影像學(包括功能性影像)上高度懷疑有殘留或復發(fā)病灶的區(qū)域可局部加量至60 Gy或以上。
4.1 常規(guī)照射技術
⑴鎖骨上/下野
上界為環(huán)甲膜水平,需包括所有的鎖骨,下界與胸壁野上界相接,一般位于鎖骨頭下1 cm左右。內界為體中線至胸骨切跡水平沿胸鎖乳突肌的內緣。外界與肱骨頭相切。可采用X線和電子線混合照射以減少肺尖的照射劑量。治療時為頭部偏向健側以減少喉照射,機架角向健側偏斜10°~15°以保護氣管、食管和脊髓。內上射野必要時沿胸鎖乳突肌走向作鉛擋保護喉和脊髓。
⑵胸壁切線野:上界與鎖骨上野銜接,如單純胸壁照射上界可達鎖骨頭下緣,下界為對側乳腺皮膚皺折下1 cm。內界一般過體中線,外界:腋中線或腋后線,參照對側腺體附著位置。同保乳術后的全乳照射,各邊界也需要根據(jù)原發(fā)腫瘤的部位進行微調,保證原腫瘤部位處于劑量充分的區(qū)域,同時需要包括手術疤痕。
胸壁照射如果采用電子線照射,各設野邊界可參照切線野。無論采用X線或電子線照射,都需要給予胸壁組織等效填充物以提高皮膚劑量至足量。
⑶腋窩照射:①鎖骨上和腋窩聯(lián)合野,照射范圍包括鎖骨上/下和腋窩,與胸壁野銜接。腋鎖聯(lián)合野的上界和內界都同鎖骨上野,下界在第二肋間,外界包括肱骨頸,需保證射野的外下角開放。采用6 MV X線,鎖骨上/下區(qū)深度以皮下3~4 cm計算,達到鎖骨上區(qū)腫瘤量50 Gy/5周/25次后,腋窩深度根據(jù)實際測量結果計算,欠缺的劑量采用腋后野補量至DT 50 Gy,同時鎖骨上區(qū)縮野至常規(guī)鎖骨上野范圍,采用電子線追加劑量至50 Gy。②腋后野:作為腋鎖聯(lián)合野的補充,采用6 MV X線,上界平鎖骨下緣,內界位于肋緣內1.5 cm,下界同腋-鎖骨聯(lián)合野的下界,外界與前野肱骨頭鉛擋相接,一般包括約1 cm 肱骨頭。光欄轉動以使射野各界符合條件。
⑷內乳野:常規(guī)定位的內乳野需包括第一至第三肋間,上界與鎖骨上野銜接,內界過體中線0.5~1 cm,寬度一般為5 cm,原則上2/3及以上劑量需采用電子線以減少心臟的照射劑量。
4.2 三維適形照射技術
和二維治療相比,基于CT定位的三維治療計劃可以顯著提高靶區(qū)劑量均勻性和減少正常組織不必要的照射,提高射野銜接處劑量的合理性,所以即使采用常規(guī)定位,也建議在三維治療計劃系統(tǒng)上進行劑量參考點的優(yōu)化,楔形濾片角度的選擇和正常組織體積劑量的評估等,以更好地達到靶區(qū)劑量的完整覆蓋和放射損傷的降低。胸壁和區(qū)域淋巴結靶區(qū)勾畫可以參照RTOG標準或其他勾畫指南。
5 乳腺癌新輔助化療后、改良根治術后放射治療
放療指征暫同未做新輔助化療者,原則上參考新輔助化療前的初始分期。放療技術和劑量同未接受新輔助化療的改良根治術后放療。
對于有輔助化療指征的患者,術后放療應該在完成輔助化療后開展;如果無輔助化療指征,在切口愈合良好,上肢功能恢復的前提下,術后放療建議在術后8周內開始。與靶向治療和內分泌治療的時間配合同保乳治療或無新輔助化療的改良根治術后放療。
6 乳房重建術與術后放療
原則上不論手術方式,乳房重建患者的術后放療指征都需遵循同期別的乳房切除術后患者。無論是自體組織或假體重建術,都不是放射治療的禁忌證。但是從最佳的腫瘤控制和美容兼顧的角度考慮,如采用自體組織重建,有條件的單位可以將重建延遲至術后放療結束,期間可考慮采用擴張器保持皮瓣的空間,這樣在一定程度上比Ⅰ期重建后放療提高美容效果。當采用假體重建時,由于放療以后組織的血供和順應性下降,Ⅱ期進行假體植入會帶來更多的并發(fā)癥,包括假體移位、攣縮等,所以考慮有術后放療指征,又需采用假體的患者建議采用Ⅰ期重建。
乳房重建以后放療的技術可以參照保乳術后的全乳放療。由于重建的乳房后期美容效果在很大程度上取決于照射劑量,而重建后放療的患者一般都有淋巴引流區(qū)的照射指征,所以盡可能提高靶區(qū)劑量均勻性,避免照射野銜接處的熱點,是減少后期并發(fā)癥的關鍵。在這個前提下,建議采用三維治療技術,盡可能將淋巴引流區(qū)的照射整合到三維治療計劃中。

表 1 乳腺癌術后復發(fā)風險的分組

表 2 乳腺癌術后全身輔助治療的選擇a
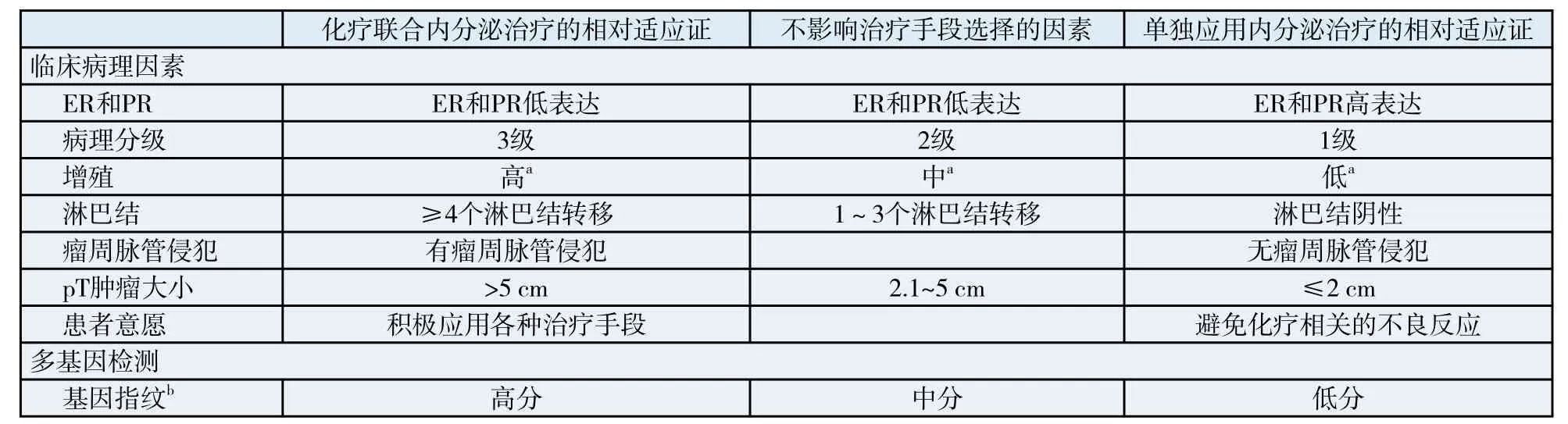
表 3 ER(+)、Her-2(-)患者化療和內分泌治療的選擇
十 乳腺癌全身治療指南
1 乳腺癌術后輔助全身治療臨床指南
1.1 乳腺癌術后輔助全身治療的選擇
乳腺癌術后復發(fā)風險的分組見表1,該表可供全面評估患者手術以后的復發(fā)風險的高低,是制定全身輔助治療方案的重要依據(jù)。乳腺癌術后全身輔助治療的選擇見表2。ER(+)、Her-2(-)患者化療和內分泌治療的選擇見表3。
1.2 乳腺癌術后輔助化療的臨床指南
1.2.1 適應證
⑴腫瘤>2 cm。
⑵淋巴結陽性。
⑶激素受體陰性。
⑷Her-2陽性。
⑸組織學分級為3級。
輔助化療方案的制定應綜合考慮腫瘤的臨床病理學特征、患者方面的因素和患者的意愿以及化療可能的獲益和由之帶來的毒性等。行免疫組化檢測時,應該常規(guī)包括ER、PR、Her-2和Ki67。
1.2.2 禁忌證
⑴妊娠早期女性:妊娠中期女性患者,應慎重選擇化療。
⑵年老體弱且伴有嚴重內臟器質性病變患者。
1.2.3 治療前談話
⑴輔助化療的目的是降低腫瘤復發(fā)率,提高總生存率。
⑵化療的不良反應。
⑶>70歲的患者接受化療可能會有獲益,但應慎重權衡化療帶來的利弊。
1.2.4 治療前準備
⑴首次化療前應充分評估患者的臟器功能,檢測方法包括血常規(guī)、肝腎功能、心電圖等。以后每次化療前應常規(guī)檢測血常規(guī)和肝腎功能;使用心臟毒性藥物前應常規(guī)做心電圖和(或)左室射血分數(shù)(left ventricular ejection fraction,LVEF)測定;其他檢查應根據(jù)患者的具體情況和所使用的化療方案等決定。
⑵育齡婦女應妊娠試驗陰性并囑避孕。⑶簽署化療知情同意書。
1.2.5 輔助化療方案與注意事項(化療詳細方案參見附錄Ⅵ、Ⅶ)
⑴選擇聯(lián)合化療方案,常用的有:①以蒽環(huán)類為主的方案,如CAF、A (E)C、FE100C方案(C:環(huán)磷酰胺,A:多柔比星,E:表柔比星,F(xiàn):氟尿嘧啶)。雖然吡柔比星(THP)在歐美少有大組的循證醫(yī)學資料,但在我國日常臨床實踐中,用同等劑量的吡柔比星代替普通多柔比星也是可行的。THP推薦劑量40~50 mg/m2。②蒽環(huán)類與紫杉類聯(lián)合方案,例如TAC (T:多西他賽)。③蒽環(huán)類與紫杉類序貫方案,例如AC→T/P (P:紫杉醇)或FEC→T。④不含蒽環(huán)類的聯(lián)合化療方案,適用于老年、低風險、蒽環(huán)類禁忌或不能耐受的患者,常用的有TC方案及CMF方案(C:環(huán)磷酰胺,M:甲氨蝶呤,F(xiàn):氟尿嘧啶)。
⑵若無特殊情況,一般不建議減少化療的周期數(shù)。
⑶在門診病歷和住院病史中須給出藥物的每平方米體表面積的劑量強度。一般推薦首次給藥劑量不得低于推薦劑量的85%,后續(xù)給藥劑量應根據(jù)患者的具體情況和初始治療后的不良反應,可以1次下調20%~25%。每個輔助化療方案僅允許劑量下調2次。
⑷輔助化療一般不與內分泌治療或放療同時進行,化療結束后再開始內分泌治療,放療與內分泌治療可先后或同時進行。
⑸化療時應注意化療藥物的給藥順序,輸注時間和劑量強度,嚴格按照藥品說明和配伍禁忌使用。
⑹蒽環(huán)類藥物有心臟毒性,使用時須評估LVEF,至少每3個月1次。如果患者使用蒽環(huán)類藥物期間發(fā)生有臨床癥狀的心臟毒性、或無癥狀但LVEF<45%亦或較基線下降幅度超過15%,應先停藥并充分評估患者的心臟功能,后續(xù)治療應慎重。
1.3 乳腺癌術后輔助內分泌治療臨床指南
1.3.1 適應證
激素受體ER和(或)PgR陽性的乳腺癌患者。
1.3.2 治療前談話
⑴輔助內分泌治療的目的是降低腫瘤復發(fā)率,提高總生存率。
⑵內分泌治療的不良反應。
1.3.3 內分泌治療與其他輔助治療的次序
輔助內分泌治療與化療同時應用可能會降低療效。一般在化療之后使用,但可以和放射治療以及曲妥珠單抗治療同時應用。
1.3.4 絕經前患者輔助內分泌治療方案與注意事項(絕經標準詳見附錄Ⅷ)
⑴一般情況下,首選他莫昔芬20 mg/d×5年。治療期間注意避孕,并每半年至1年行1 次婦科檢查,通過B超了解子宮內膜厚度。
雖然托瑞米芬在歐美少有大組的絕經前乳腺癌循證醫(yī)學資料, 但在我國日常臨床實踐中,用托瑞米芬代替他莫昔芬也是可行的。
⑵卵巢去勢推薦用于下列絕經前患者:①高度風險且化療后未導致閉經的患者,可同時與他莫昔芬聯(lián)合應用。卵巢去勢后也可以與第三代芳香化酶抑制劑聯(lián)合應用,但目前尚無充分證據(jù)顯示其優(yōu)于卵巢去勢與他莫昔芬的聯(lián)合;②不愿意接受輔助化療的中度風險患者,可同時與他莫昔芬聯(lián)合應用;③對他莫昔芬有禁忌者。
⑶卵巢去勢有手術切除卵巢、卵巢放射及藥物去勢(GnRHa),若采用藥物性卵巢去勢,目前推薦的治療時間是2~3年。
1.3.5 絕經后患者輔助內分泌治療的方案及注意事項
⑴第三代芳香化酶抑制劑可以向所有絕經后的ER和(或)PR陽性患者推薦,尤其是具備以下因素的患者:①高度復發(fā)風險患者;②對他莫昔芬有禁忌的患者;或使用他莫昔芬出現(xiàn)中、重度不良反應的患者;③在用他莫昔芬20 mg/d×5年后的高度風險患者。
⑵芳香化酶抑制劑可以從一開始就應用5年(來曲唑、阿那曲唑或依西美坦),或者在他莫昔芬治療2~3年后再轉用2~3年(依西美坦或阿那曲唑),亦或在他莫昔芬用滿5年之后的高度風險患者再繼續(xù)應用5年(來曲唑) 。一旦使用1種第三代芳香化酶抑制劑,如果無特殊原因,不推薦換用其他第三代芳香化酶抑制劑。
⑶可選用他莫昔芬。他莫昔芬20 mg/d×5年,是有效而經濟的治療方案。治療期間應每半至1年行1次婦科檢查,通過B超了解子宮內膜厚度。
⑷也可選用他莫昔芬以外的其他雌激素受體調節(jié)劑,如托瑞米芬。
⑸絕經前患者內分泌治療過程中,因月經狀態(tài)改變可能引起治療調整。
⑹芳香化酶抑制劑和LHRH類似物可導致骨密度下降或骨質疏松,因此在使用這些藥物前常規(guī)推薦骨密度檢測,以后在藥物使用過程中,每6個月監(jiān)測1次骨密度。并進行T-評分(T-Score),T-Score為<-2.5,開始使用雙膦酸鹽治療;T-Score為-2.5~-1.0,給予維生素D和鈣片治療,并考慮使用雙膦酸鹽;T-Score為>-1.0,不推薦使用雙膦酸鹽。
1.4 乳腺癌術后輔助曲妥珠單抗治療臨床指南
1.4.1 適應證
原發(fā)腫瘤>1.0 cm時,推薦使用曲妥珠單抗;原發(fā)腫瘤在>0.5 cm但<1.0 cm時,可考慮使用。
⑴Her-2/neu基因過表達是指免疫組化法3+,或熒光原位雜交法(FISH)陽性,或者色素原位雜交法(CISH)陽性。
⑵經免疫組化檢測Her-2為(++)的患者值得進一步FlSH或CISH明確是否有基因擴增。
1.4.2 相對禁忌證
⑴治療前LVEF < 50%。
⑵同期正在進行多柔比星化療。
1.4.3 治療前談話
⑴目前正在進行中的臨床研究初步結果顯示:對于Her-2/neu基因過表達的乳腺癌患者采用1年曲妥珠單抗輔助治療可以降低乳腺癌的復發(fā)率。
⑵曲妥珠單抗是一種生物靶向制劑,經10年以上的臨床應用證實其不良反應少,但其中較嚴重的不良反應是,當其與蒽環(huán)類藥物聯(lián)合應用會增加充血性心力衰竭的機會。
⑶曲妥珠單抗高昂的價格,Her-2/neu狀態(tài)確認的重要性及其檢測費用。
1.4.4 治療前準備
⑴精確的Her-2/neu檢測。建議將浸潤性乳腺癌組織的石蠟標本(蠟塊或白片)送往國內有條件的病理科進行復查。
⑵心功能檢查(心臟超聲或同位素掃描,以前者應用更為普遍)。
⑶簽署治療知情同意書。
1.4.5 治療方案和注意事項
⑴曲妥珠單抗6 mg/kg (首次劑量8 mg/kg )每3周方案,或2 mg/kg(首次劑量4 mg/ kg)每周方案。目前暫推薦的治療時間為1年,可與化療同時使用或化療后序貫使用。
⑵首次治療后觀察4~8 h。
⑶與多柔比星同期應用須慎重,但可以前后階段序貫應用。與非蒽環(huán)類化療、內分泌治療或放療都可同期應用(具體方案見附錄Ⅵ、Ⅶ)。
⑷每3個月監(jiān)測1次LVEF。治療中若出現(xiàn)LVEF低于50%,應暫停治療,并跟蹤監(jiān)測LVEF結果,直至恢復50%以上方可繼續(xù)用藥。若不恢復、或繼續(xù)惡化或出現(xiàn)心衰癥狀則應當終止曲妥珠單抗治療。
2 乳腺癌新輔助化療臨床指南
2.1 新輔助化療的適宜人群
2.1.1 一般適合臨床Ⅱ、Ⅲ期的乳腺癌患者
Ⅰ期患者行術前化療的意義尚不肯定。Ⅳ期患者化療為姑息解救治療手段,而非新輔助治療適應證。
2.1.2 對隱匿性乳腺癌行新輔助化療的可行性
對隱匿性乳腺癌行新輔助化療是可行的。其中隱匿性乳腺癌定義為找不到其他原發(fā)灶的腋窩淋巴結的轉移性腺癌,盡管臨床體檢和現(xiàn)有的影像學檢查均不能發(fā)現(xiàn)乳房腫塊,甚至術后病理也未查及乳腺癌的原發(fā)病灶,但還是可以診斷這是一類特殊類型乳腺癌。
2.2 新輔助化療的禁忌證
⑴未經組織病理學確診的乳腺癌:推薦得到ER、PR、Her-2/neu及Ki67等免疫組化指標,不推薦將細胞學作為病理診斷標準。
⑵妊娠早期女性。妊娠中期女性患者,應慎重選擇化療。
⑶年老體弱且伴有嚴重心、肺等器質性病變,預期無法耐受化療者。
2.3 新輔助化療前的談話
⑴新輔助化療的定義:新輔助化療是指在手術或手術加放療的局部治療前,以全身化療為乳腺癌的第一步治療,后再行局部治療。基于目前循證醫(yī)學的證據(jù),新輔助化療的療效和輔助化療的療效是一樣的,但可以使部分不能保乳的患者獲得保乳的機會,部分不可手術的患者獲得手術的機會。但是一部分患者(< 5%)在新輔助化療的過程中可能出現(xiàn)進展,甚至喪失手術的機會。
⑵新輔助化療的意義:①新輔助化療是局部晚期乳腺癌或炎性乳腺癌的規(guī)范療法,可以使腫瘤降期以利于手術,或變不可手術為可手術。②若能達到病理完全緩解,則預示遠期高生存率。③對于腫瘤較大且有保乳意愿的患者可以提高保乳率。
⑶部分乳腺癌對新輔助化療初始治療方案不敏感。若2個周期化療后腫瘤無變化或反而增大時,需要更換化療方案或采用其他療法。
⑷接受有效的新輔助化療之后,即便臨床上腫瘤完全消失,也必須接受既定的后續(xù)治療,包括手術治療,并根據(jù)手術后病理結果決定進一步輔助治療的方案。
2.4 新輔助化療的實施
2.4.1 治療前準備
⑴病灶基線體檢:精確測量乳腺原發(fā)灶和腋窩淋巴結的最長徑(多個腫塊時取其最長徑之和)。
⑵基線影像學評估:乳房超聲、乳腺X線下腫瘤的最長徑(有條件者可進行MRI評估)。
⑶血常規(guī)、肝腎功能、心電圖、胸片、肝臟超聲檢查。局部晚期乳腺癌或炎性乳腺癌患者還需加做全身骨掃描、胸部CT。心臟病者行必要的心功能檢查(如心超測LVEF)。
⑷治療前必須對乳腺原發(fā)灶行空芯針活檢,明確組織學診斷及免疫組化檢查(隱匿性乳腺癌除外)。
⑸腫大的區(qū)域淋巴結是否為乳腺癌轉移,必須穿刺得到病理證實。如果陽性,即使新輔助化療有效,也不必作前哨淋巴結活檢;如果陰性,可在新輔助化療前行前哨淋巴結活檢。
⑹育齡婦女應妊娠試驗陰性或囑避孕。
⑺告知化療的不良反應,簽署化療知情同意書。
2.4.2 宜選擇含蒽環(huán)類和紫杉類的聯(lián)合化療方案(附錄Ⅵ、Ⅶ)及注意事項
⑴以蒽環(huán)類為主的化療方案,如CAF、FAC、AC、CEF和FEC方案(C:環(huán)磷酰胺;A:多柔比星,或用同等劑量的吡柔比星;E:表柔比星;F:氟尿嘧啶)。
⑵蒽環(huán)類與紫杉類聯(lián)合方案,如A(E)T、TAC(T:多西他賽)。
⑶蒽環(huán)類與紫杉類序貫方案,如AC→P 或AC→T(P:紫杉醇)。
⑷其他含蒽環(huán)類的化療方案,如NE(N:長春瑞濱)。
注意事項:
⑴ 新輔助治療方案應同時包括紫杉類和蒽環(huán)類藥物,Her-2陽性者應同時應用抗 Her-2的藥物。
⑵絕經后激素受體強陽性的患者可考慮使用單用內分泌治療,如果使用這樣的治療,應持續(xù)5~8個月或至最佳療效。
⑶在門診病歷和住院病史中須給出藥物的每平方米體表面積的劑量強度。一般推薦首次給藥劑量不得低于推薦劑量的85%,后續(xù)給藥劑量應根據(jù)患者的具體情況和初始治療后的不良反應,可以1次下調20%~25%。
⑷每個新輔助化療方案僅允許劑量下調2次。
2.4.3 療效評估以及化療的療程
⑴建議在化療第1個周期的最后1天,亦即計劃第2個周期化療之前,進行細致的體檢,初步了解化療的治療反應,如果明確腫瘤增大,要考慮早期進展的可能。
⑵一般情況下,建議在化療第2個周期末,即計劃第3個周期之前全面評估療效。新輔助化療前后的檢查手段應該一致,評價結果按照RECTST 標準或WHO標準分為CR、PR、SD和PD。
⑶無效的患者建議更改化療方案重新進入評價程序,或改變總體治療計劃,改用手術、放療或者其他全身治療措施。
⑷對CR或PR的患者的處理有爭議。一般可以根據(jù)個體情況而有以下選擇:①直接手術;②繼續(xù)2~4 個周期的相同方案(總計4~6個周期)化療后,再次評估化療的效果及手術;③若采用AC→T或P方案,則再繼續(xù)2個周期的AC,然后更換為4個周期的T或P方案化療后,再次評估化療的效果及手術。
2.5 乳腺癌經新輔助化療降期后的處理
2.5.1 手術分類
手術可根據(jù)個體情況選擇根治術、改良根治術、保留乳房手術。
2.5.2 術后病理檢查
⑴病理完全緩解(pCR)的定義有兩種:①一般是指乳腺原發(fā)灶中找不到惡性腫瘤的組織學證據(jù),或僅存原位癌成份;②嚴格意義上的pCR是指乳腺原發(fā)灶和轉移的區(qū)域淋巴結均達到病理完全緩解。
⑵pCR的確定應當由病理醫(yī)生完成,但臨床醫(yī)生有責任協(xié)助病理醫(yī)生找到原病灶部位,經過多點取材檢查后,才能確定pCR。
⑶殘存腫瘤的組織學分型、分級、ER、PgR及Her-2等免疫組化結果可供參考。應當根據(jù)新輔助化療前取材得到的病理報告,再安排術后治療,如術前ER陰性而術后ER陽性者仍應視為ER陽性的乳腺癌,反之亦然。
2.5.3 術后輔助治療
⑴術后輔助化療:目前尚有爭議。一般可以根據(jù)術前化療的周期數(shù)、療效以及術后病理檢查結果而再繼續(xù)選擇相同化療方案、或更換新的化療方案以及不輔助化療,鑒于目前尚無足夠證據(jù),故無法統(tǒng)一。一般新輔助化療加輔助化療的總周期數(shù)為6~8個周期。
⑵術后輔助放療:目前尚有爭議。一種意見認為,無論化療反應如何都應當根據(jù)化療前的腫瘤臨床分期,來決定是否需要輔助放療以及輔助放療的范圍,另一種意見則認為應當根據(jù)術后的病理分期來決定。本指南傾向按照化療前臨床分期予以處理。
⑶輔助內分泌治療、輔助分子靶向治療:參見乳腺癌術后輔助全身治療臨床指南。新輔助加輔助曲妥珠單抗的總治療時間為1年。
3 晚期乳腺癌解救性全身治療臨床指南
晚期乳腺癌包括復發(fā)和轉移性乳腺癌,是不可治愈的疾病。治療的主要目的是緩解癥狀、提高生活質量和延長患者生存期。應盡可能在決定治療方案前對復發(fā)或轉移部位進行活檢,尤其是孤立性病灶,以明確診斷和重新評估腫瘤的ER、PR和Her-2狀態(tài)。
3.1 晚期乳腺癌內分泌治療指南
3.1.1 適應證
⑴ER和(或)PR陽性的復發(fā)或轉移性乳腺癌。
⑵轉移灶僅局限于骨或軟組織。
⑶無癥狀的內臟轉移。
⑷復發(fā)距手術時間較長,一般>2年。
⑸原則上內分泌治療適合于激素受體陽性的患者,但是如果是受體不明或受體為陰性的患者,只要其臨床病程發(fā)展緩慢,也可以試用內分泌治療。
3.1.2 治療前談話
⑴復發(fā)或Ⅳ期乳腺癌的全身治療主要以延長生存期、提高生活質量為目的,而非治愈性。因此,應優(yōu)先選擇毒性盡可能小的治療方案。只要情況允許,毒性較小的內分泌治療優(yōu)于細胞毒治療。
⑵內分泌治療的不良反應。
3.1.3 內分泌藥物
⑴絕經后患者的內分泌治療包括:芳香化酶抑制劑包括非甾體類(阿那曲唑和來曲唑)和甾體類(依西美坦)、作用于雌激素受體的藥物(他莫昔芬和氟維司群)、孕酮類藥物(甲地孕酮)、雄激素(氟甲睪酮)、大劑量雌激素(乙炔基雌二醇)。
⑵絕經前患者的內分泌治療包括:他莫昔芬、LHRH類似物(戈舍瑞林和luprolide)、外科手術去勢、孕酮類藥物(甲地孕酮)、雄激素(氟甲睪酮)和大劑量雌激素(乙炔基雌二醇)。
3.1.4 內分泌一線治療的選擇和注意事項
⑴沒有接受過抗雌激素治療或距既往的抗雌激素治療1年以上的絕經后復發(fā)患者,他莫昔芬和芳香化酶抑制劑都是合理的選擇。
⑵他莫昔芬輔助治療失敗的絕經后患者可選芳香化酶抑制劑或氟維司群。
⑶既往接受過抗雌激素治療并且距抗雌激素治療1年內復發(fā)轉移的絕經后患者,芳香化酶抑制劑是首選的一線治療。
⑷未接受抗雌激素治療的絕經前患者,可選擇治療為他莫昔芬,卵巢去勢,或卵巢去勢加他莫昔芬或芳香化酶抑制劑。
3.1.5 內分泌解救治療的選擇及注意事項
⑴盡量不重復使用輔助治療或一線治療用過的藥物。
⑵他莫昔芬治療失敗的絕經后患者可選芳香化酶抑制劑或氟維司群。
⑶一類芳香化酶抑制劑治療失敗患者可選另外一類芳香化酶抑制劑、氟維司群或孕激素(醋酸甲地孕酮/甲羥孕酮)。
⑷ER陽性的絕經前患者可采取卵巢手術切除或其他有效的卵巢功能抑制治療,隨后遵循絕經后婦女內分泌治療指南。
⑸二線內分泌治療之后的內分泌治療有效選擇,尚缺乏高水平的證據(jù)供參考。
3.2 晚期乳腺癌化療的臨床指南
3.2.1 適應證(具備以下1個因素即可考慮首選化療)
⑴激素受體陰性。
⑵有癥狀的內臟轉移。
⑶激素受體陽性但對內分泌治療耐藥的患者。
⑷年齡<35歲。
3.2.2 治療前談話
⑴化療的目的是改善生活質量,延長生存期。
⑵化療的不良反應。
3.2.3 治療前準備
⑴首次化療前應檢測血常規(guī)、肝腎功能、心電圖。以后每次化療前后應常規(guī)檢測血常規(guī),使用蒽環(huán)類藥物者還須檢查心電圖或LVEF。心臟或肝腎功能異常者需監(jiān)測血常規(guī)、心電圖、LVEF或肝腎功能。
⑵育齡婦女應妊娠試驗陰性并囑避孕。⑶簽署化療知情同意書。
3.2.4 化療方案和注意事項(具體方案見附件Ⅵ、Ⅶ)
⑴推薦的首選化療方案包括單藥序貫化療或聯(lián)合化療。與單藥化療相比,聯(lián)合化療通常有更好的客觀緩解率和疾病至進展時間,然而聯(lián)合化療的毒性較大且生存獲益很小。此外,序貫使用單藥能降低患者需要減小劑量的可能性。需要使腫瘤迅速縮小或癥狀迅速緩解的患者選擇聯(lián)合化療,耐受性和生活質量作為優(yōu)先考慮因素的患者選擇單藥序貫化療。
⑵一線單藥包括:蒽環(huán)類,如多柔比星、表柔比星、聚乙二醇化脂質體多柔比星;紫杉類,如紫杉醇、多西他賽、白蛋白結合紫杉醇;抗代謝藥,如卡培他濱和吉西他濱;以及非紫杉類微管形成抑制劑,如長春瑞濱。
⑶一線聯(lián)合化療方案包括:環(huán)磷酰胺、多柔比星和氟尿嘧啶(FAC/CAF);氟尿嘧啶、表柔比星和環(huán)磷酰胺(FEC);多柔比星、環(huán)磷酰胺(AC);表柔比星、環(huán)磷酰胺(EC);多柔比星聯(lián)合多西他賽或紫杉醇(AT);環(huán)磷酰胺、氨甲喋呤和氟尿嘧啶(CMF);多西他賽聯(lián)合卡培他濱;吉西他濱聯(lián)合紫杉醇。
⑷其他有效的單藥還包括環(huán)磷酰胺、順鉑、口服依托泊苷、長春花堿、米托蒽醌和氟尿嘧啶持續(xù)靜脈給藥方案。
⑸標準的藥物治療為應用一個治療方案直至疾病進展換藥,但由于缺乏總生存期方面的差異,應該采用長期化療還是短期化療后停藥或維持治療需權衡療效、藥物不良反應和患者生活質量。
⑹蒽環(huán)類藥物有心臟毒性,使用時須評估LVEF,至少每3個月1次。如果患者使用蒽環(huán)類藥物期間發(fā)生有臨床癥狀的心臟毒性、或無癥狀但LVEF<45%或較基線下降>15%,首先停藥,充分評估患者的心臟功能,后續(xù)治療應該慎重。盡管早期有臨床試驗提示同時使用右丙亞胺和蒽環(huán)類藥物可能會降低化療的客觀有效率,但是薈萃分析顯示右丙亞胺會引起較重的粒細胞減少,但是并未降低化療的療效,且可降低約70%的心力衰竭發(fā)生率。
3.3 Her-2陽性的晚期乳腺癌治療的臨床指南
3.3.1 適應證
Her-2/neu陽性的復發(fā)或轉移性乳腺癌。
⑴Her-2/neu陽性是指免疫組化檢測為(+++),或熒光原位雜交法(FISH)或者色素原位雜交法(CISH)顯示Her-2基因擴增。
⑵免疫組化檢測Her-2為(++)的患者,應該進一步行FISH或CISH檢測明確是否有基因擴增。
3.3.2 相對禁忌證
⑴治療前LVEF<50%。
⑵同時進行多柔比星化療。
⑶治療過程中,LVEF較基線下降≥15%。
3.3.3 治療前談話
⑴在常規(guī)化療的基礎上加用曲妥珠單抗不但可以提高客觀有效率和中位PFS,而且可延長患者的總生存期。
⑵曲妥珠單抗是一種生物靶向制劑,經10年以上的臨床應用總體安全性良好,但有可能影響心臟射血功能和增加充血性心力衰竭的機會。
⑶曲妥珠單抗價格貴,Her-2/neu狀態(tài)確認的重要性及其檢測費用。
3.3.4 治療前準備
⑴準確的Her-2/neu檢測。有條件盡量行轉移灶的再次活檢,以證實轉移灶的 Her-2狀態(tài)是否有轉變。并可將原手術組織的標本和轉移灶標本(蠟塊或白片)送往國內有條件的病理科進行復查。
⑵心功能檢查(心臟超聲或同位素掃描,以前者應用更為普遍)。
⑶簽署治療知情同意書。
3.3.5 一線治療方案的選擇和注意事項
⑴曲妥珠單抗可聯(lián)合的化療藥物和方案有紫杉醇聯(lián)合或不聯(lián)合卡鉑、多西他賽、長春瑞濱和卡培他濱。
⑵Her-2和激素受體同時陽性的晚期乳腺癌患者中,對病情發(fā)展較慢或不適合化療的患者,可以選擇曲妥珠單抗聯(lián)合內分泌治療。
⑶使用期間,每3個月檢查1次LVEF。3.3.6 二線治療方案的選擇和注意事項
⑴在含曲妥珠單抗方案治療后發(fā)生疾病進展的Her-2陽性轉移乳腺癌患者中,后續(xù)治療應繼續(xù)阻滯Her-2通路。
⑵可保留曲妥珠單抗,而更換其他化療藥物,如卡培他濱。
⑶也可換用拉帕替尼與其他化療藥物,如卡培他濱。
⑷也可停細胞毒藥物,而使用兩種靶向治療藥物的聯(lián)合,如拉帕替尼聯(lián)合曲妥珠單抗。
4 終末期乳腺癌姑息性治療臨床指南
4.1 適應證
⑴有難以控制的腫瘤相關癥狀,如疼痛、厭食和惡液質、惡心嘔吐等。
⑵腫瘤相關的生理和心理問題,如體能狀況下降(ECOG≥3分或KPS<50分)、精神錯亂、譫妄、脊神經壓迫、惡液質、肝腎功能衰竭及嚴重的伴發(fā)疾病等。
⑶無有效治療手段的進展期疾病。⑷預期生命<3個月。
4.2 治療前談話
⑴使患者及家屬了解疾病的狀況和理解后續(xù)治療的性質。
⑵了解患者及家屬對姑息性治療的需求和做出相應的具體的姑息性措施。
4.3 腫瘤相關癥狀的控制和注意事項
4.3.1 疼痛
⑴腫瘤晚期疼痛的處理應遵循三階梯止痛原則。具體原則:①應盡量口服給藥;②按時給藥;③按階梯給藥,按照疼痛的程度和性質選用不同階梯的止痛藥物,先用非麻醉性鎮(zhèn)痛劑,在常規(guī)非麻醉性鎮(zhèn)痛劑無效時,可應用可待因等弱阿片類藥物,疼痛仍不能控制者可使用強阿片類藥物,如嗎啡、芬太尼等;④用藥劑量個體化,并注意具體細節(jié)。
⑵注意藥物的不良反應,如便秘、頭痛等,平衡止痛療效與不良反應。
⑶可應用一些輔助用藥增加止痛效果,減少不良反應。如安定類藥物、抗抑郁藥物、抗痙攣藥物等加強止痛療效,胃黏膜保護劑、胃腸動力藥物和通便緩瀉藥等,可使腫瘤患者避免過早出現(xiàn)鎮(zhèn)痛藥的不良反應。
⑷針對性治療,如骨轉移患者推薦應用雙膦酸鹽和局部放療等較積極的治療手段。
⑸增加醫(yī)生與患者之間的溝通,了解患者疼痛的具體細節(jié)并予以指導和幫助,有助于控制疼痛。有證據(jù)顯示,以電話為基礎的由接受過培訓且有資質的護士組成的患者管理系統(tǒng)能夠顯著緩解患者的癌癥相關的情緒低落和癌癥疼痛。
4.3.2 厭食和惡液質
⑴晚期癌癥患者都可能發(fā)生厭食和惡液質,影響患者生活質量。
⑵癌癥患者惡液質的主要癥狀有:厭食、消瘦、貧血、蛋白質的丟失以及代謝失常等。
⑶可用甲地孕酮、甲羥孕酮或類固醇類藥物來治療厭食和惡液質,癥狀好轉后停用。
⑷對終末期的患者過度行營養(yǎng)支持治療有可能會帶來更多的痛苦,甚至可能會縮短患者的壽命。終末期患者的水化和營養(yǎng)措施應主要為口干的護理和終末期患者的家屬的護理知識普及。
4.3.3 惡心和嘔吐
⑴明確嘔吐原因,有治療相關性嘔吐(如化療、放療等)、疾病相關性(如腦轉移、胃腸道梗阻等)。
⑵針對原因進行治療,如放療和化療前預防性給予止吐藥物、腦轉移者給予脫水、胃腸道梗阻者給予胃腸減壓等處理。
⑶非特異性的惡心嘔吐給予多巴胺受體拮抗劑或苯二氮卓類藥物,尤其適用于焦慮所致的惡心嘔吐。
⑷頑固性惡心嘔吐可持續(xù)靜脈給藥或皮下給藥,如可進行多巴胺受體拮抗劑的劑量滴定至最大獲益和耐受水平。若惡心仍持續(xù)存在,可考慮加用5-羥色胺受體拮抗劑和(或)抗膽堿能藥物和(或)抗組胺藥物,糖皮質激素,持續(xù)止吐藥物滴注,安定類藥物甚至大麻類藥物。針灸和鎮(zhèn)靜劑也可考慮。
⑸注意劇烈嘔吐有可能引起上消化道出血,另須注意電解質平衡。
4.3.4 惡性胸水
⑴對全身治療抗拒的腫瘤引起的惡性胸水,會引起患者呼吸困難,局部對癥治療可以緩解癥狀。
⑵在胸腔穿刺后,可以直接抽胸水后拔除穿刺管,也可以行胸腔閉式引流術。前者可以明確胸水的性質和暫時緩解癥狀,但快速大量放液可導致低血壓、低蛋白血癥、引起虛脫、縱隔擺動和肝性昏迷等,另外多次放液易引起腔內繼發(fā)感染。胸腔閉式引流術,可置管數(shù)日或數(shù)周,注入細胞毒藥物或硬化劑,療效較好。
⑶局部胸腔內用藥可選用順鉑、多柔比星、博來霉素等化療藥物,也可選用萬特普安、短小棒狀桿菌、白介素-2、干擾素及卡介苗等生物反應調節(jié)劑。一般認為局部用藥的主要機理是以化學性粘連作用為主。
⑷大多數(shù)藥物胸腔注射的常見不良反應有胸痛、發(fā)熱,偶有低血壓。這些不良反應一般不嚴重,對癥處理可以控制。
4.3.5 乏力
⑴腫瘤相關的乏力(CRF)很常見,臨床上漏診和漏治現(xiàn)象非常普遍。腫瘤本身和腫瘤治療均可引起CRF,其具體機制尚不明確,是身體對抗過度負荷及其造成的組織損傷的一種反應,與疼痛有協(xié)同作用。
⑵CRF往往與其他臨床表現(xiàn)共同存在,其臨床常見癥候群為乏力、疼痛、苦惱和睡眠障礙等。大多數(shù)接受化療的患者和終末期患者均存在睡眠障礙,發(fā)生率約是正常人群的3倍,常見的表現(xiàn)為失眠綜合征和入睡困難。
⑶CRF需與心情壓抑相區(qū)別,前者隨治療時間的延長而增加,后者隨治療時間的延長而減輕。
⑷CRF評估會受到患者或醫(yī)務工作者等人為因素影響,以前評估時很少采用客觀指標,現(xiàn)在建議加用客觀指標,如6 min步行法(the 6-minute walk)。
⑸CRF的治療可分為兩個方面:①找不到病因,主要以非藥物治療治療。非藥物治療主要包括保存體力,合理使用體力以及養(yǎng)成良好的睡眠習慣等。瑜伽可以改善睡眠和生活質量、減輕乏力。②找到病因,對因治療:乏力可由其他藥物所致,如倍他樂克引起心率減慢而導致乏力,引起嗜睡的藥物導致乏力。伴隨的其他疾病也可以引起乏力,如心衰和甲狀腺功能低下。
十一 乳腺癌患者康復治療共識
1 康復治療的定義
康復包括生理功能的恢復、心理狀態(tài)的調整以及社會活動能力的恢復。乳腺癌的康復治療就是在乳腺癌正規(guī)治療同時或結束后,幫助患者恢復機體生理功能、調整心理狀態(tài),并且能夠回歸社會,重建被疾病破壞了的生活。
2 康復治療的內容
2.1 患側上肢功能的鍛煉
2.1.1 術后上肢功能鍛煉
功能鍛煉對于恢復患者肩關節(jié)功能和消除水腫至關重要,但必須嚴格遵守循序漸進的順序,不可隨意提前,以免影響傷口的愈合。
循序漸進方法:術后1~2 d,練習握拳、伸指、屈腕;
術后3~4 d,前臂伸屈運動;
術后5~7 d,患側的手摸對側肩、同側耳(可用健肢托患肢);
術后8~10 d,練習肩關節(jié)抬高、伸直、屈曲至90°;
術后10 d后,肩關節(jié)進行爬墻及器械鍛煉。
⑴功能鍛煉的達標要求是:2周內患肢上臂能伸直、抬高繞過頭頂摸到對側的耳。達標后仍需繼續(xù)進行功能鍛煉。
⑵術后7 d內限制肩關節(jié)外展。
⑶嚴重皮瓣壞死者,術后2周內避免大幅度運動。
⑷皮下積液或術后1周引流液超過50 mL時應減少練習次數(shù)及肩關節(jié)活動幅度(限制外展)。
⑸植皮及行背闊肌皮瓣乳房重建術后要推遲肩關節(jié)運動。
2.1.2 預防或減輕上肢水腫
一般認定患側上肢周徑比對側上肢周徑長<3 cm為輕度水腫,3~5 cm為中度,>5 cm 為重度水腫。
⑴預防感染:保持患側皮膚清潔;不在患肢手臂進行有創(chuàng)性的操作,例如抽血、輸液等;洗滌時戴寬松手套,避免長時間接觸有刺激性的洗滌液;避免蚊蟲叮咬;衣著、佩戴首飾或手表時一定要寬松。
⑵避免高溫環(huán)境:避免燙傷;患側手臂不要熱敷,沐浴時水溫不要過高;避免強光照射和高溫環(huán)境。
⑶避免負重:避免提、拉、推過重的物品;避免從事重體力勞動或較劇烈的體育活動。
⑷其他:盡快恢復手臂功能;乘坐飛機時戴彈力袖套。
⑸淋巴水腫的自我護理方法:①輕度或中度淋巴水腫:抬高手臂;沿淋巴走向自下而上向心性按摩;做手臂功能恢復訓練;戴彈力袖套。②重度淋巴水腫:戴彈力袖套;物理治療。如手臂出現(xiàn)變紅或異常硬等癥狀,亦或水腫嚴重時應考慮有感染發(fā)生,應抗感染及對癥處理。
2.2 營養(yǎng)和運動
乳腺癌疾病本身的進展或治療期間的不良反應均有可能會導致患者營養(yǎng)不良,而飲食過剩造成超重,也是乳腺癌患者康復期所面臨的問題之一。癌癥患者同時也是第二原發(fā)癌癥、心血管疾病、糖尿病、骨質疏松癥的高危人群,合理的營養(yǎng)、健康的生活方式在乳腺癌患者康復期顯得尤為重要。
2.2.1 飲食營養(yǎng)
目前為止尚沒有證據(jù)證明某一類食品的飲食與乳腺癌的復發(fā)或轉移相關。
⑴可選用易消化、高蛋白、高維生素、低脂肪的食物。
⑵需要禁忌的食物有:①胎盤及其制品;②未知成分的保健品。
2.2.2 運動
康復期應選擇一項適合自己并能終生堅持的有氧運動。可向患者推薦的運動有快走、騎車、游泳、打太極拳以及有氧舞蹈等。
均衡飲食及有氧運動可增強人體免疫系統(tǒng)、有效減輕精神壓力、改善睡眠、緩解由癌癥及對其治療而引起的疲勞癥狀,增加人體對疾病的抵抗能力。
2.2.3 建立健康的生活方式
⑴保持正常的體重;
⑵堅持日常鍛煉;
⑶減少酒精的攝入,不要抽煙;
⑷慎用保健品。
2.3 心理狀態(tài)的調整
2.3.1 不良情緒的心理干預
乳腺癌患者的不良情緒主要集中在自尊、身體影響、焦慮和抑郁。
醫(yī)護人員需要了解患者的心理變化特點及心理狀態(tài)調整的過程,以提供必要的心理干預。醫(yī)護人員可以在認知、決策、應對技能等方面提升患者的自我控制能力,指導患者合理地運用暗示、宣泄等應對技巧,以增加對于困境的忍耐力。避免給予患者過多的同情與憐憫,向患者強調保持常態(tài)的重要性,幫助患者盡快擺脫患者角色,積極面對生活。
⑴提供充分信息,幫助患者理性接受患病事實。醫(yī)護人員可參與患者的認知矯正,幫助她們進行適當?shù)姆此迹瑴p少錯誤的想法,減輕患者的恐懼。
⑵幫助患者尋找積極的生存目的,建立生活的信心。醫(yī)護人員必須及時且正確地評估患者當前的期望,包括患者與其家屬之間的依賴關系。幫助患者意識到自身的價值,對家庭其他成員的重要性,以增加其與疾病抗爭的信心。
⑶激發(fā)患者的承擔意識,協(xié)助其有效地控制自我。實施以患者為中心的醫(yī)療護理模式,幫助患者充分發(fā)揮她們的決策權,激發(fā)她們的自我承擔意識。
2.4 性康復指導
⑴了解乳腺癌及其治療對性生活可能產生影響的全部信息。需要告訴她們的是導致女性產生性欲的性激素是雄激素。女性約一半的雄激素是由位于腎臟上方的腎上腺產生的,而卵巢產生另一半的雄激素。女性只需要很少量的雄激素就能維持性欲所需要的正常水平。
⑵無論將采用何種治療手段,經愛撫獲得愉悅的能力不會改變。
⑶試著享受其他感覺性愉悅的方式,伴侶間應該互相幫助,通過觸摸和愛撫來達到性高潮。
⑷與伴侶進行關于性問題的交流。沉默是性健康最大的敵人,如果永遠不敢開口咨詢,那么將永遠不會解脫。
相關建議:
⑴改善與伴侶有關性生活方面的溝通;⑵嘗試感性的按摩;
⑶讀一本性知識的好書,增加對性的知識和技巧;
⑷增加性幻想;
⑸與伴侶分享自己的性幻想;
⑹鼓勵伴侶在性活動中更積極主動;
⑺告訴伴侶以自己喜歡的方法來進行。
2.5 生育指導
雖然目前沒有證據(jù)顯示生育會影響乳腺癌患者的預后,但在選擇是否生育,以及何時生育時必須充分考慮患者疾病復發(fā)的風險和治療對后代的影響,與患者也要有充分的溝通。
⑴乳腺原位癌患者在結束了手術和放療之后即可考慮生育。
⑵淋巴結陰性的乳腺浸潤性癌患者在手術2年后可考慮生育
⑶淋巴結陽性的乳腺浸潤性癌患者在手術5年后可考慮生育。
⑷需要輔助內分泌治療的患者,在受孕前3個月停止內分泌治療(例如諾雷得、三苯氧胺或其他SERMs),直至生育后哺乳結束,再繼續(xù)內分泌治療。
2.6 術后隨訪指導
⑴早期乳腺癌患者在術后應定期隨訪,以了解患者的生存狀況,以及患者對輔助治療的依從性和不良反應等。
⑵隨訪時間:術后(或結束輔助化療后)第1~2年每3個月1次,第3~4年每4~6個月1次,第5年開始每年1~2次。
⑶隨訪檢查內容:觸診體檢、肝臟超聲、血生化和血常規(guī)。
⑷其他特殊檢查:乳房X線(每年1次),婦科檢查(三苯氧胺治療中每年1次),骨密度(芳香化酶抑制劑治療中)。
⑸骨掃描、CT或MRI等可用于有癥狀的患者,但不推薦無癥狀患者常規(guī)應用。
2.7 提供綜合社會支持,促進社會活動能力的恢復
醫(yī)護人員可以根據(jù)患者的需要,積極調動環(huán)境因素與社會資源,給患者提供幫助、鼓勵和支持,最大限度地恢復患者的社會功能。2000年,澳大利亞頒布了第一個關于對乳腺癌患者支持性照護的循證指南,稱為“心理社會的臨床實踐指南:為乳腺癌患者提供信息、咨詢和支持”。指南中特別建議所有的女性都應該得到治療小組的情感支持和社會支持,也應該得到同輩支持小組的信息和支持。從這一點可以看出,在乳腺癌患者的社會支持網(wǎng)絡中,應涵蓋專業(yè)支持,家庭支持和同輩支持。
綜合社會支持的內容:
⑴專業(yè)支持:以提供醫(yī)學信息和心理支持為主,可以開設康復課程、專業(yè)講座,設立康復熱線、康復值班室、康復網(wǎng)站,出版康復相關的書籍等。
⑵家庭支持:以鼓勵家屬參與患者的診治和康復過程為主,可以開設家屬信息咨詢窗口,為家屬提供交流平臺等。
⑶同輩支持:以康復病友志愿者的參與為主,可以采用病房探視或新病友座談會的形式,建議在醫(yī)護人員的專業(yè)指導和監(jiān)督下進行。
十二 乳房重建與整形臨床指南
1 乳房重建的目的
女性因各種原因,特別是接受乳房惡性腫瘤手術治療后,可能造成乳房的缺失或乳房外形的毀損。乳房重建可以幫助乳腺癌患者重塑身體外形,使兩側乳房基本對稱,能夠使患者在穿上衣著后,自信地恢復正常的社會和生活角色。
2 乳房重建的指征
乳房重建適合于因各種原因準備或已經接受乳房切除的女性,或因為保乳手術導致乳房明顯變形的患者。
3 乳房重建的類型
根據(jù)重建的時間,乳房重建可以分為即刻重建和延期重建兩大類。乳房重建可以在全乳切除的同時,在一次麻醉過程中完成,稱為即刻重建;也可以在全乳切除術后的數(shù)月或數(shù)年后進行,稱為延期重建,這一重建的時間往往取決于患者。乳房重建的時機選擇取決于很多因素,只有充分考慮了兩種重建手術的優(yōu)缺點,以及患者自身的諸多因素,才能確定最佳的時間。
根據(jù)重建的材料,乳房重建可以分為自體組織(皮瓣)重建、植入物重建以及聯(lián)合兩種材料(如背闊肌聯(lián)合植入物)的重建。
4 乳房重建的原則與注意事項
⑴乳腺癌手術后的乳房重建應該由一支專業(yè)的多學科團隊完成,在術前對患者進行充分評估,評估內容包括腫瘤治療策略、體型、個體及家屬的要求、合并的疾病及有無吸煙史,從而確定手術的安全切緣、乳房重建的最佳時機和方法、手術與輔助治療的順序安排。
⑵保留皮膚的全乳切除可以使接受即刻乳房重建后的乳房的美容效果得到極大的改善,證據(jù)顯示,與傳統(tǒng)的全乳切除手術比較,保留皮膚的全乳切除不會增加局部和區(qū)域的腫瘤復發(fā)風險。對于乳腺癌患者而言,保留乳頭乳暈復合體的全乳切除手術也受到關注,一些報道顯示,乳頭乳暈復合體受腫瘤累及的比例雖然較低,短期隨訪中仍有少部分病例發(fā)生局部復發(fā),但是目前仍缺乏長期的隨訪數(shù)據(jù);同時,保留乳頭乳暈復合體后,乳頭感覺、乳房外形自我滿意度等生活質量數(shù)據(jù)缺乏好的研究報告,這一術式應審慎開展,尚有待前瞻性臨床研究證實其安全性。
⑶保乳手術過程中,通常采用腫塊廣泛切除或更大范圍的區(qū)段/象限切除術,足夠安全的切緣距離意味著切除較大范圍的正常乳腺組織,有可能導致乳房局部腺體缺失,術后或放療后出現(xiàn)乳房變形、乳頭乳暈復合體移位等乳房外觀的不滿意。在不影響腫瘤局部治療效果的前提下,術前由腫瘤外科醫(yī)生或整形外科醫(yī)生對乳房的缺損進行評估,并做好相應準備,術中采用腫瘤整形手術技術,在缺損部位進行局部的充填,根據(jù)腫瘤部位、乳房大小和乳房下垂情況設計相應的切口。這一術式可以通過一次麻醉和手術過程完成,能在一定程度上改善乳房的形態(tài)與外觀。和常規(guī)保乳手術相同,也需要在原術腔放置4~6枚惰性金屬夾以備術后放療時作為瘤床的標記
⑷乳房重建的方法包括植入物、自體組織以及聯(lián)合上述兩種材料。植入物可以在乳房重建手術時,在胸大肌下方直接放置永久假體;或者先行放置組織擴張器,再擇期更換為永久假體。植入物可以使用鹽水囊假體、硅膠假體或含有硅膠外殼的鹽水囊混合型假體。自體組織重建可以選擇多種帶蒂或游離皮瓣,轉移至胸壁進行乳房塑型;最為常用的自體組織皮瓣包括:擴大背闊肌肌皮瓣、帶蒂橫型腹直肌肌皮瓣(TRAM)、游離橫型腹直肌肌皮瓣(F-TRAM)、保留肌束的游離TRAM(MSFTRAM)、腹壁下血管穿支皮瓣(DIEP)、臀上動脈穿支皮瓣(SGAP)等。游離皮瓣乳房重建涉及顯微外科技術,以及游離皮瓣的術后監(jiān)測團隊的建立。
⑸乳房重建和整形手術中尚需要考慮到其他的手術方式,包括乳頭乳暈重建,對側乳房的縮乳成型、乳房提升、隆乳,目的是達到雙側乳房的對稱效果;一般而言,這些手術往往分期實施,并應該在術前和患者充分溝通。
5 術后放療與乳房重建的關系
明確需要接受術后輔助放療的患者,首先考慮采用自體皮瓣的延期重建;放療可能對重建乳房的外形造成不利影響;有經驗的團隊可考慮即刻重建后再給予放療。當考慮進行組織擴張和植入物即刻重建時,建議先放置組織擴張器,在放療開始前或結束后更換為永久性假體。曾經接受放療的患者如果采用植入物重建,常發(fā)生較嚴重的包囊攣縮、移位、重建乳房美觀度差和植入物暴露,因此,放療后的延期乳房重建,不宜使用組織擴張器和植入物的重建方法。
十三 乳腺導管原位(內)癌治療指南
乳腺導管原位癌(ductal carcinoma in situ,DCIS),亦稱為導管內癌,屬于乳腺浸潤性癌的前驅病變,是一類非全身性的導管內局部病變。乳腺癌病理組織學分類中按細胞核形態(tài)將DCIS分為低、中、高三個級別,不同級別的DCIS可能具有不同的遺傳學起源和發(fā)生背景。DCIS具有進展為浸潤性癌的趨勢。極少數(shù)患者在確診為DCIS時伴腋淋巴結轉移。有些腋淋巴結轉移的患者也可能是由于腫瘤原發(fā)灶取材不當、未發(fā)現(xiàn)浸潤性成分造成的,這種情況下的DCIS與本指南所提的DCIS有著本質區(qū)別。部分DCIS患者存在DCIS伴微浸潤(AJCC分期將DCIS微浸潤定義為癌細胞突破基底膜并侵犯鄰近組織,但病灶最大徑不超過0.1 cm,分期為T1mic)。對于DCIS伴微浸潤的患者,目前國際上缺乏治療共識,本指南不作特別規(guī)定,以個體化治療策略為主。
DCIS的診斷,必須要以病理充分取材為前提,在排除潛在的浸潤成分以后,方可確診。空心針活檢、局部切除活檢,以及對病灶的不充分取材,都不是確診DCIS的依據(jù)。
1 治療原則
乳腺DCIS的治療目的是降低局部復發(fā)率。以局部治療為主,治療方式包括局部病灶廣泛切除聯(lián)合或不聯(lián)合全乳放療,以及全乳房切除術。必要時輔以內分泌治療(如他莫昔芬),主要目的是降低局部復發(fā),及預防同側和對側再發(fā)。對DCIS患者,沒有證據(jù)提示化療能帶來生存獲益;也沒有證據(jù)顯示Her-2陽性(針對導管內癌成分)患者能夠從曲妥珠單抗治療中獲益。
2 局部廣泛切除聯(lián)合全乳腺放療
2.1 適應人群,禁忌證,術前準備,手術過程,術后病理檢查
請參見“浸潤性乳腺癌保乳治療臨床指南”相關章節(jié)。
對于腋窩淋巴結的處理,請參見“前哨淋巴結活檢”相關章節(jié)。
2.2 全乳放療
⑴全乳放療在術后乳腺切口愈合后就可以開始,推薦在術后8周內開始。
⑵放射治療的基本技術以及劑量請參見“浸潤性乳腺癌保乳治療臨床指南”相關章節(jié)。和浸潤性癌原則相似,仍推薦全乳照射后瘤床加量,尤其在對絕經前患者的治療中。
2.3 輔助內分泌治療
⑴適應證:ER/PR陽性的乳腺導管內癌(注意:若單純以預防對側第二原發(fā)乳腺癌為目的,激素受體陰性患者也可接受他莫昔芬預防用藥)。
⑵目的:降低同側復發(fā)和對側第二原發(fā)乳腺癌。
⑶劑量:放療結束后建議采用他莫昔芬20 mg/d(10 mg每日2次),連續(xù)服用5年,治療期間應每半年至一年行1次婦科檢查。對于老年(>65歲)、伴有心血管疾病的患者,應充分權衡他莫昔芬?guī)淼墨@益與心血管事件間的利弊。
3 其他治療選擇
3.1 全乳房切除術
⑴適應證:所有不適合或拒絕接受保留乳房治療的患者。
⑵方法:單純乳房切除術、保留乳頭乳暈的全乳房切除術(病灶位于乳頭乳暈的不適用)、保留皮瓣的全乳房切除術。
⑶注意事項:皮下乳房切除術難以100%地切除乳腺腺體組織,因此全乳房切除術并不能完全避免局部復發(fā)。
⑷術后不需要聯(lián)合放療。
3.2 單純局部切除術
目前僅推薦用于個別年齡>70歲,或伴有嚴重內科疾病,或因其他原因無法接受全乳房切除術和全乳放療,或Van Nays預后指數(shù)提示低危的患者。術后仍建議對ER/PR陽性、無他莫昔芬禁忌證的患者采用他莫昔芬治療5年。
4 乳腺DCIS治療方式選擇的參考——Van Nays預后指數(shù)
國外某些學者采用Van Nays預后指數(shù)(簡稱VNPI)作為一個客觀的指標以協(xié)助臨床醫(yī)生對DCIS治療方式進行決策。VNPI對DCIS按腫瘤大小、患者年齡、手術切緣、腫瘤細胞核分級4個方面綜合考慮,每一方面評分由1分(最佳)至3分(最差),4個方面總分由最低的4分(最佳)至最高的12分(最差)。VNPI 10~12分者建議行全乳切除術,VNPI 4~6分者可行單純局部切除術,而VNPI 7~9分者則建議行局部廣泛切除聯(lián)合全乳放療。VNPI的具體評分方法詳見附錄Ⅸ。
注:目前對于VNPI的臨床應用價值仍有爭議,在此僅供臨床醫(yī)師參考。
十四 Her-2陽性乳腺癌臨床診療專家共識
腫瘤分子靶向治療,是利用腫瘤細胞表達而正常細胞很少或不表達的特定基因或基因的表達產物作為治療靶點,最大程度殺死腫瘤細胞而對正常細胞殺傷較小的治療模式。人類表皮生長因子受體2(Her-2)是乳腺癌明確的預后指標和藥物治療效果的預測指標。作為第一個靶向Her-2的人源化單克隆抗體,曲妥珠單抗的問世改變了Her-2陽性乳腺癌患者的預后,影響了乳腺癌的診治模式,是乳腺癌藥物治療的重要突破。2007年拉帕替尼作為晚期乳腺癌二線治療藥物也在歐美批準上市,盡管目前在中國尚未上市,但其臨床試驗也正在中國部分醫(yī)院進行。為了更好地推廣規(guī)范的Her-2檢測,準確評估患者預后,更大地發(fā)揮Her-2靶向治療藥物使用的療效,減少治療盲目性,使更多患者獲益,中國抗癌協(xié)會乳腺癌專業(yè)委員會專家組成員,根據(jù)現(xiàn)有國內外研究結果討論后達成以下共識。
1 標準Her-2檢測和結果判定
⑴Her-2是乳腺癌重要的預后指標,同時也是靶向Her-2藥物的預測指標。
⑵靶向Her-2藥物治療適應證是Her-2陽性乳腺癌。
⑶Her-2陽性的定義,可以是標準免疫組化(IHC)+++,或原位熒光雜交法(FISH)陽性。
⑷如果患者免疫組化檢測顯示Her-2(+++),可以直接判斷為Her-2陽性;
如果免疫組化檢測Her-2 (++),應該再進行FISH檢測以明確。如果標準實驗室免疫組化檢測結果 Her-2 (+)或 Her-2 (-) ,則判斷為Her-2陰性。
⑸Her-2陽性判斷也可以通過FISH檢測。在合格實驗室進行的FISH檢測,比值>2.2則可判斷為Her-2陽性;<1.8則為Her-2陰性患者;如果所得結果為1.8~2.2的臨界值,則應該結合免疫組化結果判斷。
⑹如果患者病情發(fā)展不符合Her-2陰性患者特點,臨床認為有可能是Her-2陽性,或者復發(fā)轉移患者治療過程中為了爭取治療機會,建議進行Her-2的重新檢測,可以用原發(fā)腫瘤標本,但更提倡復發(fā)病灶再活檢,方法可以用IHC或FISH。
2 Her-2陽性復發(fā)轉移乳腺癌治療原則
2.1 治療原則
⑴Her-2陽性晚期復發(fā)轉移乳腺癌,首選治療應該是含曲妥珠單抗為基礎的治療,根據(jù)患者激素受體狀況、既往(新)輔助治療用藥情況,選擇治療方案,使患者最大受益。
⑵曲妥珠單抗單藥治療Her-2陽性轉移性乳腺癌有一定療效,但更多臨床研究顯示,曲妥珠單抗與化療藥物聯(lián)合效果更好。Slamon等發(fā)表在新英格蘭醫(yī)學雜志(NEJM)的曲妥珠單抗聯(lián)合紫杉醇,Marty等發(fā)表在臨床腫瘤學雜志(JCO)的曲妥珠單抗聯(lián)合多西紫杉醇的兩項關鍵Ⅲ期臨床研究結果,奠定了曲妥珠單抗聯(lián)合紫杉類藥物作為Her-2陽性晚期乳腺癌一線治療的地位。所以蒽環(huán)類化療失敗的Her-2 陽性乳腺癌,曲妥珠單抗聯(lián)合紫杉醇或多西紫杉醇,可以作為首選的一線方案。
⑶紫杉類治療失敗的Her-2陽性乳腺癌,曲妥珠單抗可以聯(lián)合長春瑞濱、鉑類、卡培他濱、吉西他濱等其他化療藥物。
⑷研究結果顯示,曲妥珠單抗聯(lián)合阿那曲唑一線治療Her-2同時ER/PR陽性晚期乳癌,無進展生存期、臨床獲益率和至疾病進展時間均顯著優(yōu)于阿那曲唑單藥。所以Her-2與激素受體陽性的絕經后轉移性乳腺癌患者,可以采用曲妥珠單抗聯(lián)合芳香化酶抑制劑治療。
2.2 曲妥珠單抗治療疾病進展后治療策略
⑴繼續(xù)使用曲妥珠單抗,更換其他化療藥物:傳統(tǒng)細胞毒藥物治療,出現(xiàn)疾病進展意味著需要更換治療方案。但曲妥珠單抗由于其不同的作用機制,患者曾經治療有效而其后出現(xiàn)疾病進展時并不一定需要停藥。臨床前研究顯示,持續(xù)應用曲妥珠單抗抑制Her-2表達有助于控制乳腺癌細胞生長,而停止曲妥珠單抗,腫瘤生長加快。Hermine研究顯示,一線使用曲妥珠單抗疾病進展后,繼續(xù)使用曲妥珠單抗比停止使用曲妥珠單抗治療療效更好。GBG 26/BIG03-05隨機臨床試驗中,曲妥珠單抗治療疾病進展轉移性Her-2陽性乳腺癌,隨機分為單用卡培他濱和卡培他濱聯(lián)合曲妥珠單抗,結果顯示疾病進展后繼續(xù)使用曲妥珠單抗的治療仍能取得更長的無疾病進展時間。因此,Her-2陽性乳腺癌曲妥珠單抗聯(lián)合化療治療出現(xiàn)疾病進展后,可保留曲妥珠單抗繼續(xù)使用,而換用其他聯(lián)合化療方案。
⑵拉帕替尼聯(lián)合卡培他濱:臨床研究證明,曲妥珠單抗治療失敗的乳腺癌,拉帕替尼聯(lián)合卡培他濱比單用卡培他濱的至疾病進展時間延長,所以曲妥珠單抗方案治療后疾病進展Her-2陽性患者也可以選擇拉帕替尼聯(lián)合卡培他濱。
⑶還可以考慮曲妥珠單抗聯(lián)合拉帕替尼的非細胞毒藥物的方案。
3 Her-2陽性乳腺癌曲妥珠單抗輔助治療原則
臨床研究結果表明,曲妥珠單抗用于Her-2陽性早期乳腺癌術后輔助治療, 可明顯降低復發(fā)和死亡。因此美國綜合癌癥網(wǎng)(NCCN)和中國cNCCN乳腺癌臨床實踐指南都將曲妥珠單抗輔助治療寫入其中。
3.1 Her-2 陽性乳腺癌曲妥珠單抗輔助治療用藥推薦
⑴AC-TH:多柔比星(或表柔比星)聯(lián)合環(huán)磷酰胺,1/21 d×4個周期,然后紫杉醇或多西紫杉醇4個周期,同時曲妥珠單抗周療2 mg/kg(首劑 4 mg/kg),或3周1次6 mg/kg(首劑8 mg/kg),共1年。
⑵不適合蒽環(huán)藥物的患者可以用TCH:多西紫杉醇75 mg/m2,卡鉑 AUC 6,每21 d為1個周期,共6個周期,同時曲妥珠單抗周療, 化療結束后曲妥珠單抗6 mg/kg,3周1次,至1年。
⑶標準化療后單用曲妥珠單抗治療1年,曲妥珠單抗6 mg/kg(首劑 8 mg/kg),每3周方案,治療時間為1年。
⑷HERA研究4年隨訪結果顯示,對于術后初始未接受曲妥珠單抗治療的Her-2陽性乳腺癌,延遲使用曲妥珠單抗輔助治療也可以獲益,因此輔助化療已經結束, 但仍處于無病狀態(tài)的患者可以使用1年曲妥珠單抗。
目前認為,Her-2陽性乳腺癌曲妥珠單抗輔助治療,合適的用藥周期為 1年,因為Finher最新隨訪結果并沒有證明短程的9周曲妥珠單抗治療能改善預后,所以目前并不推薦曲妥珠單抗輔助治療9周方案,同樣至今也無證據(jù)表明2年輔助治療的效果更好。
3.2 曲妥珠單抗在輔助治療中的心臟毒性
曲妥珠單抗聯(lián)合化療藥物可能增加心肌損害,嚴重者會發(fā)生心力衰竭。盡管NSABP B-31、N9831和HERA三項試驗中心臟毒性事件數(shù)不高并且可以恢復,但臨床研究入選的病例是化療后經過心臟功能安全篩選的。臨床實踐中建議在對既往史、體格檢查、心電圖、超聲心動圖LVEF基線評估后再開始應用曲妥珠單抗,使用期間應該每3個月監(jiān)測心功能。若患者有無癥狀性心功能不全,監(jiān)測頻率應更高(如每6~8周1次),出現(xiàn)下列情況時,應停止曲妥珠單抗治療至少4周,并每4周檢測1次LVEF:
⑴LVEF較治療前絕對數(shù)值下降≥16%。
⑵LVEF低于該檢測中心正常范圍并且LVEF較治療前絕對數(shù)值下降≥10%。
⑶4~8周內LVEF回升至正常范圍或LVEF較治療前絕對數(shù)值下降≤15%,可恢復使用曲妥珠單抗。
⑷LVEF持續(xù)下降(>8周),或者3次以上因心肌病而停止曲妥珠單抗治療,應永久停止使用曲妥珠單抗。
4 Her-2陽性乳腺癌的含曲妥珠單抗新輔助治療
臨床試驗研究證明,術前新輔助治療獲得病理學完全緩解(pCR)患者無病生存(DFS)和總生存(OS)均優(yōu)于同樣治療未達到pCR的患者。Her-2 陽性患者新輔助治療,曲妥珠單抗聯(lián)合化療與單用化療相比能夠顯著提高pCR率。Buzdar新輔助治療試驗中,曲妥珠單抗聯(lián)合紫杉醇序貫CEF化療的pCR率高達65.2%,顯著高于單純化療組的26.3%(P=0.016)。NOAH研究結果顯示,Her-2陽性局部晚期乳腺癌,曲妥珠單抗聯(lián)合AT/T/CMF方案能顯著提高pCR率(43%vs23%,P=0.002)。但現(xiàn)有新輔助治療數(shù)據(jù)相對不足,臨床考慮方案應該慎重,而設計臨床研究方案更要謹慎考慮科學性和倫理學原則。要注意短期的曲妥珠單抗聯(lián)合化療使用,可能獲得更高的pCR, 但并不一定獲得更長的無病生存,更難以確定OS的改善,所以不能代替后續(xù)長期的輔助治療。
因此術前新輔助治療用過曲妥珠單抗的患者,術后輔助推薦曲妥珠單抗,治療總療程 1年。Her-2陽性乳腺癌患者如果術前新輔助治療未用過曲妥珠單抗,術后輔助治療推薦曲妥珠單抗。
現(xiàn)代乳腺癌診斷和分類,應該是在標準的傳統(tǒng)病理組織學基礎上,添加更好的免疫組化診斷和更新的分子病理診斷。乳腺癌的科學合理綜合治療,有賴于病理科、影像科室和臨床有關學科合作,在國內外治療指南和臨床診療專家共識的基礎上規(guī)范預后指標和預測指標的檢測,合理治療、提高患者生活質量與生存率。
十五 乳腺癌局部和區(qū)域淋巴結復發(fā)診治指南
1 局部和區(qū)域復發(fā)的定義
局部復發(fā)是指早期乳腺癌乳房保留治療后同側乳腺內,或可手術乳腺癌乳房切除術后同側胸壁再次出現(xiàn)腫瘤;區(qū)域復發(fā)是指患側的淋巴引流區(qū),包括腋窩、鎖骨上/下及內乳淋巴結區(qū)域出現(xiàn)腫瘤。孤立性復發(fā)是指在發(fā)現(xiàn)局部-區(qū)域復發(fā)時,通過常規(guī)檢查未發(fā)現(xiàn)合并其他部位的轉移。
2 診斷
完整全面地檢查以明確復發(fā)時有無合并遠處轉移。
細針穿刺雖然可以提供復發(fā)的依據(jù),但仍需要獲得復發(fā)灶的組織診斷,并確定復發(fā)病變的生物學標志物(ER、PR和Her-2)狀態(tài)。
影像學(包括功能影像)診斷,需要覆蓋完整的胸壁和區(qū)域淋巴結。如果復發(fā)患者既往曾接受術后放療,則診斷復發(fā)時的影像學檢查還需要增加對有無放射性肺損傷的評估。如接受過術后放療的患者出現(xiàn)臂叢神經癥狀或上肢水腫,且臨床無明顯淋巴結腫大,推薦行增強MRI或PET-CT掃描,有助于鑒別復發(fā)和放射性纖維化。18-FDG PET-CT對于復發(fā)患者評估復發(fā)的完整范圍、有無遠處轉移,以及術后改變與放射性損傷之間的鑒別都有優(yōu)于傳統(tǒng)影像的優(yōu)勢。
3 治療原則
無論乳房保留治療后復發(fā)還是乳房切除術后復發(fā),均需要多學科評估和治療,以最大程度優(yōu)化治療原則,目的在于一方面有效地控制局部疾病,另一方面盡可能地減少或延遲再次復發(fā)或遠處轉移的發(fā)生。
3.1 保乳術后同側乳房復發(fā)
⑴單灶復發(fā)或可手術的復發(fā)患者,補救性乳房切除是最主要的局部治療手段,可以獲得60%~70%的5年局部控制率和約85%的總生存率。同時如果首次手術時未行腋窩淋巴結清掃,乳房切除術的同時可行I/II組腋窩淋巴結清掃。若以往曾經行腋窩淋巴結清掃,經臨床或影像學檢查發(fā)現(xiàn)淋巴結侵犯證據(jù)時可行腋窩手術探查或補充清掃。
⑵若復發(fā)范圍廣泛或累及皮膚,甚至呈現(xiàn)炎性乳腺癌表現(xiàn),則需先行全身治療后再考慮局部手術和(或)放療。
⑶補救性乳房切除術后一般不考慮胸壁放療,但如腋窩淋巴結有轉移而既往未行區(qū)域淋巴結照射的患者需補充鎖骨上/下淋巴結的照射。
3.2 乳房切除術后復發(fā)
與保乳術后孤立乳房內復發(fā)患者相比,乳房切除術后胸壁和區(qū)域淋巴結復發(fā)的患者預后較差。同時首發(fā)胸壁復發(fā)患者,后續(xù)鎖骨上淋巴結復發(fā)率較高。而首發(fā)區(qū)域淋巴結復發(fā)的患者,后續(xù)胸壁復發(fā)率也可高達30%。所以在既往沒有接受過術后放療的患者,在首次復發(fā)行放療時,需包括易再次復發(fā)的高危區(qū)域。
3.3 胸壁復發(fā)
胸壁結節(jié)可切除者,推薦局部廣泛切除。但是單純手術切除的后續(xù)再次復發(fā)率可達60%~75%,放射治療可以顯著降低再次復發(fā)率,是局部區(qū)域性復發(fā)患者綜合治療的主要手段之一。首次復發(fā)患者局部小野照射會帶來高達50%以上的再次復發(fā)率,且小野照射后再次復發(fā)中有2/3位于原射野以外,所以在既往沒有接受過術后放療的患者中照射靶區(qū)需要覆蓋患側全胸壁,并需要對鎖骨上/下淋巴引流區(qū)進行預防性照射。彌漫性復發(fā)患者,需要先行全身治療,根據(jù)局部病變的退縮情況并排除遠處轉移后,再行胸壁和區(qū)域淋巴結的放療。
對于以往曾經行術后放療的患者,再次照射的價值尚未證實,若復發(fā)病變不能手術或切除不完全,在充分考慮術后放療與復發(fā)的時間間隔,放療后正常組織改變的程度、局部-區(qū)域復發(fā)的風險,并且平衡了再照射的風險和益處之后,可針對復發(fā)病變局部再照射。
3.4 孤立的腋窩淋巴結復發(fā)
手術切除為主要的治療手段,若以往未行腋窩淋巴結清掃,則需要補充清掃。而腋清掃后復發(fā)患者如可手術,則對復發(fā)灶行補充切除。在既往無術后放療的患者補充腋清掃后,需對鎖骨上/下淋巴引流區(qū)和胸壁行預防性照射。對于復發(fā)病變無法完全切除的患者,照射范圍還需包括腋窩。
3.5 鎖骨上淋巴結復發(fā)
如既往未行放療,放療靶區(qū)需包括鎖骨上/下淋巴引流區(qū)和胸壁;如既往有乳房和胸壁照射史,可單獨給予鎖骨上/下淋巴引流區(qū)的放療,照射野需與原射野銜接。
3.6 內乳淋巴結復發(fā)
同鎖骨上淋巴結復發(fā)處理原則,如既往無胸壁照射史,放療范圍需要包括患側胸壁。但胸壁和其他區(qū)域淋巴結復發(fā)患者,在放療靶區(qū)的選擇上,原則上不需要對內乳區(qū)進行預防性照射。
3.7 放射治療技術
和二維治療相比,基于CT定位的三維治療計劃可以顯著提高靶區(qū)覆蓋程度,并合理評估正常組織照射體積和劑量,推薦在復發(fā)患者中盡可能采用。全胸壁和區(qū)域淋巴結照射劑量達到50 Gy/25 f或相應的生物等效劑量后對復發(fā)灶需要加量至60 Gy,對未切除的復發(fā)灶照射劑量需要達到60 Gy以上,但必須控制正常組織損傷。加熱配合局部放療可以在一定程度上改善局部控制率。
3.8 全身治療策略
全身治療在下列情況下需要考慮:激素受體陽性患者內分泌治療,具有可持續(xù)治療和降低再次復發(fā)率的價值;復發(fā)灶廣泛乃至放射治療難以覆蓋完整的靶區(qū);同期放化療可以提高局部控制率;Her-2陽性患者可以聯(lián)合靶向治療。和其他復發(fā)轉移患者的治療原則一致,推薦局部-區(qū)域復發(fā)患者參加前瞻性臨床研究。
十六 乳腺癌骨轉移的臨床診療指南
1 概述
在晚期乳腺癌中,骨轉移的發(fā)生率為65%~75%,而首發(fā)癥狀為骨轉移者占27%~50%。骨痛、骨損傷、骨相關事件(SREs)及生活質量降低是乳腺癌骨轉移常見的并發(fā)癥。骨相關事件包括:骨痛加劇或出現(xiàn)新的骨痛、病理性骨折(椎體骨折、非椎體骨折)、椎體壓縮或變形、脊髓壓迫、骨放療(因骨痛或防治病理性骨折或脊髓壓迫)、骨轉移病灶進展(出現(xiàn)新發(fā)、多發(fā)骨轉移、原有骨轉移灶擴大)及高鈣血癥。
2 骨轉移的診斷方法
骨放射性核素掃描(ECT)是骨轉移初篩診斷方法。具有靈敏度高、早期發(fā)現(xiàn)、全身成像不易漏診的優(yōu)點。但也存在特異度較低、不易區(qū)分成骨性還是溶骨性病變、也不能顯示骨破壞程度的缺點。骨ECT檢查推薦用于乳腺癌出現(xiàn)骨疼痛、骨折、堿性磷酸酶升高、高鈣血癥等可疑骨轉移的常規(guī)初篩診斷檢查;乳腺癌分期>T3N1M0患者的進一步行常規(guī)分期檢查。骨ECT檢查也可選擇性用于乳腺癌患者 的常規(guī)分期檢查。
磁共振掃描(MRI)、或CT掃描、X線拍片是骨轉移的影像學確診檢查方法。對于骨ECT掃描異常的患者,應該針對可疑骨轉移灶部位進行MRI、CT、X線拍片檢查,以確認骨轉移診斷,并了解骨破壞的嚴重程度。
正電子發(fā)射計算機斷層顯像(PET-CT),可以直接反映腫瘤細胞對葡萄糖的攝入,已有臨床研究提示 FDG-PET具有與骨掃描相似的靈敏度,更高的特異度,對乳腺癌骨轉移治療后病情的跟蹤優(yōu)于骨掃描,但是專家組認為目前PET-CT在骨轉移診斷的價值有待進一步研究,臨床并不作為常規(guī)推薦。
所以骨轉移的臨床診斷,ECT可以作為初篩檢查,X 線、CT、MRI 可以明確有無骨質破壞,PET-CT的價值有待進一步研究,臨床上各種診斷方法應該合理應用,必要時需要通過骨活檢取得病理診斷。
對于確診骨轉移的乳腺癌患者,應進一步常規(guī)檢查:血常規(guī)、肌酐、血鈣等肝腎功能及血生化指標檢查;胸、腹、骨盆影像學檢查。
3 乳腺癌骨轉移的臨床表現(xiàn)
乳腺癌骨轉移多見為多發(fā)性溶骨性病變,有些患者在溶骨病變治療后的修復可以在影像學中表現(xiàn)為過度鈣化而被誤診為成骨性改變,對這部分患者應追溯其首診時的X片是否有溶骨性改變。
乳腺癌骨轉移的特點:伴有疼痛的骨轉移嚴重影響患者生活質量,但骨轉移本身一般不直接對生命構成威脅;有效的治療手段較多,不合并內臟轉移的患者生存期相對較長。
4 骨轉移的治療
4.1 治療目標
乳腺癌骨轉移綜合治療的主要目標:
① 緩解疼痛,恢復功能,改善生活質量;
②預防和治療骨相關事件;
③ 控制腫瘤進展,延長生存期。
4.2 治療方案
乳腺癌骨轉移,作為復發(fā)轉移性乳腺癌已經是全身性疾病,可以選擇的治療手段有:①化療、內分泌治療、分子靶向治療等;②雙膦酸鹽治療;③手術治療;④放射治療;⑤鎮(zhèn)痛和其他支持治療。應根據(jù)患者具體病情制定個體化綜合治療方案(圖1)。
4.3 治療原則
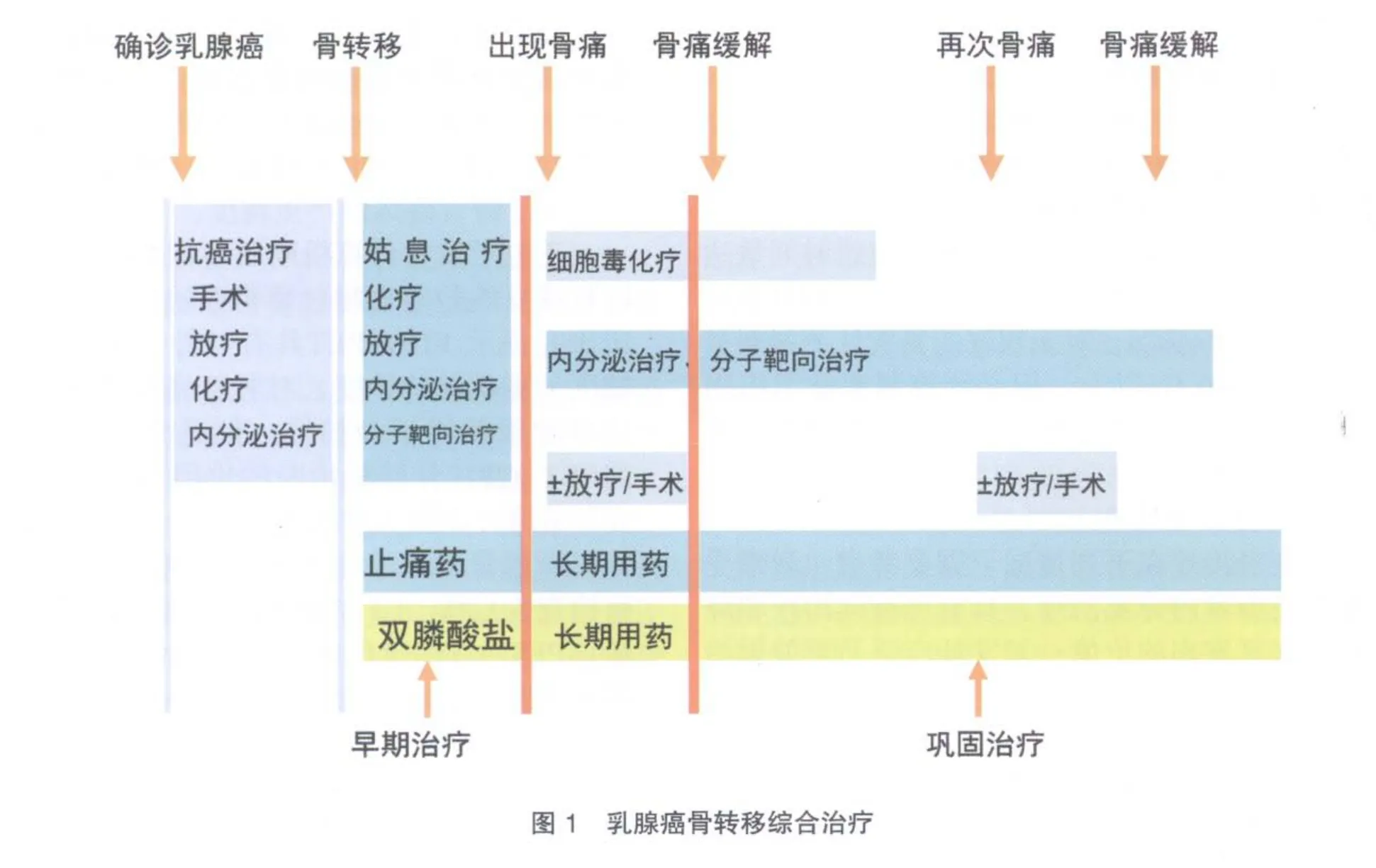
全身治療為主,其中化療、內分泌治療、分子靶向治療作為復發(fā)轉移性乳腺癌的基本藥物治療,雙膦酸鹽類可以預防和治療骨相關事件。合理的局部治療可以更好地控制骨轉移癥狀,其中手術是治療單發(fā)骨轉移病灶的積極手段,放射治療是有效的局部治療手段。
復發(fā)轉移性乳腺癌選擇治療方案,要考慮患者腫瘤組織的激素受體狀況(ER/PR)、Her-2情況、年齡、月經狀態(tài)以及疾病進展是否緩慢。原則上疾病進展緩慢的激素反應性乳腺癌患者可以首選內分泌治療,疾病進展迅速的復發(fā)轉移患者應首選化療,而Her-2過表達的患者可以考慮單用或聯(lián)合使用曲妥株單抗治療。
進展緩慢的復發(fā)轉移性乳腺癌的特點:
⑴原發(fā)和(或)復發(fā)轉移灶腫瘤組織ER陽性和(或)PR陽性;
⑵術后無病生存期較長的復發(fā)轉移患者(如術后2年后出現(xiàn)復發(fā)轉移);
⑶僅有軟組織和骨轉移,或無明顯癥狀的內臟轉移(如非彌散性的肺轉移和肝轉移,或腫瘤負荷不大且不危及生命的其他內臟轉移)。
激素反應性(hormone responsive)乳腺癌的概念,是基于患者可能從內分泌治療中獲益的角度來界定哪些患者適合內分泌治療,認為滿足下列條件中1條或數(shù)條的患者有可能從內分泌治療中獲益:
⑴原發(fā)灶和(或)復發(fā)轉移灶ER和(或) PR陽性。
⑵老年患者。
⑶術后無病間期較長。
⑷既往內分泌治療曾獲益。
基于乳腺癌骨轉移本身一般不直接構成生命威脅,且不合并內臟轉移的患者生存期相對較長,因此盡量避免不必要的強烈化療。而晚期乳腺癌患者,如治療后疾病長期保持穩(wěn)定則應視為臨床獲益,因為持續(xù)穩(wěn)定6個月以上的患者生存期與CR+PR相同。基于內分泌治療更適合長期用藥,可以盡量延長治療用藥時間,延長疾病控制時間。
絕經后復發(fā)轉移性乳腺癌,一線內分泌治療的首選為第3代芳香化酶抑制劑,包括阿那曲唑、來曲唑、依西美坦,因為在三苯氧胺治療失敗的復發(fā)轉移性乳腺癌的二線治療中,第3代芳香化酶抑制劑比甲地孕酮更有效。在復發(fā)轉移性乳腺癌的一線內分泌治療中,新一代的芳香化酶抑制劑明顯優(yōu)于三苯氧胺。絕經前復發(fā)轉移性乳腺癌患者首選化療,適合或需要用芳香化酶抑制劑作為內分泌治療時,可以采取藥物性卵巢功能抑制聯(lián)合芳香化酶抑制劑。乳腺癌骨轉移患者,如ER和PR陰性、術后無病間隔期短、疾病進展迅速、合并內臟轉移、對內分泌治療無反應者應考慮化療。推薦用于轉移性乳腺癌化療的藥物包括:蒽環(huán)類、紫杉類、卡倍他濱、長春瑞濱、吉西他濱。可以選擇化療方案有:CMF、CAF、AC、AT、XT、GT方案。輔助治療僅用內分泌治療而未用化療的患者可以選擇CMF(CTX/MTX/5-FU)、CAF(CTX/ADM/5-FU)或AC(ADM/CTX)方案。輔助治療未用過蒽環(huán)類和紫杉類化療的患者首選AT方案(蒽環(huán)類聯(lián)合紫杉類),如CMF輔助化療失敗的患者;部分輔助治療用過蒽環(huán)類和(或)紫杉類化療,但臨床未判定為耐藥和治療失敗的患者也可使用AT方案。蒽環(huán)類輔助治療失敗的患者,可以選擇的方案有:XT(卡倍他濱聯(lián)合多西他賽)和GT(吉西他濱聯(lián)合紫杉醇)方案。紫杉類治療失敗的患者,目前尚無標準方案推薦,可以考慮的藥物有卡倍他濱、長春瑞濱、吉西他濱和鉑類,可以單藥或聯(lián)合化療。但單純骨轉移患者一般不采用聯(lián)合化療。
4.4 放射治療
放射治療是乳腺癌骨轉移姑息性治療的有效方法。骨疼痛是骨轉移的常見癥狀,也是影響患者生活質量及活動能力的主要原因。脊椎、股骨等負重部位骨轉移并發(fā)病理性骨折的危險性約30%,病理性骨折將顯著影響患者的生存質量和生存時間。放射治療用于乳腺癌骨轉移治療的主要作用:緩解骨疼痛、減少病理性骨折的危險。
放射治療方法包括體外照射與放射性核素治療2類。
體外照射是骨轉移姑息治療的常用有效方法。體外照射的主要適應證:有癥狀的骨轉移灶,用于緩解疼痛及恢復功能;選擇性用于負重部位骨轉移的預防性放療,如脊柱或股骨轉移。骨轉移放射治療的體外照射常用劑量及分割方法有3種方案:300 cGy/f,共10次;400 cGy/f,共5次;800 cGy/f,單次照射。3種方法照射的緩解骨疼痛的療效及耐受性無明顯差異。單次放療方案的治療費用顯著低于分次照射,但再放療及病理性骨折發(fā)生率高于分次放療。骨轉移單次照射技術尤其適于活動及搬動困難的晚期癌癥患者。
放射性核素治療對緩解全身廣泛性骨轉移疼痛有一定療效,但是有些核素治療后骨髓抑制發(fā)生率較高,而且恢復較緩慢,約需12周,可能會影響化療的實施。因此,放射性核素治療的臨床使用應充分考慮選擇合適的病例和恰當?shù)臅r機。
放射治療緩解骨痛的有效率為59%~88%。值得注意的是放療緩解骨痛的顯效需要一定的時間,因此對于在放射治療明顯顯效前的患者及放射治療不能完全控制疼痛的患者,仍然需要根據(jù)患者的疼痛程度使用止痛藥以及必要的雙膦酸鹽治療,可以使用負荷劑量。
4.5 手術治療
骨轉移外科治療目的是提高患者生活質量,骨外科技術的進步能夠使癌癥骨轉移患者最大限度解決對神經的壓迫、減輕疼痛、恢復肢體功能,從而改善患者生活質量。應對骨轉移患者密切隨訪觀察、早期發(fā)現(xiàn)骨轉移灶、對具有潛在病理骨折的長骨是否需要手術作出恰當?shù)呐袛嗍翘岣呋颊呱钯|量的重要保證。
外科手術治療乳腺癌骨轉移的方法包括:骨損傷固定術、置換術和神經松解術。固定術治療可考慮選擇性用于病理性骨折或脊髓壓迫,預期生存時間>4周的乳腺癌骨轉移患者。預防性固定術治療可考慮選擇性用于股骨轉移灶直徑>2.5 cm,或股骨頸骨轉移,或骨皮質破壞>50%,預期生存時間>4周的乳腺癌骨轉移患者。
4.6 止痛藥治療
止痛藥是緩解乳腺癌骨轉移疼痛的主要方法。骨轉移疼痛的止痛藥治療應遵循WHO癌癥三階梯止痛指導原則:首選口服及無創(chuàng)給藥途徑;按階梯給藥;按時給藥;個體化給藥;注意具體細節(jié)。
止痛藥物包括非甾體類抗炎止痛藥、阿片類止痛藥、輔助用藥。
常用非甾體類抗炎藥包括:乙酰氨基酚、布洛芬、雙氯芬酸鈉、吲哚美辛、萘普生、塞來昔布、氯諾昔康等。
常用阿片類止痛藥包括:嗎啡緩釋片、芬太尼透皮貼劑、羥考酮控釋片、嗎啡即釋片、可待因、美沙酮等。哌替啶不宜用于癌痛治療。
輔助用藥包括三環(huán)類抗抑郁藥、抗驚厥類藥、神經弛緩劑和糖皮質激素等。
非甾體類抗炎藥是骨轉移疼痛藥物止痛治療的基礎用藥,當止痛效果不佳時,或出現(xiàn)中重度疼痛時,推薦合用阿片類止痛藥。選擇阿片緩釋劑按時用藥,有利于持續(xù)緩解骨疼痛。然而,骨轉移疼痛患者在持續(xù)慢性疼痛的同時,大約63%的骨轉移患者伴有突發(fā)性(爆發(fā)性)疼痛。對頻繁發(fā)作的突發(fā)性疼痛的患者,可以通過增加止痛藥的按時用藥劑量緩解疼痛。對少數(shù)患者則無法通過增加止痛藥按時用藥劑量控制疼痛,甚至因無法耐受藥物不良反應而不能增加按時用藥的劑量。控制突發(fā)性疼痛的主要方法是備用速效或短效止痛藥。控制突發(fā)性疼痛的短效止痛藥單次用藥劑量一般為日用劑量的5%~10%。對于難治的突發(fā)性疼痛患者,可考慮使用患者自控藥泵法給藥。發(fā)生神經病理性疼痛時, 應根據(jù)病情選擇輔助用藥。例如出現(xiàn)灼痛、墜脹痛等表現(xiàn)時,可選擇合用阿米替林、去甲替林或多慮平等三環(huán)類抗抑郁劑;出現(xiàn)電擊樣疼痛或槍擊樣疼痛等表現(xiàn)時,可選擇合用加巴噴丁或卡馬西平等抗驚厥劑。止痛藥可與雙膦酸鹽類藥、放療等方法綜合治療。
5 乳腺癌骨轉移雙膦酸鹽臨床應用專家共識
5.1 雙膦酸鹽類藥物的共性和個性
5.1.1 作用原理
雙膦酸鹽是焦膦酸鹽分子的穩(wěn)定類似物。破骨細胞聚集于礦化骨基質后,通過酶水解作用導致骨重吸收,而雙膦酸鹽可以抑制破骨細胞介導的骨重吸收作用。雙膦酸鹽可以抑制破骨細胞成熟,抑制成熟破骨細胞的功能,抑制破骨細胞在骨質吸收部位的聚集,抑制腫瘤細胞擴散、浸潤和黏附于骨基質。
5.1.2 適應證
①高鈣血癥,②骨痛,③治療和預防骨相關事件(SREs)。SREs對乳腺癌骨轉移患者的生活質量具有至關重要的影響,它包括病理性骨折、脊髓壓迫、為了緩解骨痛或預防和治療病理性骨折或脊髓壓迫而進行放療、骨骼手術、改變抗癌方案以治療骨痛、惡性腫瘤所至高鈣血癥。目前在乳腺癌骨轉移中使用雙膦酸鹽的主要目的正是降低SREs的發(fā)生率。
臨床研究證實雙膦酸鹽可以有效治療乳腺癌的骨轉移。正如英國國家臨床推薦治療方案研究所(NICE)的建議,這類藥物目前正被廣泛用于治療晚期乳腺癌的骨并發(fā)癥。而隨后的臨床研究證明,雙膦酸鹽可以預防乳腺癌骨轉移患者發(fā)生SREs。所以乳腺癌骨轉移,如果預期的生存期≥3個月,且肌酐低于3.0 mg/dL,在治療病情所需的化療和激素治療的同時,應及時給予雙膦酸鹽治療。
5.1.3 臨床用藥及使用方法
雙膦酸鹽化學結構中與中心碳原子連接的側鏈不同,雙膦酸鹽類藥物的臨床活性和功效亦有所不同:
第一代雙膦酸鹽以氯膦酸二鈉為代表,這些藥物在30年前進入臨床使用。
用量和用法:氯膦酸二鈉目前有靜脈、口服2種制劑可供選擇,雙膦酸鹽口服制劑方便在家用藥,也方便和口服化療藥物和內分泌藥物聯(lián)合使用。臨床上也可以先采用靜脈滴注氯膦酸二鈉400 mg/d,連用 3 d,而后口服氯膦酸二鈉1 600 mg/d,共3~4周作為1個周期的用法。氯膦酸二鈉主要經腎臟清除,因此,在氯膦酸二鈉治療過程中一定要維持足夠的水份攝入。氯膦酸二鈉膠囊應整粒吞服。任何情況下不能將氯膦酸鹽與含有鈣或其他二價陽離子的牛奶、食物或藥物同服,因為它們會減少氯膦酸鹽的吸收。
第二代是含氮的雙膦酸鹽,包括帕米膦酸二鈉、阿侖膦酸鈉,這些藥物抑制骨吸收的體外活性作用要強于第一代藥物。
用量和用法:帕米膦酸鹽靜脈滴注,每次60~90 mg,輸注時間不少于2 h,每3~4周用藥1次。
第三代為具有雜環(huán)結構的含氮雙膦酸鹽唑來膦酸和不含環(huán)狀結構含氮的伊班膦酸,在作用強度和療效方面比第二代有了進一步提高。用量和用法:
唑來膦酸鹽4 mg iv >15 min,1/3~4周。伊班膦酸鹽6 mg iv >15 min,1/3~4周。
⑴伊班膦酸治療轉移性骨病:常規(guī)劑量:6 mg 每3~4周靜注1次,每次靜注不短于15 min,1/3~4周。
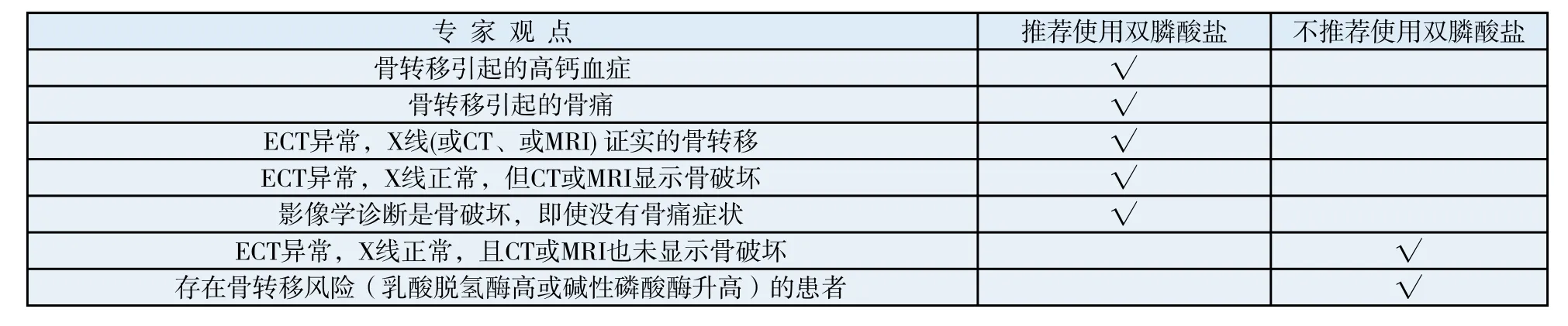
表 4 雙膦酸鹽推薦使用情況
⑵伊班膦酸負荷劑量(loading dose):伊班膦酸負荷劑量可快速緩解伴有嚴重疼痛的轉移性骨痛患者,使用方法:6 mg/d, 連續(xù)3 d靜注,以后每3~4周常規(guī)使用6 mg/次。
伊班膦酸目前在國外有靜脈、口服2種制劑可供選擇,靜脈滴注6 mg伊班膦酸和口服50 mg伊班膦酸療效相當,而口服制劑可方便在家用藥,也方便和口服化療藥物和內分泌藥物聯(lián)合使用。
5.2 雙膦酸鹽的使用適應證和用藥時機
具體使用情況見表4。
5.3 雙膦酸鹽的使用方法及注意事項
⑴在使用雙膦酸鹽前,應該檢測患者血清電解質水平,重點關注血肌酐、血清鈣、磷酸鹽、鎂等指標。
⑵臨床研究表明第一代氯膦酸鹽、第二代帕米膦酸鹽和第三代唑來膦酸和伊班膦酸鹽,都有治療乳腺癌骨轉移的作用。都可以用于治療高鈣血癥、骨痛、預防和治療骨轉移相關事件。已有臨床研究結果顯示,第三代雙膦酸鹽唑來膦酸和伊班膦酸有療效更好、毒性更低和使用更方便的優(yōu)點。
⑶選擇藥物治療應考慮患者的一般狀況和、疾病的總體情況及同時接受的治療。靜脈內使用唑來膦酸和伊班膦酸具有輸液時間更短的優(yōu)勢。
⑷雙膦酸鹽可以與放療、化療、內分泌治療、止痛藥聯(lián)合使用。
⑸長期使用雙膦酸鹽應注意每天補充鈣500 mg和維生素D。
⑹在輕中度腎功能不全(肌酐清除率>30 mL/min)的患者中無需調整劑量,但嚴重腎功能不全(肌酐清除率≤30 mL/min)患者,應根據(jù)不同產品的說明書進行劑量調整減量或延長輸注時間。
⑺鑒于有文獻報道少數(shù)患者在長期使用雙膦酸鹽后有發(fā)生下頜骨壞死的風險,所以使用雙膦酸鹽前應注意進行口腔檢查,注意每日口腔清潔,服藥期間盡量避免包括拔牙等口腔手術。
5.4 用藥時間及停藥指征
5.4.1 用藥時間
研究證明,雙膦酸鹽用于乳腺癌出現(xiàn)骨相關事件的中位時間為6~18個月,所以用藥時間至少6個月。
5.4.2 停藥指征
⑴使用中監(jiān)測到不良反應,且明確與雙膦酸鹽相關;
⑵治療過程中出現(xiàn)腫瘤惡化,出現(xiàn)其他臟器轉移并危及生命;
⑶臨床醫(yī)生認為需要時;
⑷但經過其他治療后骨痛緩解,不是停藥指征。
5.5 生化標記物
目前有部分生化指標可能幫助醫(yī)生了解患者對雙膦酸鹽的治療反應——但目前局限于科研領域,不建議臨床使用。
5.6 臨床資料和專家觀點
5.6.1 雙膦酸鹽預防骨轉移的作用
盡管已有研究提示,雙膦酸鹽可能有預防骨轉移的作用,并可能有潛在的預防內臟轉移的作用,但雙膦酸鹽預防骨轉移的臨床研究仍在進行中。所以但對于沒有骨轉移影像學證據(jù)的患者,以及出現(xiàn)骨外轉移但沒有骨轉移證據(jù)的患者,目前均不推薦使用雙膦酸鹽。
5.6.2 雙膦酸鹽作為乳腺癌術后輔助治療用藥
體外研究顯示,雙膦酸鹽藥物有抗腫瘤作用,但臨床研究還在進行中。盡管有小樣本研究證明,乳癌術后標準放療、化療、內分泌治療后,后續(xù)加用雙膦酸鹽治療可降低骨轉移甚至內臟轉移的風險,但是大規(guī)模研究尚未完成,因此目前不推薦雙膦酸鹽作為乳腺癌術后輔助治療用藥。
5.6.3 乳腺癌患者抗腫瘤治療引起的骨丟失
抗腫瘤治療引起的骨丟失 (cancer treatment-induced bone loss,CTIBL) 是應該引起重視的臨床問題,可以發(fā)生在老年患者、化療后、激素治療尤其是卵巢功能抑制和芳香化酶抑制劑治療后,根據(jù) ASCO骨健康指南,應該檢測骨密度(BMD),并根據(jù)結果考慮是否使用雙膦酸鹽藥物。ASCO指南建議所有年齡超過 65歲,或年齡在60~64歲,但有以下危險因素之一:骨質疏松家族史、體重 <70 kg、曾發(fā)生過非創(chuàng)傷性骨折或其他危險因素的患者常規(guī)檢查BMD。ASCO指南同時建議絕經后婦女無論年齡只要正在接受AI治療,絕經前婦女正在接受可能導致早絕經的治療(化療,卵巢去勢)的患者都應該常規(guī)檢查BMD。BMD評分(T-Score)低于-2.5開始使用雙膦酸鹽;BMD評分在-2.5到-1.0之間患者考慮使用雙膦酸鹽;而BMD評分高于-1.0的患者則不建議使用雙膦酸鹽。雙膦酸鹽治療骨質疏松的用法和治療骨轉移的用法不一樣,可以每3~6個月使用1次,并且要根據(jù)治療后BMD評分的改變調整用藥。而乳腺癌患者由于其年齡和治療均有可能存在骨質疏松,醫(yī)生應常規(guī)對這些女性的骨骼健康進行評估,目前不推薦將雙膦酸鹽用于骨質疏松的預防。
5.6.4 發(fā)生SREs后是否換藥預防SREs再次發(fā)生的問題
發(fā)生某些特殊SREs(高鈣、骨手術、放療)后,在臨床研究中會作為觀察終點停止使用雙膦酸鹽,但臨床實踐中不應該停用,而應該繼續(xù)用藥。但某一類雙膦酸鹽使用過程發(fā)生首次骨轉移加重的 SRE 后,可以考慮換用另一類雙膦酸鹽。也有專家認為換藥是否獲益有待更多的臨床研究數(shù)據(jù)支持。

