利用珍貴橙色束絲放線菌ATCC 31565氨甲酰基化4,5-雙氫-7-去氨甲酰基格爾德霉素
劉昕,李書芬,牛沂菲,賈長虹,武臨專,王以光
格爾德霉素(geldanamycin,GDM)和安絲菌素(ansamitocin,ASM)分別是由吸水鏈霉菌(如streptomyces hygroscopicus17997)和珍貴橙色束絲放線菌(如actinosynnema pretiosumATCC 31565)產生的具有抗腫瘤活性的安莎類抗生素[1-2]。GDM 與 ASM 具有相同的生物合成機制:它們均以 3-氨基-5-羥基苯甲酸(AHBA)為特異性生物合成起始物,在 I 型聚酮合酶(PKS)作用下將 7 個二碳單位連接形成安莎鏈,在酰胺合酶的作用下將安莎鏈與AHBA 連接環化;再經過 PKS 后修飾過程,形成 GDM 或ASM[3-4]。但是,GDM 與 ASM 的生物合成 PKS 后修飾存在顯著差異:GDM 的 PKS 后修飾包括羥基化、O-甲基化、氨甲酰化和氧化等,ASM 的 PKS 后修飾包括鹵(氯)化、N-甲基化(或 N-糖基化[5])、O-甲基化、酰化、環氧化和氨甲酰化(環化)等(圖1)。相對于 GDM,ASM 的 PKS后修飾似乎更加復雜。如果參與 ASM 生物合成的 PKS 后修飾系統可對 GDM 生物合成中間產物(或 GDM 本身)發揮修飾作用,就可獲得新的格爾德霉素衍生物,從而為抗腫瘤藥物開發提供候選化合物。基于該設想,本文作者進行了初步的探索研究。
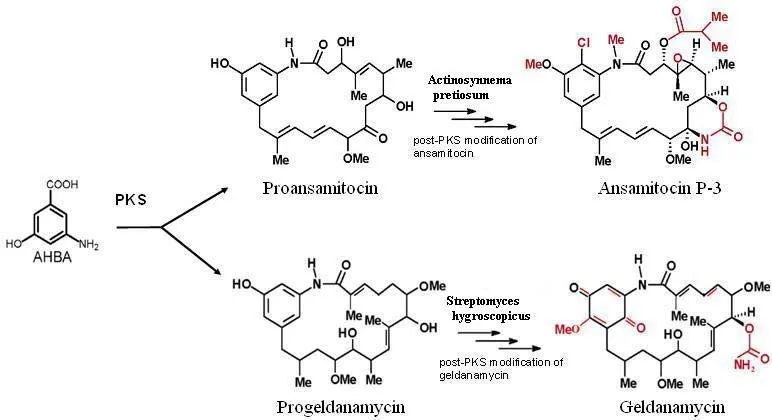
圖1 ASM 與 GDM 具有相同的生物合成機制、不同的 PKS 后修飾示意圖
1 材料與方法
1.1 材料
1.1.1 菌種 珍貴橙色束絲放線菌 ATCC 31565,ASM 產生菌;吸水鏈霉菌 17997,GDM 產生菌;吸水鏈霉菌 17997gdmN(氨甲酰基轉移酶基因)阻斷變株,4,5-雙氫-7-去氨甲酰基-7-羥基格爾德霉素(4,5-dihydro-7-descarbomoyl-7-hydroxygeldanamycin,CT-1-7)產生菌[6-7];吸水鏈霉菌17997gdmP(細胞色素 P450 單氧化酶基因)基因阻斷變株,4,5-雙氫格爾德霉素(4,5-H2GDM)產生菌(同時產生少量 17-O-demethylreblastatin)[8-9]。上述菌株均為本實驗室保存或構建。
1.1.2 試劑 GDM、CT-1-7、4,5-H2GDM 和 17-O-demethylreblastatin,由本實驗室分別從吸水鏈霉菌 17997、吸水鏈霉菌 17997gdmN阻斷變株、吸水鏈霉菌 17997gdmP阻斷變株的發酵產物中提取;GF254TLC 硅膠板為青島海洋化工分廠產品;葡萄糖、乙酸乙酯等普通化學試劑為北京化工廠化學或分析純產品;甲醇為美國 Fisher 公司HPLC 級產品。
1.1.3 儀器 Agilent 1200 型高效液相色譜儀為美國 Agilent公司產品;QTRAP 型質譜為美國 Applied Biosystems/MSD SCIEX 公司產品。
1.2 方法
1.2.1 珍貴橙色束絲放線菌 ATCC 31565 的培養 甘油管冷凍保藏的珍貴橙色束絲放線菌 ATCC 31565 孢子懸液,接種于 MY 培養基(培養基組成:酵母提取物 0.4%,麥芽提取物 1.0%,葡萄糖 0.4%,瓊脂粉 1.5%),28℃培養 4~5 d。
1.2.2 生物轉化 珍貴橙色束絲放線菌 ATCC 31565 的每個 MY 培養平皿(直徑 9cm),加入 CT-1-7 溶液(溶于二甲基亞砜,20 mg/ml)250 μl,終濃度 200 μg/ml,涂勻,28℃繼續培養 24~36 h。
1.2.3 生物轉化產物提取 取一個生物轉化平皿,將其中的 MY 瓊脂培養物切碎為長寬約 0.5cm×0.5cm 大小的瓊脂塊,轉入三角瓶中,加入約 40 ml 乙酸乙酯提取 24 h,傾出提取液,室溫揮干后,用約 500 μl 乙酸乙酯復溶。
1.2.4 生物轉化產物檢測 硅膠板 TLC 檢測,采用乙酸乙酯-二氯甲烷-正己烷-甲醇(9∶6∶6∶1)溶媒系統展層;展層結束后,用少量 NaOH(2.0 mol/L)溶液噴涂[10],照相記錄。
1.2.5 生物轉化產物的 LC-MS/MS 分析 將目標生物轉化產物從 TLC 硅膠板上刮下,乙酸乙酯洗脫回收并揮干,復溶于少量甲醇中,進行 LC-MS/MS 分析。Agilent 1200 型液相色譜系統與 QTRAP LC-MS-MS 質譜儀聯用,配Turbo Ionspray 離子化源。液相色譜條件:Dikma Diamonsil C18反相色譜柱,5 μm,150mm×4.6mm;30%~100%甲醇梯度洗脫 30min;流速 1 ml/min;檢測波長 304 nm。質譜檢測條件:噴霧電壓 5.5 kV;溫度 450℃;解簇電壓 80 V;霧化氣 40 相對單位,輔助氣 30 相對單位,均為氮氣;全掃描監測,正離子方式,質荷比(m/z)范圍為100~1000;采用信息依賴掃描模式獲得二級質譜;碰撞壓力設為高;碰撞能量為35 eV。
2 結果
2.1 生物轉化產物 TLC 檢測結果
對 4,5-雙氫-7-去氨甲酰基-7-羥基格爾德霉素(CT-1-7,化學結構見圖2)。在珍貴橙色束絲放線菌 ATCC 31565 中的生物轉化產物進行硅膠板 TLC 和 NaOH 顯色,發現有新的生物轉化產物出現(圖3),并且與 4,5-H2GDM 具有相同的Rf值。
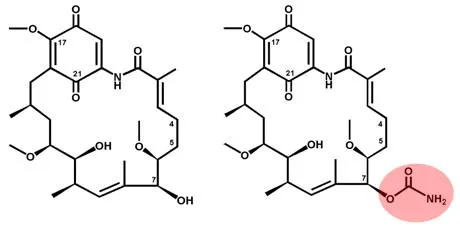
圖2 CT-1-7(左)和 4,5-H2GDM(右)的化學結構
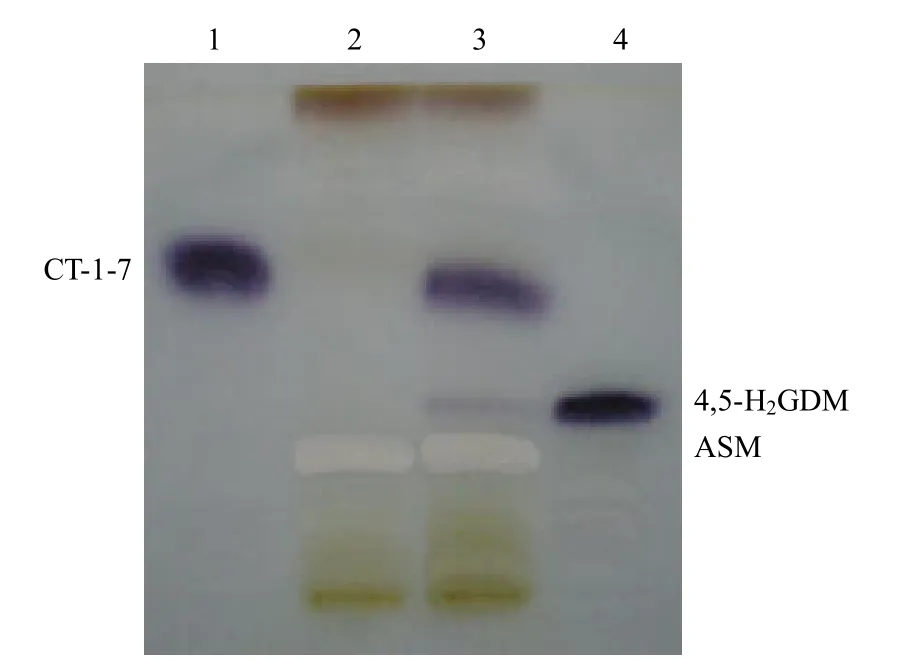
圖3 CT-1-7 生物轉化產物的硅膠板 TLC 檢測
2.2 LC-MS/MS 分析結果

圖4 4,5-H2GDM 的 LC-MS/MS 確證
從 TLC 硅膠板上回收轉化產物條帶后進行 HPLC 分析,主峰的保留時間(24.47min)和紫外吸收光譜(圖4A)與 4,5-H2GDM 對照品一致,因此推測該化合物為4,5-H2GDM;對該化合物進行質譜分析(圖4B),顯示其分子量和二級質譜特征均與 4,5-H2GDM 一致[11],證實該化合物為4,5-H2GDM,化學結構見圖2。
3 討論
Hu 等[12]利用除莠霉素(herbimycin)與 GDM 的化學結構相似性,在除莠霉素產生菌——Streptomyces hygroscopicusAM 3672 中對 GDM 進行了生物轉化研究,獲得了格爾德霉素衍生物——15-羥基格爾德霉素。本文將 GDM 生物合成中間產物 4,5-雙氫-7-去氨甲酰基-7-羥基格爾德霉素(CT-1-7)加入到 ASM 產生菌——珍貴橙色束絲放線菌Actinosynnema pretiosumATCC 31565 中,獲得了 4,5-雙氫格爾德霉素,說明參與 ASM 生物合成 PKS 后修飾的氨甲酰基轉移酶能夠識別并催化 CT-1-7 氨甲酰基化。此外,本文作者還分別利用珍貴橙色束絲放線菌 ATCC 31565 對GDM 以及另外一個 GDM 生物合成中間產物(17-O-demethylreblastatin,即 17-hydroxy-progeldanamycin)[13]進行了生物轉化實驗,但未檢測到生物轉化產物,提示安絲菌素生物合成 PKS 后修飾除了氨甲酰基化以外的其他修飾步驟不能對格爾德霉素及其生物合成中間產物發生作用。考慮到前格爾德霉素(progeldanamycin,化學結構見圖1)與前安絲菌素(proansamitocin,化學結構見圖1)在結構上非常相似,今后如可獲得前格爾德霉素,還可采用前格爾德霉素作為生物轉化底物,探討獲得格爾德霉素衍生物(雜合抗生素)的可能性。
CT-1-7 在珍貴橙色束絲放線菌 ATCC 31565 中的氨甲酰基化產率較低(約 5%~10%),推測主要是由于在珍貴橙色束絲放線菌 ATCC 31565 中存在 ASM 生物合成中間產物的競爭作用;預計阻斷 ASM 生物合成,可顯著提高其氨甲酰基化產率。
對參與 GDM 與 ASM 生物合成 PKS 后修飾的氨甲酰基轉移酶進行氨基酸序列比對(alignment),發現兩者有60%相同性(identities)、70%相似性(positives),因此,推測這兩個酶在空間結構上非常相似;由于兩者所催化底物的化學結構又比較相似,它們在催化功能上可以互相替換并不令人意外,本文的生物轉化實驗結果對此予以了證實。
[1]Fulston M, Stefanska AL, Thirkettle JE.Methods for ansamitocin production: US, 6573074.2003-06-03.
[2]BeBoer C, Dietz A.The description and antibiotic production of Streptomyces hygroscopicus var.Geldanus.J Antibiot (Tokyo), 1976,29(11):1182-1188.
[3]Rascher A, Hu Z, Viswanathan N, et al.Cloning and characterization of a gene cluster for geldanamycin production in Streptomyces hygroscopicus NRRL 3602.FEMS Microbiol Lett, 2003, 218(2):223-230.
[4]Yu TW, Bai L, Clade D, et al.The biosynthetic gene cluster of the maytansinoid antitumor agent ansamitocin from Actinosynnema pretiosum.Proc Natl Acad Sci U S A, 2002, 99(12):7968-7973.
[5]Zhao P, Bai L, Ma J, et al.Amide N-glycosylation by Asm25, an N-glycosyltransferase of ansamitocins.Chem Biol, 2008, 15(8):863-874.
[6]Hong YS, Lee D, Kim W, et al.Inactivation of the carbamoyltransferase gene refines post-polyketide synthase modification steps in the biosynthesis of the antitumor agent geldanamycin.J Am Chem Soc, 2004, 126(36):11142-11143.
[7]He W, Wu L, Gao Q, et al.Identification of AHBA biosynthetic genes related to geldanamycin biosynthesis in Streptomyces hygroscopicus 17997.Curr Microbiol, 2006, 52(3):197-203.
[8]Lin L, He WQ, Wang YG.A new 19-O-glycylated GDM in gdmP mutant of Streptomyces hygroscopicus 17997.Abstract Book of 15th International Symposium on the Biology of Actinomycetes, Shanghai.2009:51.
[9]Shin JC, Na Z, Lee DH, et al.Characterization of tailoring genes involved in the modification of geldanamycin polyketide in Streptomyces hygroscopicus JCM4427.J Microbiol Biotechnol, 2008,18(6):1101-1108.
[10]Liu AM, Wu LZ, Zhang HT, et al.A color reaction method for early preliminary discrimination of benzenic ansamycins.Chin J Antibiot,2008, 33(7):403-406.(in Chinese)劉愛明, 武臨專, 張會圖, 等.苯安莎類抗生素的一種早期鑒別方法.中國抗生素雜志, 2008, 33(7):403-406.
[11]Zhang K, Wu LZ, Lin L, et al.Identification and detection of 4,5-dihydrogeldanamycin produced by Streptomyces hygroscopicus 17997.Chin J Antibiot, 2009, 34(5):267-271.(in Chinese)張侃, 武臨專, 林靈, 等.吸水鏈霉菌 17997產生的 4,5-雙氫格爾德霉素的鑒別與檢測.中國抗生素雜志, 2009, 34(5):267-271.
[12]Hu Z, Liu Y, Tian ZQ, et al.Isolation and characterization of novel geldanamycin analogues.J Antibiot (Tokyo), 2004, 57(7):421-428.
[13]Stead P, Latif S, Blackaby AP, et al.Discovery of novel ansamycins possessing potent inhibitory activity in a cell-based oncostatin M signalling assay.J Antibiot (Tokyo), 2000, 53(7):657-663.

