菱鎂礦制備輕燒氧化鎂及其水化動力學研究
劉欣偉,馮雅麗,李浩然,張萍,汪平
(1. 北京科技大學 土木與環境工程學院,北京 100083;2. 中國科學院 過程工程研究所生化工程國家重點實驗室,北京 100190)
高純氧化鎂指MgO質量分數大于98%的樣品,高溫下具有優良的耐堿性和電絕緣性,光透過性好,導熱性高,熱膨脹系數大,廣泛用于電子、化工、陶瓷等行業[1-5]。目前制備高純氧化鎂的方法主要有海水石灰沉淀法、鹵水熱解法和菱鎂礦煅燒法[6-7],海水石灰法工藝復雜,投資大,生產成本高;鹽湖鹵水熱解法工藝過程中副產大量的氯化氫,腐蝕性大,回收利用較困難。菱鎂礦煅燒法工藝在生產高純氧化鎂的過程中不會對環境造成污染,是理想的生產氧化鎂的工藝。但目前在菱鎂礦煅燒制備輕燒氧化鎂和再水化、碳化法制備高純氧化鎂的工藝中,輕燒氧化鎂活性和水化效率直接影響到碳化率和綜合回收率。在以前的研究中,主要考察菱鎂礦煅燒條件和水化溫度對輕燒氧化鎂水化率的影響[8-9]。在此,本文作者以菱鎂礦為原料制備輕燒氧化鎂,考察水化溫度、氧化鎂濃度和顆粒度對輕燒氧化鎂水化動力學的影響,并建立表觀反應速率常數關于水化溫度、氧化鎂濃度和顆粒度的經驗表達式,以便為菱鎂礦水化、碳化法制備高純氧化鎂提供理論依據。
1 實驗部分
1.1 主要原料及實驗設備
本項研究選用遼寧海城菱鎂礦為原料,其化學組成(質量分數)見表1。

表1 菱鎂礦的化學組成Table 1 Chemical composition of magnesite %
主要實驗設備為:KSW-5-12A型電爐溫度控制器;數控超線恒溫槽;AR1140電子天平;SHZ-D(III)循環水式真空泵;PH050電烘干爐。
1.2 實驗方法及測試方法
1.2.1 輕燒氧化鎂的制備
輕燒氧化鎂由菱鎂礦煅燒制得,分解過程為MgCO3→MgO+CO2;制備工藝為:菱鎂礦鄂式破碎→篩分為一定粒度→一定煅燒溫度和保溫時間下煅燒→輕燒氧化。
1.2.2 輕燒氧化鎂活性的測定
將一定顆粒度的菱鎂礦分別在750,800和900 ℃下煅燒,冷卻后用研缽磨細至粒度在75 μm以下。在80 ℃水浴中,采用檸檬酸活性法表征輕燒氧化鎂的反應活性[10]。
1.2.3 水化反應
將輕燒氧化鎂與水按不同的比例混合,用電動磁力攪拌器設定不同的轉速,分別在 30,40,50,60和70 ℃下進行恒溫水浴,在不同溫度下分別反應0.5,1.0,1.5,2.0和2.5 h后,再將水化后懸浮液抽濾,清洗,產物至于70 ℃烘箱中干燥至恒質量。
1.2.4 水化率測定
將干燥后的水化產物于500 ℃煅燒2 h,由下式得到水化率:
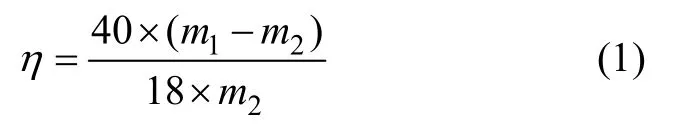
式中:η為水化率;m1為水化產物煅燒前質量;m2為水化產物煅燒后質量。
2 結果與討論
2.1 活性氧化鎂制備條件優化研究
選擇適當的煅燒溫度、保溫時間和原礦粒度對菱鎂礦進行煅燒,考察煅燒溫度、保溫時間以及原礦粒度對輕燒氧化鎂活性的影響,用 L9(34)正交設計表進行方差分析,研究各因素對氧化鎂活性的影響,優化制備條件。氧化鎂正交試驗正交表如表2所示。不同條件下氧化鎂活性見表 3。采用方差分析法處理試驗數據,結果見表4。
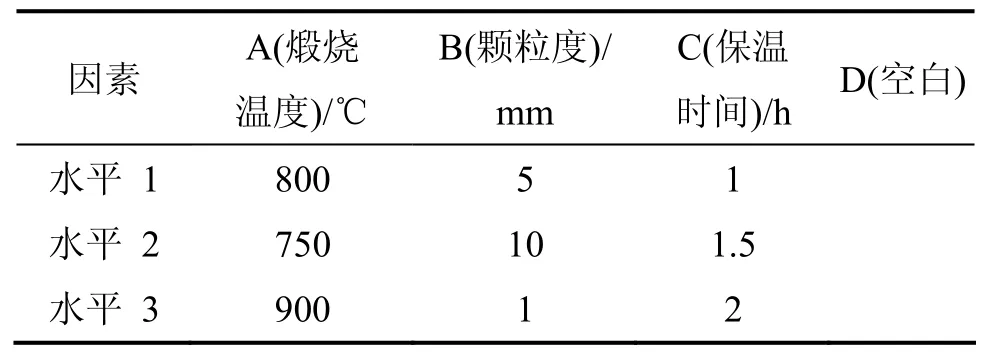
表2 因素水平確定表Table 2 Determination of factors and levels
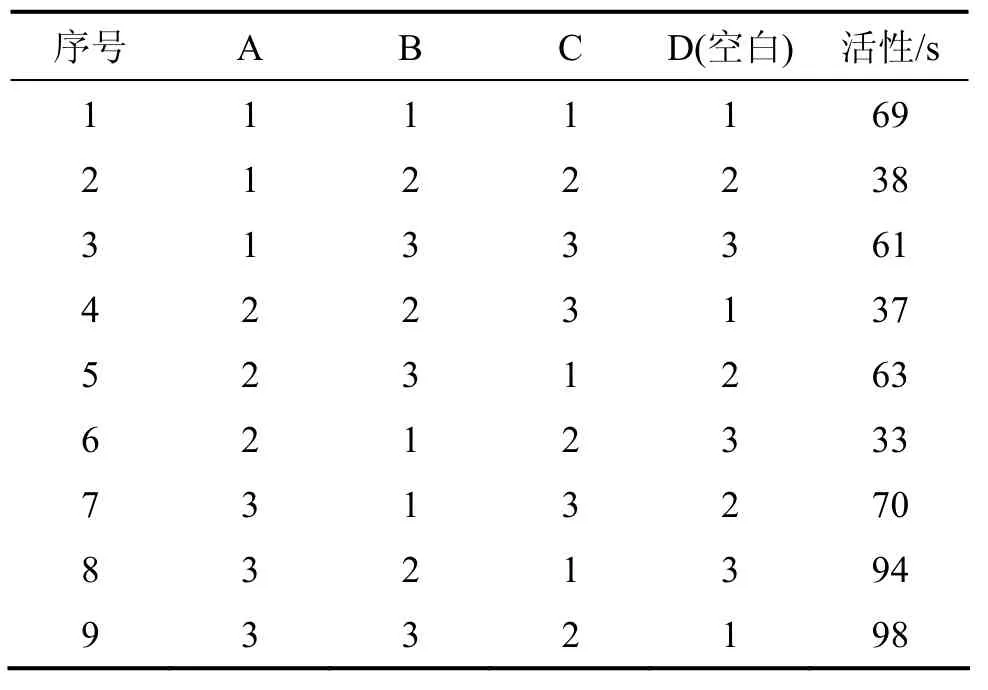
表3 氧化鎂活性正交分析表Table 3 Orthogonal analysis of magnesium oxide activity
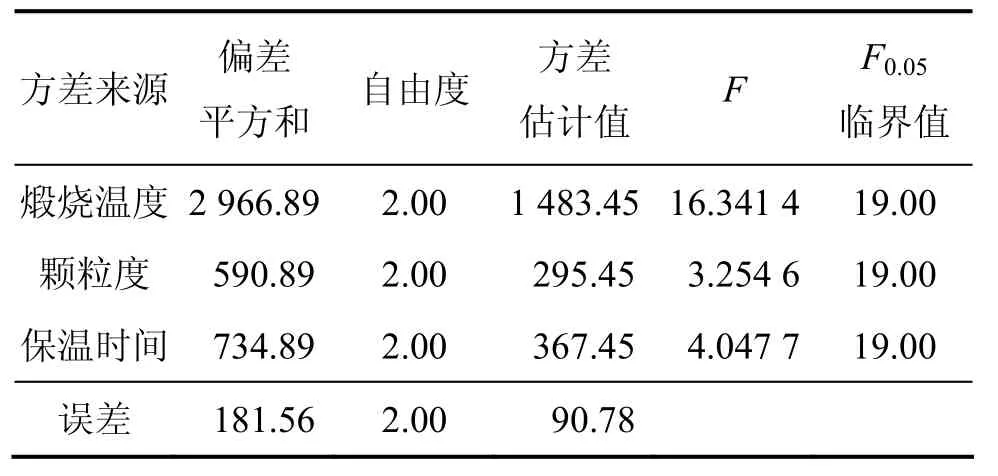
表4 氧化鎂活性方差分析結果Table 4 Variance analysis of magnesia activity
由表4可知:煅燒溫度的偏差平方和最大,保溫時間的次之,顆粒度的最小,因此,影響氧化鎂活性的最主要因素為煅燒溫度,其次為保溫時間,顆粒度的影響較小。從理論上講,菱鎂礦的顆粒越小,熱傳導越快,菱鎂礦分解越充分,輕燒氧化鎂的活性越高。另外,菱鎂礦是三方晶系,MgCO3受熱分解過程是[CO3]結構單元的位置上釋放出1個CO2,留下1個O,使這些位置的化學組成發生變化,成為物化性能活化點。在700~800 ℃煅燒時,菱鎂礦化學組成由MgCO3轉變成MgO,價鍵由 Mg—[CO3]轉變為Mg—O,但晶體結構仍維持菱鎂礦的結構,晶體結構的鍵角大、結構疏松、不規則,因而化學活性高;隨著煅燒溫度升高和保溫時間延長,菱鎂礦的分解反應基本結束,晶體結構調整和生長占主導地位,MgO晶體漸趨完善、晶粒尺寸變大,化學活性逐漸降低,但當煅燒溫度較低,保溫時間過短時,熱量無法傳到顆粒內部,顆粒內外溫差較大,導致所謂“加生”現象[11-13],菱鎂礦分解不完全,為保證輕燒料不欠燒也不過燒,并具有較高的活性,最佳煅燒溫度應控制在750 ℃,煅燒時間為1.5 h,顆粒度為1 mm。
2.2 水化反應動力學研究
2.2.1 輕燒氧化鎂水化動力學模型的確定
輕燒氧化鎂的水化反應方程為:MgO+H2O→Mg(OH)2,根據水化條件的不同,水化動力學可以分為化學反應控制、外擴散控制和內擴散控制 3種類型[14-18]。為了確定氧化鎂水化動力學模型,首先研究攪拌速度對氧化鎂水化率的影響,結果如圖1所示。
在輕燒氧化鎂水化過程中,當液膜擴散為控速步驟時,攪拌強度對水化率影響很大,通常可提高水化率40%~70%[19]。但從實驗結果(圖1)可知:攪拌強度對氧化鎂的水化率影響不大,由此可判斷水化反應控制步驟非外擴散控制。
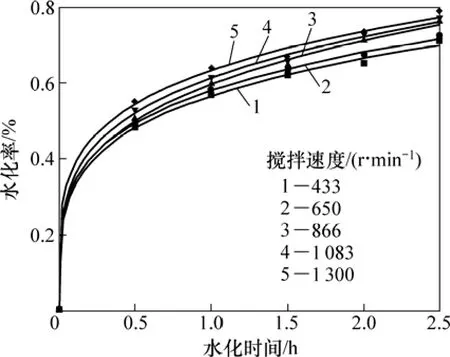
圖1 攪拌速度對氧化鎂水化率的影響Fig.1 Effect of stirring speed on magnesia hydration rate
為了進一步判斷氧化鎂水化動力學模型,將實驗數據代入不同的動力學方程擬合,不同溫度下的實驗數據與內擴散控制的動力學方程為:
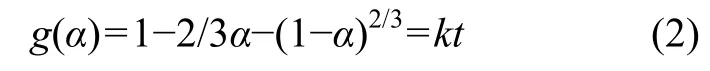
式中:g(α)代表水化率函數;α為水化率;k為表觀反應速率常數;t為水化時間。擬合結果如圖2所示。從圖2可見:不同溫度下各實驗數據與內擴散控制動力學方程均較好地符合(R2>0.98),從而證實輕燒氧化鎂的水化反應為內擴散控制類型。
阿累尼烏斯公式:
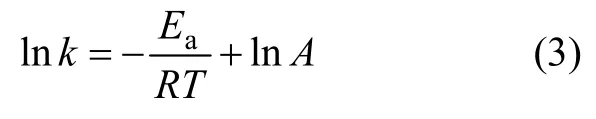
式中:T為熱力學溫度;Ea為反應活化能。將水化溫度與水化速率常數之間的關系擬合(見圖3),可求得表觀反應活化能為23.78 kJ/ mol,根據化學反應與擴散控速的活化能判據:E擴散<25.12 kJ/mol<E化學,可以進一步判定氧化鎂的水化反應為內擴散控制類型。
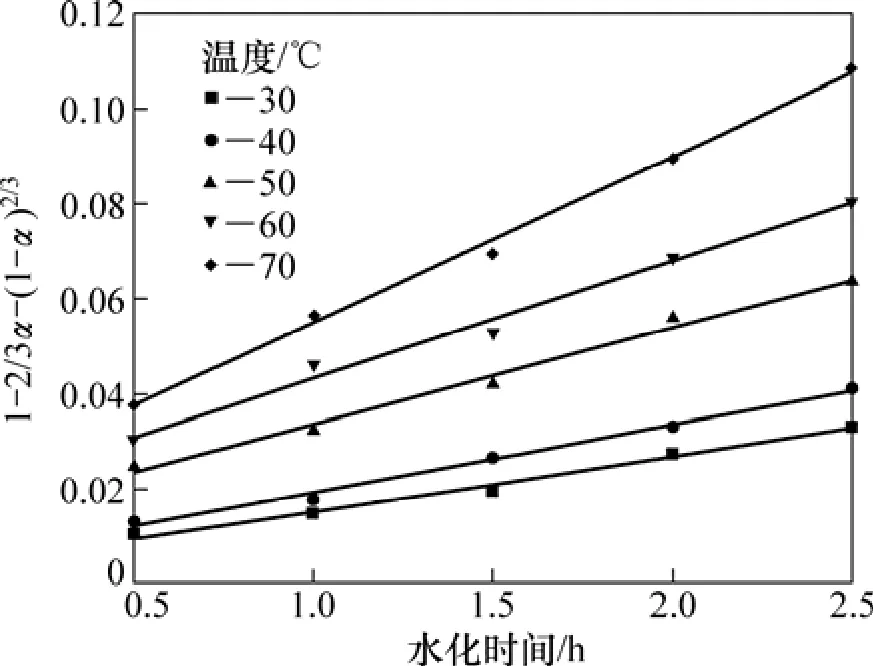
圖2 不同溫度下的水化動力學曲線Fig.2 Hydration dynamic curves at different temperatures
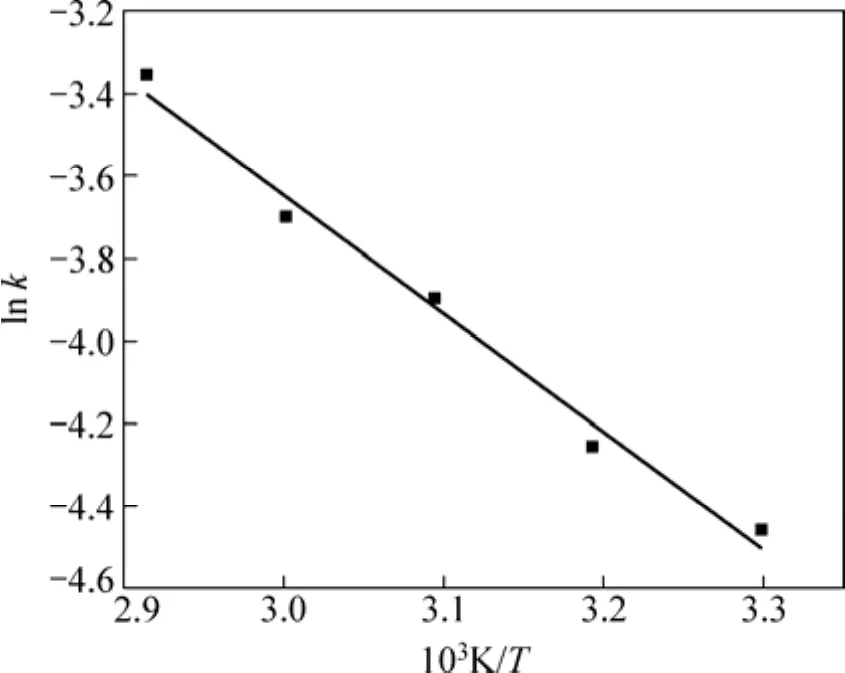
圖3 反應速率常數與溫度的關系Fig.3 Relationship between k and temperature
2.2.2 顆粒度對氧化鎂水化動力學的影響
在攪拌速度、溫度、氧化鎂濃度不變的情況下研究輕燒氧化鎂顆粒度(r0)對水化率的影響,結果如圖4所示。由圖4可知,顆粒度控制在0.074~1.000 mm范圍內,水化反應仍屬于內擴散控制類型。隨著氧化鎂粒度的減小,水化反應速率上升。這是因為粒度的減小增大了水和氧化鎂顆粒的接觸面積,從而提高了反應速率。
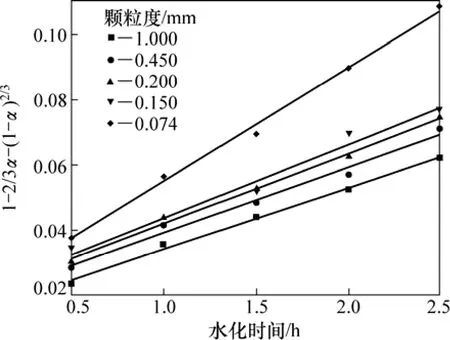
圖4 顆粒度對水化動力學的影響Fig.4 Effect of particle size on hydration kinetics
對表觀反應速率和 1 /進行線性擬合,擬合結果如圖5所示。從圖5可見:表觀反應速率與 1 /成線性關系。
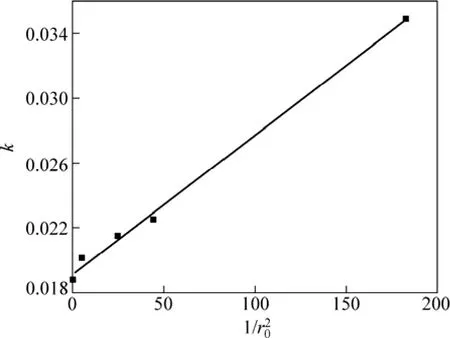
圖5 顆粒度與反應速率常數的關系Fig.5 Relationship between 1 /and k
2.2.3 氧化鎂濃度對水化動力學的影響
固定攪拌速度、反應溫度及氧化鎂顆粒度等條件,考察氧化鎂質量濃度對水化動力學的影響,結果如圖6所示。
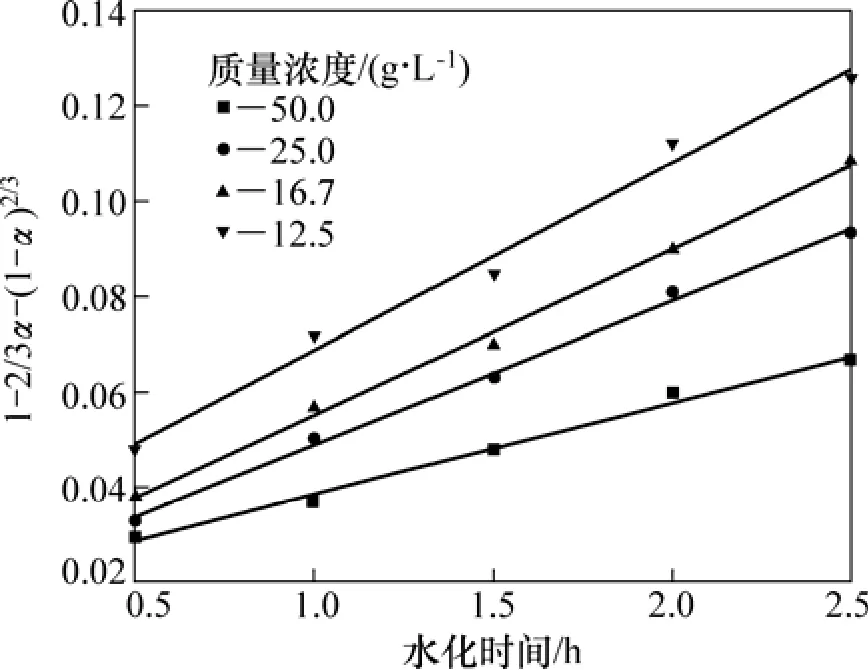
圖6 氧化鎂質量濃度ρ0動力學的影響Fig.6 Effect of ρ0 on hydration kinetics
從圖6可見:當氧化鎂質量濃度在12.5~50 g/L之間時,輕燒氧化鎂的水化反應仍然屬于內擴散類型;隨著氧化鎂質量濃度的增加,斜率有所下降,反應速率減小。這是因為氧化鎂質量濃度越大,輕燒氧化鎂的含量越大,懸浮的固體顆粒物越不易分散,固液反應物之間的有效接觸面積越小,在一定程度上限制了表面化學反應,導致水化速率下降。
對表觀反應速率和氧化鎂質量濃度進行線性擬合,擬合結果見圖7。從圖7可見:表觀反應速率和氧化鎂質量濃度存在線性關系。
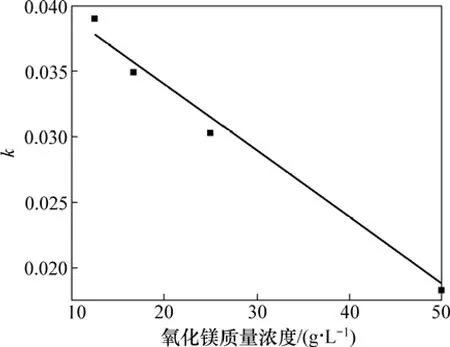
圖7 氧化鎂質量濃度ρ0與反應速率常數k的關系Fig.7 Relationship between ρ0 and k
2.2.4 表觀反應速率常數與溫度、氧化鎂濃度、顆粒度的關系
根據內擴散浸出動力學方程,在理想條件下,k與c0/成正比[20],而根據上面的擬合結果,k與c0和 1 /成線性關系(見圖5和圖7)。因此,假設它們之間存在如下關系:
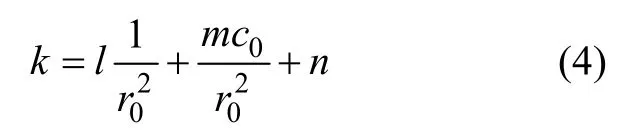
其中:l,m和n為常數。計算 1 /和c0/,用MATLAB對數據進行多元線性擬合,得到結合水化動力學方程,可得表觀反應速率常數的經驗公式為
3 結論
(1) 菱鎂礦的煅燒溫度和煅燒時間對輕燒氧化鎂的活性有較大影響,顆粒度的影響較小,最佳煅燒溫度為750 ℃,保溫時間為1.5 h,顆粒度為1 mm。
(2) 攪拌速度對輕燒氧化鎂的水化率影響很小,根據水化動力學曲線計算出表觀反應活化能為 23.78 kJ/mol,兩者證明氧化鎂的水化反應為內擴散控制類型。
(3) 氧化鎂濃度的降低和顆粒度的減小都能提高氧化鎂的水化率,通過 MATLAB對數據進行擬合得到表觀反應速率常數k的經驗公式為
[1]Roco M C,Villiams R S,Alivisatos P. Nanotechnology research directions,vision for nanotechnology R&D in next decade[R].Dordrecht: Kluwer,2001: 43-45.
[2]Mironyuk I F,Gun’ko V M,Povazhnyak M O,et al. Magnesia formed on calcination of Mg(OH)2prepared from natural bischofite[J]. Applied Surface Science,2006,252(3):4071-4082.
[3]胡慶福,胡曉湘,宋麗英. 中國專用氧化鎂開發現狀及發展建議[J]. 化工進展,2005,24(1): 30-32.HU Qing-fu,HU Xiao-xiang,SONG Li-ying. Development status and suggestions of special magnesium oxide in China[J].Chemical Industry and Engineering Progress,2005,24(1):30-32.
[4]郭小水,劉家祥,李敏,等. 重鎂水添加乙醇熱解制備高純氧化鎂[J]. 有色金屬,2009,61(1): 77-80.GUO Xiao-shui,LIU Jia-xiang,LI Min,et al. High purity magnesia preparation from Mg(HCO3)2with ethanol addition[J].Nonferrous Metals,2009,61(1): 77-80.
[5]譚綠貴. 龍穴山瓷石礦床地質特征及開發途徑初探[J]. 礦產保護與利用,2002(6): 27-28.TAN Lü-gui. Geological features of longxue mountain China stone deposit and its exploitation ways[J]. Conservation and Utilization of Mineral Resources,2002(6): 27-28.
[6]徐徽,蘇元智,李新海,等. 鹽湖水氯鎂石制取輕質氧化鎂的工藝[J]. 中國有色金屬學報,2004,14(10): 1776-1782.XU Hui,SU Yuan-zhi,LI Xin-hai,et al. Technology of preparation for light magnesium oxide from bischofite[J].Transactions of Nonferrous Metals Society of China,2004,14(10): 1776-1782.
[7]徐徽,蔡勇,石西昌,等. 水鎂石制取高純氧化鎂的研究[J].湖南師范大學自然科學學報,2006,29(1): 52-53.XU Hui,CAI Yong,SHI Xi-chang,et al. Study on preparation of high-purity magnesia from brucite[J]. Journal of Natural Science of Hunan Normal University,2006,29(1): 52-53.
[8]翟學良,楊永杜. 活性氧化鎂水化動力學研究[J]. 無機鹽工業,2004(4): 16-18.ZHAI Xue-liang,YANG Yong-du. Study of hydrolization kinetics of activated MgO[J]. Inorganic Chemical Industry,2004(4): 16-18.
[9]孫永明. Statistica 6.0 研究輕燒氧化鎂水化動力學[J]. 化工礦產地質,2008,30(4): 227-230.SUN Yong-ming. Dynamic study of hydration of active magnesia by Statistica 6.0[J]. Geology of Chemical Mineral,2008,30(4): 227-230.
[10]崔鑫,鄧敏. 氧化鎂制備方法、活性與水化測定方法綜述[J].硅酸鹽通報,2008,27(1): 136-141.CUI Xin,DENG Min. A review of preparation,activity and hydration of MgO[J]. Bulletin of the Chinese Ceramic Society,2008,27(1): 136-141.
[11]章柯寧,張一敏,王昌安,等. 從低品級菱鎂礦中提取高純氧化鎂的研究[J]. 武漢科技大學學報,2006,29(6): 558-560.ZHANG Ke-ning,ZHANG Yi-min,WANG Chang-an,et al.Obtaining high-grade MgO from low-grade magnesite[J].Journal of Wuhan University of Science and Technology,2006,29(6): 558-560.
[12]百麗梅,韓躍新,印萬忠,等. 菱鎂礦制備優質活性鎂技術研究[J]. 有色礦冶,2005,21(7): 47-48.BAI Li-mei,HAN Yue-xin,YIN Wan-zhong,et al. Technology research on preparation of high quality active magnesia with magnesite[J]. Non-Ferrous Mining Metallurgy,2005,21(7):47-48.
[13]姜玉之,韓躍新,印萬忠,等. 利用菱鎂礦制備氫氧化鎂[J].東北大學學報,2006,27(6): 694-697.JIANG Yu-zhi,HAN Yue-xin,YIN Wan-zhong,et al.Preparation of magnesium hydroxide from magnesite[J]. Journal of Northeastern University,2006,27(6): 694-697.
[14]蔣漢瀛. 濕法冶金過程物理化學[M]. 北京: 冶金工業出版社,1984: 89-100.JIANG Han-ying. Physical chemistry of hydrometallurgical process[M]. BeiJing: Metallurgy Industry Press,1984: 89-100.
[15]Bayrak B,Lacin O,Bakan F,et al. Investigation of dissolution kinetics of natural magnesite in gluconic acid solutions[J].Chemical Engineering Journal,2006,117: 109-115.
[16]錢海燕,李素英,鄧敏,等. 輕燒氧化鎂水化動力學[J]. 化工礦物與加工,2007 (12): 1-4.QIAN Hai-yan,LI Su-min,DENG Min,et al. Hydration dynamic of light-burned magnesia[J]. Technology of Chemical Industrial Minerals,2007(12): 1-4.
[17]孫永明. 菱鎂礦煅燒氧化鎂制備高純超細氫氧化鎂[D]. 南京:南京工業大學材料科學與工程學院,2005: 29.SUN Yong-ming. Magnesium hydroxide of high grade and extra fine obtained by hydration of light-burned magnesia calcined from magnesite[D]. Nanjing: Nanjing University of Technology.School of Material Science and Technology,2005: 29.
[18]ZHAO Yun,ZHU Guo-cai. Thermal decomposition kinetics and mechanism of magnesium bicarbonate aqueous solution[J].Hydrometallurgy,2007,89: 217-223.
[19]李浩然,馮雅麗,羅小兵,等. 濕法浸出粘土礦中釩的動力學[J]. 中南大學學報: 自然科學報,2008,39(6): 1181-1184.LI Hao-ran,FENG Ya-li,LUO Xiao-bing,et al. Leaching kinetics of extraction of vanadium pentoxide from clay mineral[J]. Journal of Central South University: Science and Technology,2008,39(6): 1181-1184.
[20]莫鼎成. 冶金動力學[M]. 長沙: 中南工業大學出版社,1987:209-215.MO Ding-cheng. Metallurgical kinetics[M]. Changsha: Press of Central South University,1987: 209-215.

