丹參和川芎嗪聯合應用對大鼠腦缺血再灌注氧化損傷的保護作用研究
張莉,高志軍,趙靜(.西藏大學醫學院,拉薩市850000;.西藏當雄縣人民醫院,當雄縣85500)
腦缺血再灌注損傷(Cerebral ischemia reperfusion injury,CIR)是指腦組織缺血一定時間恢復血供后,腦功能不但未能恢復,反而出現了更加嚴重的腦機能障礙。它是由興奮性氨基酸中毒、氧化應激、細胞內鈣超載、炎癥反應和細胞凋亡等多種因素參與的病理過程[1],其中自由基連鎖反應被認為是造成腦組織損害的重要機制。因此,清除自由基、切斷自由基對腦缺血的繼發性損害已成為目前神經保護治療的重要途徑之一。近年研究表明,中藥對CIR后的腦細胞起著重要的保護作用。丹參為唇形科多年生草本植物,以根入藥,具有活血化瘀、寧心安神等功效。現代藥理學研究表明[2~4],丹參具有改善腦血流再灌注和腦血流自動調節機制,能清除自由基、抗生物膜過氧化、拮抗鈣離子、防止鈣超載。川芎嗪是川芎的一種生物堿,用于治療閉塞性血管疾病、心絞痛、冠心病、腦血栓形成等[5~7]。本研究在已證實單味中藥丹參、川芎嗪對CIR后對腦細胞有一定保護作用的基礎上,進一步研究兩藥聯合應用是否比單用的效果更好,以為臨床用藥提供理論依據。
1 儀器與材料
1.1 儀器
GGX25型原子吸收分光光度計(北京科創海光儀器有限公司);721型分光光度計(南京第四分析儀器有限公司)。
1.2 試藥
川穹嗪注射液(北京第四科寶制藥有限公司,批號:100218;規格:40 mg·2 mL-1);丹參注射液(上海中西制藥有限公司,批號:091124,規格:3 g·2 mL-1);丙二醛(MDA)、超氧化物歧化酶(SOD)測定試劑盒(南京建成生物工程研究所)。
1.3 動物
健康Wistar成年大鼠200只,♂,體重(270±18)g,由第三軍醫大學實驗動物中心提供(動物合格證號:24301050)。
2 方法
2.1 模型的復制
模型的復制方法參照文獻[8],采用大腦中動脈線栓法(MCAO)制備大鼠右側大腦中動脈缺血2 h再灌注24 h模型。常規麻醉消毒,取頸旁右側切口,分離右側頸總動脈(CCA)、右頸外動脈(ECA)與頸內動脈(ICA),順CCA經ICA將栓線送至顱內,遇阻力而止,栓線插入深度18~20 mm。縫合切口,留置線頭于體外。腦缺血2 h再灌注時,將大鼠再次麻醉,輕輕抽提栓線至CCA內,使血流再通。假手術大鼠栓線只插入10 mm,其余步驟相同。復制模型成功的判定標準為大鼠清醒后出現右側Homer征及以左前肢為重的偏癱。
2.2 分組和給藥
實驗分為5組,即假手術(等滲鹽水1.5 mL)、模型(等滲鹽水1.5 mL)、丹參(2 g·kg-1)、川芎嗪(3.5 mg·kg-1)和丹參+川芎嗪(2 g·kg-1+3.5 mg·kg-1)組。分別于缺血后再灌注前20 min、再灌注后12、24 h大鼠尾靜脈緩慢推注給藥。
2.3 TTC染色測定各組大鼠腦梗死面積
大鼠于缺血2 h再灌24 h ig給藥后迅速斷頭取左側大腦,切去嗅球、小腦和低位腦干,間隔2 mm連續作6個腦冠狀切片,立即置切塊于37℃TTC染液(含3%TTC 4.0 mL,1 mol·L-1K2HPO40.1 mL)中避光恒溫孵育30 min,在15 min時將腦組織塊翻面,染色后用10%甲醛固定24 h。TTC被線粒體過氧化氫酶還原,可使正常組織染色呈紅色,壞死組織呈白色。數碼相機拍照,用形態學圖像分析系統計算腦梗死區域占全腦總面積的百分比。公式如下:梗死面積百分比=梗死面積/全腦總面積×100%。
2.4 腦組織水、鈣含量的測定
同上取右前腦50~100 mg,稱重后于105℃恒溫箱烘干至恒重,即為干重。用公式[(濕重-干重)/濕重]×100%計算腦含水量。將烘干的腦組織次氯酸消化,5%鹽酸定容,在原子吸收分光光度計上測吸光度(OD)值,以標準曲線法計算腦鈣含量。
2.5 腦組織SOD活性、MDA含量測定
將大鼠斷頭取腦,用去離子水沖凈表面,取視交叉和腳間窩間右腦扇形冠狀切片約50~100 mg,通過分光光度計測定SOD活性和MDA含量。
2.6 統計學方法
3 結果
3.1 大鼠腦梗死面積的測定結果
與假手術組比較,模型組大鼠腦梗死面積顯著增加(P<0.01);與模型組比較,各用藥組大鼠腦梗死面積顯著降低(P<0.01),且丹參+川芎嗪組比單用藥組效果更好,表明兩藥聯合應用能明顯減少CIR后大鼠的腦梗死面積。大鼠腦梗死面積的測定結果見表1。

表1 大鼠腦梗死面積的測定結果Tab 1 Results of cerebral ischemic area of rats
3.2 大鼠腦組織水、鈣含量的測定結果
與假手術組比較,模型組大鼠腦組織中腦鈣和腦水分含量顯著升高(P<0.01);與模型組比較,各用藥組大鼠腦鈣和腦水分含量顯著降低(P<0.05),且丹參+川芎嗪組比單用藥組效果更好,表明兩藥聯合應用能明顯減少CIR后大鼠的腦鈣和腦水分含量。大鼠腦組織水、鈣含量的測定結果見表2。

表2 大鼠腦組織水、鈣含量的測定結果Tab 2 Results of the contents of brain wet and calcium in cerebral tissue of rats
3.3 大鼠腦組織MDA含量、SOD活性的測定結果
高(P<0.01),而SOD活性顯著降低(P<0.01);與模型組比較,各用藥組大鼠MDA含量顯著降低(P<0.05),SOD活性顯著增強(P<0.05),且丹參+川芎嗪組比單用藥組效果更好。大鼠腦組織MDA含量、SOD活性的測定結果見表3。
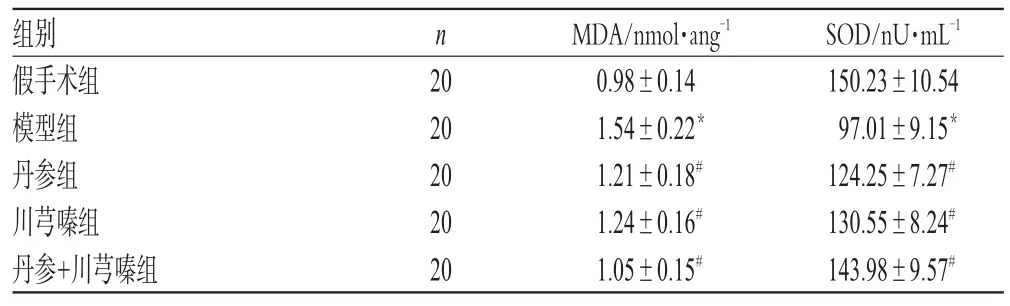
表3 大鼠腦組織MDA含量、SOD活性的測定結果Tab 3 Results of the content of MDA and activities of SOD in cerebral tissue of rats
4 討論
自由基廣泛存在于生物體內,正常情況下自由基主要參與體內藥物和毒物的降解,殺滅病原體,調節機體免疫功能。而體內存在許多抗氧化系統能清除自由基,使自由基的生成與清除處于動態平衡中,所以對機體并無有害影響。當大腦缺血再灌注時,氧自由基生成增多,其機制主要與Ca2+、線粒體、氧自由基和金屬離子等有關。大量自由基的產生,使其生成與清除失衡,從而引起一系列自由基連鎖反應,如過量氧自由基引起局灶性腦缺血再灌注后腦水腫和細胞凋亡等。Toyoda T等[9]已證實在腦缺血再灌注時,通過給予自由基清除劑可明顯減輕腦水腫和縮小梗死體積。Troy CM等[10]發現,降低SOD水平可誘導細胞凋亡,提示氧自由基可能參與凋亡發生。Yoshiha S等[11]研究表明,在缺血性腦損傷中,自由基反應啟動于缺血期,但明顯過氧化反應卻發生在再灌注期。鑒于自由基在缺血及再灌注損傷中的重要作用,抑制缺血再灌注時自由基的大量產生,減少自由基對機體組織的損害是保護腦組織的首要任務。
腦水腫包括血管源性腦水腫和細胞中毒性腦水腫,是缺血性腦損傷的并發癥之一。腦組織含水量越多,表明腦缺血損害更嚴重。本研究表明,模型大鼠用藥后能明顯降低腦組織水分含量,減輕水腫,提示這兩種藥物對大腦組織具有保護作用。
SOD是酶促防御系統中一種重要的氧自由基清除劑,在腦缺血再灌注時,自由基的大量產生,使SOD大量消耗而活性降低,自由基產生和清除的動態平衡被打破,使細胞組織的結構和功能衰退。本研究表明,丹參和川芎嗪能提高缺血再灌注腦組織中SOD活性,顯示丹參和川芎嗪能增強機體清除自由基的能力,減輕自由基的氧化性損傷,從而起到保護腦細胞的功能,且兩藥聯合應用,效果更佳。
腦組織中富含脂質,易與自由基發生脂質過氧化反應而形成大量的脂質過氧化物(LPO),其中MDA是脂質過氧化反應的代謝產物,是許多不飽和脂肪酸的分解產物,MDA含量的升高間接地反映了O-含量的增加,進一步表明生物膜受自由基的損傷程度[12]。用藥各組能夠顯著降低腦組織MDA含量,表明藥物通過增強自由基清除能力和抑制自由基損傷而保護腦組織。
[1] KaushalV,Schlichter LC.Mechanisms of microglia mediated neurotoxicity in a new model of the stroke penumbra[J].J Neurosci,2008,28(9):2 221.
[2] 張 潔,曾曉榮,楊 艷,等.丹參酮ⅡA磺酸鈉和丹參素對豬冠狀動脈平滑肌細胞鈣激活鉀通道的激活機制[J].中國藥理學與毒理學雜志,2005,19(4):270.
[3] 常 宏,蔣紹艷,史玉朋,等.丹參注射液誘導大鼠骨髓間充質干細胞分化為神經元樣細胞的研究[J].中國藥房,2008,19(30):2 323.
[4] Park EJ,Zhao YZ,Kim YC,et al.PF2401 SF,standardized fraction ofSalvia miltiorrhizaand its constituents,tanshinoneⅠ,tanshinoneⅡA,and cryptotanshinone,protect primary cultured rat hepatocytes from bile acid 2 induced apoptosis by inhibiting JNK phosphorylation[J].Food Chem Toxicol,2007,45(10):1 891.
[5] 陳德森,郭俐宏,李 莉,等,川芎嗪對大鼠局灶性腦缺血再灌注損傷的影響[J].山西醫科大學學報,2010,9(6):780.
[6] 朱 怡,陳 霞,黃 屏,等.丹參川芎嗪對大鼠腦缺血再灌注損傷的保護作用[J].現代中西醫結合雜志,2001,20(7):802.
[7] Ghoneim AI,AbdelNaim AB,Khalifa AE,et al.Protective effects of curcumin against ischemia reperfusion insult in rat forebrain[J].Pharmacol Res,2002,46(3):273.
[8] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stork,1989,20(1):84.
[9] Toyoda T,Kassell NF,Lee KS.Attenuation of ischemia-reperfusion injury in the neocortex by the hydroxyl radical scavenger nicaraven[J].Neurosurgery,1997,40(2):372.
[10] Troy CM,Shelarski ML.Down regulation of copper/zinc superoxide dismutase apoptotic death in PC12 neuronal cells[J].Proc Nat Scand Sci USA,1994,91(14):6 384.
[11] Yoshiha S,Abe K,Basto R,et al.Influence of transient ischemia on lipid soluble antioxidants,free fatty acid and energy metabolites in rat brain[J].Brain Res,1982,245(2):307.
[12] Hallenbeck JM,Dutka AJ.Background review and current concepts of reperfusion injury[J].Arch Neurol,1990,47(11):1 245.

