維持性血液透析患者C反應蛋白與骨代謝紊亂的相關性
馬立萍,邸志鵬,于文慧
(1.中國石油天然氣集團公司中心醫院 血液凈化中心,河北廊坊 065000;2.天津醫科大學第二醫院 血液凈化中心,天津 300211)
維持性血液透析患者C反應蛋白與骨代謝紊亂的相關性
馬立萍1,邸志鵬1,于文慧2
(1.中國石油天然氣集團公司中心醫院 血液凈化中心,河北廊坊 065000;2.天津醫科大學第二醫院 血液凈化中心,天津 300211)
目的:探討維持性血液透析患者骨代謝紊亂和微炎癥反應之間的關系。方法:檢測血液透析患者血漿C反應蛋白、鈣、磷和甲狀旁腺激素及其他臨床生化資料,并計算鈣磷乘積,所得數據與美國腎臟病基金會維持性透析患者骨代謝和骨病控制指南比較,分析各檢測指標間的相關性。結果:在鈣、磷、鈣磷乘積和甲狀旁腺激素4項指標中,均符合指南者共21例(14.6%),與未符合指南組比較,其hs-CRP水平顯著降低(P<0.05),高血壓患者比例亦顯著降低(P<0.05)。所有患者的C反應蛋白與鈣、磷、鈣磷乘積、年齡均顯著正相關(r=0.134、0.132、0.125、0.317,均P<0.05),C反應蛋白與甲狀旁腺激素之間的相關性不顯著。多元線性回歸分析顯示,鈣、磷、鈣磷乘積是C反應蛋白的獨立危險因素(β=0.189、0.113、0.048,均P<0.01)。結論:骨代謝控制良好的維持性血液透析患者微炎癥水平較低,并且微炎癥狀態與骨代謝各指標之間顯著正相關。
血液透析;微炎癥狀態;腎性骨病;鈣磷代謝;C反應蛋白
Author’s addressCenter of Blood Purification,The Centre Hospital of China National Petroleum Corporation,langfang 065000,China
全球慢性腎臟病患者逐年增加,多種原發和繼發的原因可以導致腎功能損害并進行性惡化,最終發展為終末期腎臟病 (end stage renal disease,ESRD)。ESRD患者體內普遍存在微炎癥反應[1],同時ESRD患者體內存在著鈣磷代謝紊亂,并引起甲狀旁腺功能亢進,可能導致廣泛的骨外鈣化,影響患者的生存率[2]。有關炎癥反應和骨代謝紊亂之間的關系國內研究尚少,我們調查了維持性血液透析患者骨代謝現狀,同時分析了炎癥反應標志物高敏C反應蛋白 (high sensitivity C reactive protein,hs-CRP) 和鈣(calcium,Ca)、磷(phosphorus,P)、 鈣磷乘積 (calcium phosphorus product,Ca×P) 及 全 段 甲 狀 旁 腺 激 素 (intact parathyroid hormone,iPTH)之間的關系。
1 對象和方法
1.1 研究對象
選擇天津醫科大學第二醫院血液凈化中心維持性血液透析患者144例,血液透析時間>6個月,每周透析2~3次,每次4h,使用碳酸氫鹽透析液。排除標準:<18歲或>70歲,臨床有明顯感染、肝功能損害、營養不良、惡性腫瘤、風濕免疫病的患者。原發病為慢性腎小球腎炎67例,糖尿病腎病20例,高血壓腎病31例,多囊腎7例,慢性腎盂腎炎9例,痛風腎3例,狼瘡性腎炎2例,慢性間質性腎炎2例,原因不明3例。
1.2 臨床資料
血液透析前空腹抽取靜脈血,檢測血紅蛋白(HGB)、Ca、P、iPTH、白蛋白(Alb)和 hs-CRP 水平,血清iPTH的測定應用放射免疫法,其余指標的測定均采用日立7600全自動生化分析儀,并收集患者性別、年齡、透析持續時間、血壓等臨床資料,血清Ca濃度用血清Alb校正:矯正Ca=血清總 Ca+0.02×(40-血清 Alb)。 Ca、P、Ca×P 和 iPTH與美國腎臟病基金會維持性透析患者骨代謝和骨病控制指南(以下簡稱“指南”)比較,指南建議:慢性腎臟病 5 期(CKD5)血清 Ca:2.10~2.37mmol/L;P:1.13 ~1.78mmol/L;Ca ×P:55mg2/dl2;iPTH:150 ~300pg/ml[3]。
1.3 統計學方法
全部數據采用SPSS17.0統計軟件進行分析,組間比較采用兩獨立樣本的t檢驗,計數資料采用χ2檢驗,相關性分析采用Pearson檢驗。以所有研究對象為整體, 以 Ca、P、Ca×P、iPTH 水平作為自變量,hs-CRP水平作為因變量,進行多元線性回歸分析。
2 結果
2.1 血清生化指標達標情況分析
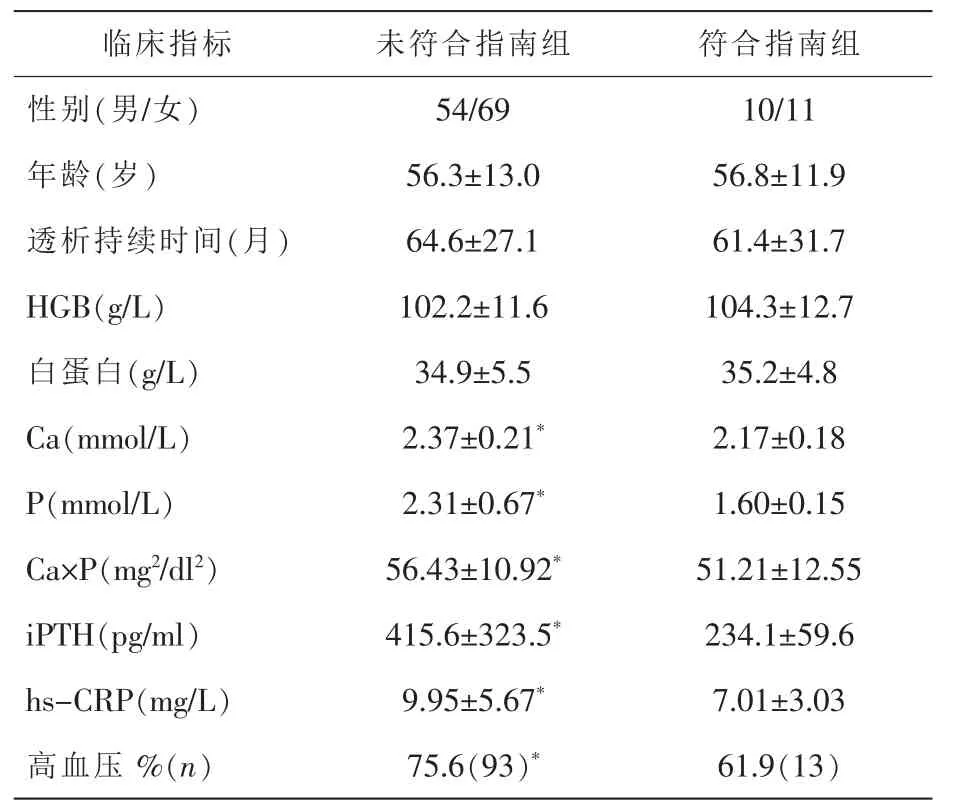
表1 4項指標符合指南組與未符合指南組的臨床資料比較
本組144例血液透析患者血清Ca、Ca×P的平均值(Ca:2.33±0.33mmol/L; Ca×P:53.97±16.63 mg2/dl2)在指南建議范圍內,P和iPTH的平均值(P:2.19 ±0.49mmol/L;iPTH:399.5 ±425.9pg/ml)較指南建議高。
27例(18.8%)Ca濃度低于指南建議范圍,79例 (54.8%)Ca濃度在指南建議范圍內;59例(41.0%)存在高磷血癥,64例(44.4%)達到治療目標;69例 (47.9%)Ca×P滿足指南建議范圍;58例(40.3%)iPTH高于指南建議范圍,30例 (20.8%)iPTH達到指南建議。表1示,4項指標均符合指南者共21例,與未符合指南組比較,其hs-CRP水平顯著降低(P<0.05),高血壓比例亦顯著降低(P<0.05)。
2.2 hs-CRP 與 Ca、P、Ca×P、iPTH 的相關性
全部病例的 hs-CRP與其 Ca、P、Ca×P和年齡均呈正相關關系 (r=0.134,0.132,0.125,0.317,均P<0.05),與透析持續時間及iPTH相關性不明顯(均 P>0.05)。
以 Ca、P、Ca×P和 iPTH 水平作為自變量 X,hs-CRP水平作為因變量Y,進行多元線性回歸分析,結果顯示:Ca、P、Ca×P 是 hs-CRP 的獨立危險因素(β=0.189,0.113,0.048,均 P<0.01)。
3 討論
骨代謝紊亂是慢性腎臟病患者常見的并發癥之一,患者出現維生素D缺乏和甲狀旁腺功能亢進,Ca、P、iPTH是評價腎性骨營養不良的基本指標[4]。 本研究發現在 Ca、P、Ca×P和 iPTH 方面14.6%的患者達到了指南建議,Ca、Ca×P的平均值在指南建議范圍內,P、iPTH的平均值略高于指南建議,大約一半的患者Ca和P達到了指南建議,只有不到1/3的患者iPTH達到了指南建議,這一研究結果和透析預后與實踐模式研究 (DOPPS)[5]近似,鈣磷代謝的異常可導致心血管鈣化的發生,并影響患者的預后,有研究發現 Ca、P、Ca×P、iPTH與透析患者的死亡率相關[6],但是究其原因至今仍不清楚。
透析患者普遍存在著微炎癥狀態[1],微炎癥狀態不同于微生物感染和全身炎癥反應綜合征(SIRS),患者不表現明顯臨床感染癥狀,但是實驗室檢查可發現患者持續存在輕微炎癥反應,主要表現為血液循環中炎性細胞因子、炎性蛋白升高,且持續、隱匿,目前認為這種微炎癥狀態是患者體內單核/巨噬細胞系統持續活化的結果[7]。腎功能衰竭本身、腎臟替代治療和感染等多種因素均促進或加重了微炎癥狀態的發生和發展。
骨代謝紊亂[2,6,8]和微炎癥狀態[9,10]均與透析患者心血管疾病關系密切,但是關于二者之間相互關系的研究尚少,國內有研究發現低鈣透析可以改善維持性血液透析患者的微炎癥狀態,并推測可能與改善鈣磷代謝紊亂有關[11],本研究得到了相近的結果,即Ca、P、Ca×P和iPTH達到指南建議的患者hs-CRP水平顯著降低,在血液透析患者中hs-CRP與Ca、P、Ca×P呈正相關關系。多元線性回歸分析顯示Ca、P、Ca×P是hs-CRP的獨立危險因素。Ca×P升高長期以來一直被認為是骨外鈣化的危險因素,Ca×P每增加10mg2/dl2,透析患者死亡的相對危險度增加11%[12]。有研究[13]顯示,通過降低透析患者Ca×P后其炎癥反應水平降低。我們推測,血清Ca、P、Ca×P和 iPTH 達到指南建議的患者,體內鈣質沉積較少,周圍組織、血管的鈣化降低,從而減弱了微炎癥反應。因此可應用低鈣透析液、活性維生素D3和磷結合劑等改善血液透析患者的鈣磷代謝紊亂,進而抑制微炎癥反應。
然而另一方面,微炎癥狀態也可能影響著鈣磷代謝,胎球蛋白A是一個鈣化抑制因子,廣泛存在于細胞外液中,可影響透析患者Ca、P、Ca×P的水平。慢性腎衰竭患者體內普遍存在的微炎癥狀態可以抑制肝臟胎球蛋白A的合成[14,15],而本研究發現 hs-CRP與 Ca、P、Ca×P呈正相關關系,可以推測增強的微炎癥反應通過抑制胎球蛋白A合成,進而影響鈣磷代謝。
血液透析患者中高血壓十分常見,本研究中非達標組高血壓發生率明顯高于達標組,其原因可能為繼發性甲狀旁腺功能亢進和血鈣水平是高血壓的危險因素[16],說明血液透析患者良好控制的鈣磷代謝有助于降低高血壓的發生;另外,hs-CRP可刺激動脈粥樣硬(AS)的發生[17],AS形成后促進了高血壓的發生。
全部病例中hs-CRP與年齡呈正相關,說明隨著年齡的增加炎癥反應加重,與Wang[18]等的研究結果一致。臨床實驗研究發現iPTH水平可以預測患者的預后[6,19],本研究沒有發現hs-CRP與iPTH之間存在相關性,可能提示甲狀旁腺功能亢進與透析患者微炎癥狀態無關。
本研究是一個單中心的臨床研究,以后應進行多中心、大樣本調查,以增強說服力。本研究從臨床數據推測慢性腎臟病患者骨代謝紊亂和微炎癥狀態之間的關系,尚需細胞分子水平的研究進一步探討其相互關系及作用機制。
[1]Schomig M,Eisenhardt A,Ritz E.The microinflammatory state of uremia[J].Blood Purif,2000,18(4):327-332.
[2]Block GA,Klassen PS,Lazarus JM,et al.Mineral metabolism,mortality,and morbidity in maintenance hemodialysis[J].J Am Soc Nephrol,2004,15(8):2208-2218.
[3]National Kidney Foundation.K/DOQI:Clinical practice guidelines for bone metabolism and disease in chronic kidney disease[J].Am J Kidney Dis,2003,42:S1-201.
[4]Ho LT,Sprague SM.Renal osteodystrophy in chronic renal failure[J].Semin Nephrol,2002,22(6):488-493.
[5]Young EW,Akiba T,Albert JM,et al.Magnitude and impact of abnormal mineral metabolism in hemodialysis patients in the Dialysis Outcomes and Practice Patterns Study(DOPPS)[J].Am J Kidney Dis,2004,44(5 Suppl 2):34-38.
[6]Slinin Y,Foley RN,Collins AJ.Calcium,phosphorus,parathyroid hormone,and cardiovascular disease in hemodialysis patients:the USRDS waves 1,3 and 4 study[J].J Am Soc Nephrol,2005,16(6):1788-1793.
[7]Bergstrom J,Lindholm B,Jr Lacson E,et al.What are the causes and consequences of the chronic inflammatory state in chronic dialysis patients?[J].Semin Dial,2000,13(3):163-175.
[8]Young EW,AlbertJM,Satayathum S,etal.Predictorsand consequences ofaltered mineralmetabolism:the dialysis outcomes and practice patterns study[J].Kidney Int,2005,67(3):1179-1187.
[9]Parekh RS,Plantinga LC,Kao WH,et al.The association of sudden cardiac death with inflammation and other traditional risk factors[J].Kidney Int,2008,74(10):1335-1342.
[10]Panichi V,PaolettiS,ConsaniC.Inflammatorypattern in hemodiafiltration[J].Contrib Nephrol,2008,161:185-190.
[11]蔡曉萍,張悅,劉曉斌,等.低鈣透析對維持性血液透析患者微炎癥狀態的影響[J].南京醫科大學學報(自然科學版),2010,1360-1361.
[12]Block GA,Port FK.Re-evaluation of risks associated with hyperphosphatemia and hyperparathyroidism in dialysis patients:recommendations for a change in management[J].Am J Kidney Dis,2000,35(6):1226-1237.
[13]Movilli E,Feliciani A,Camerini C,et al.A high calciumphosphate product is associated with high C-reactive protein concentrations in hemodialysis patients[J].Nephron Clin Pract,2005,101(4):161-167.
[14]Cozzolino M,Galassi A,Biondi ML,et al.Serum fetuin-A levels link inflammation and cardiovascular calcification in hemodialysis patients[J].Am J Nephrol,2006,26 (5):423-429.
[15]Dervisoglu E,Kir HM,Kalender B,et al.Serum fetuin-a concentrations are inversely related to cytokine concentrations in patients with chronic renal failure[J].Cytokine,2008,44(3):323-327.
[16]王磊,王梅.維持性血液透析患者高血壓的控制及其相關因素分析[J].中國血液凈化,2009,84-87.
[17]Papagianni A,Kalovoulos M,Kirmizis D,et al.Carotid atherosclerosisisassociated with inflammation and endothelial cell adhesion molecules in chronic haemodialysis patients[J].Nephrol Dial Transplant,2003,18(1):113-119.
[18]Wang AY,Woo J,Lam CW,et al.Is a single time point C-reactive protein predictive of outcome in peritoneal dialysis patients?[J].J Am Soc Nephrol,2003,14(7):1871-1879.
[19]Drechsler C,Krane V,Grootendorst DC,et al.The association between parathyroid hormone and mortality in dialysis patients is modified by wasting[J].Nephrol Dial Transplant,2009,24(10):3151-3157.
Association between C reactive protein and the dysregulation of bone and mineral metabolism inhemodialysis patients
MA Li-ping,DI Zhi-peng,YU Wen-hui,et al//Journal of China-Japan Friendship Hospital,2011 Oct,25(5):279-281
Objective:To study the relationship between the disorder of bone metabolism and microinflammation in hemodialysis patients.Methods:Clinical biochemistry information of hemodialysis patients was collected,including plasma high sensitivity C reactive protein(hs-CRP),calcium(Ca),phosphorus(P)and intact parathyroid hormone(iPTH)and other biochemical data,and calculate the calcium phosphate product(Ca×P).The data was compared with the recommended range in the guidelines for bone metabolism and disease in chronic kidney disease (K/DOQI)and the relationship between the data were analyzed.Results:In Ca,P,Ca×P and iPTH,a total of 21(14.6%)patients met the recommended range in the K/DOQI guidelines and they had a significantly lower level of hs-CRP (P <0.05).The hs-CRP level was directly related to Ca,P,Ca ×P and age (r=0.134,0.132,0.125,0.317,all P<0.05).There was no correlation between hsCRP and iPTH.Multivariate regression analysis revealed that the independent associations of hs-CRP were with underlying Ca,P and Ca×P levels(β=0.189,0.113,0.048,all P<0.01).Conclusion:The hemodialysis patients whose bone metabolism are better controlled have a lower level of microinflammatory.There is an association between the dysregulation of bone and mineral metabolism and chronic inflammation in hemodialysis patients.
hemodialysis;microinflammatory;renal bone disease;calcium and phosphorus metabolism;C reactive protein
R459.5
A
1001-0025(2011)05-0279-03
10.3969/j.issn.1001-0025.2011.05.007
馬立萍(1963-),女,副主任醫師。
2011-06-08 第2次
2011-09-08

