溶氧控制對黃色短桿菌YILW合成L-異亮氨酸的影響
白亞磊,徐慶陽,謝希賢,陳 寧
(工業微生物教育部重點實驗室,天津科技大學生物工程學院,天津 300457)
溶氧控制對黃色短桿菌YILW合成L-異亮氨酸的影響
白亞磊,徐慶陽,謝希賢,陳 寧
(工業微生物教育部重點實驗室,天津科技大學生物工程學院,天津 300457)
對黃色短桿菌YILW合成L–異亮氨酸的發酵溶氧條件進行了探索,構建了該菌合成L–異亮氨酸的代謝網絡和代謝流平衡模型.在 30 L發酵罐中考察了不同溶氧濃度下 L–異亮氨酸發酵過程.研究結果表明:高溶氧濃度有利于菌體生長,15%溶氧濃度下產酸速率高且維持的時間長,有利于 L–異亮氨酸的積累.為此提出了分段控氧模式:在菌體生長期,溶氧濃度控制為 25%;在產酸穩定期,溶氧濃度控制為15%.在此溶氧控制模式下,在30 L發酵罐上補料分批發酵60 h,L–異亮氨酸產量可達31.8 g/L,糖酸轉化率可達18.3%,且乳酸、丙氨酸等副酸明顯減少.對此結果運用代謝流分析的方法進行論證,旨在從量的角度理解溶氧對 L–異亮氨酸合成的影響提供理論基礎,對進一步優化 L–異亮氨酸發酵溶氧條件提供理論指導.
L–異亮氨酸;溶氧;分段控氧模式;代謝流分析
Abstract:The condition of dissolved oxygen of L-isoleucine synthesis in Brevibacterium flavum YILW was explored,and the metabolic networks and metabolic flux balance model were constructed. The fermentation processes were studied on the condition of different dissolved oxygen in 30 L fermenter. The results show that high dissolved oxygen leads to bacterium growth. Higher production ratio of L-isoleucine maintains a long time under the condition of 15% dissolved oxygen. Thus the grading-controlling mode of dissolved oxygen was proposed: 25%dissolved oxygen concentration in the cell growth phase and 15% dissolved oxygen concentration in the phase of acid stable. Under this strategy,the yield of L-isoleucine is 31.8 g/L in 30 L fermenter in 60 h,and the conversion of sugar to acid is up to 18.3%. The vice acid is reduced significantly such as lactic,alanine. The results was demonstrated by using the method of metabolic flux analysis,providing a theoretical basis for the in-depth understanding from the perspective of the amount of dissolved oxygen on L-isoleucine fermentation,and providing a theoretical guidance for further optimization of L-isoleucine fermentation condition of dissolved oxygen.
Keywords:L-isoleucine;dissolved oxygen;phase oxygen control model;metabolic flux analysis
L–異亮氨酸(Ile)是人體8種必需氨基酸之一,除用于一般營養型復合氨基酸輸液、要素膳外,還大量用于配制治療型特種氨基酸輸液,如肝安、腎安氨基酸輸液,對治療各種肝臟疾病具有顯著療效[1].
由葡萄糖直接合成 L–異亮氨酸的途徑較長且復雜.常高峰等[2]通過對黃色短桿菌生產 L–異亮氨酸的發酵代謝分析得出,在 L–異亮氨酸的發酵過程中有纈氨酸、丙氨酸及乳酸等雜酸積累,副產物的生成造成了碳源的浪費.王健等[3]通過對 L–異亮氨酸的代謝途徑分析得出,減弱TCA循環和乙醛酸支路,可以使更多的碳架流轉向異亮氨酸的合成.宋文軍等[4]研究表明,在 L–異亮氨酸生物合成中,若 TCA 途徑流量過大,會導致 L–異亮氨酸的代謝流減少.故減弱TCA途徑可以提高發酵過程中 L–異亮氨酸產酸水平.但是采取不同的措施,究竟對L–異亮氨酸的代謝流分布的影響有多大,尚未從量的角度給以闡釋.
本文考察了不同階段的溶氧供應量,確定了不同階段最佳溶氧供應量;采用代謝流分析方法,定量地描述了溶氧條件優化前后黃色短桿菌YILW合成L–異亮氨酸代謝流的分布.為進一步改造菌種及優化發酵過程控制,從而提高 L–異亮氨酸的發酵得率提供理論依據.
1 材料與方法
1.1 菌株
黃色短桿菌(Brevibacterium flavum)YILW(LeuL+AHVr+SGr+Leu-MEr)為天津科技大學代謝工程研究室保藏菌種.
1.2 培養基(g/L)
活化培養基:葡萄糖 1,酵母粉 5,蛋白胨 10,氯化鈉 2.5,瓊脂 25,pH,7.0~7.2,0.1,MPa滅菌 20,min.
種子培養基:葡萄糖30,酵母粉5,(NH4)2SO4,3,KH2PO4·3H2O,1.5 ,MgSO4·7H2O,0.6 ,FeSO4·7H2O,0.01,MnSO4·H2O,0.01,玉米漿 30,mL,豆餅水解液30,mL,pH,7.0~7.2,0.1,MPa,滅菌 15,min.
發酵培養基:葡萄糖 80,(NH4)2SO4,4,FeSO4·7H2O,0.015 ,MgSO4·7H2O,0.5 ,MnSO4·H2O,0.015 ,KH2PO4·3H2O,1.5 ,K2HPO4·3H2O,3 ,VH,100,μg ,VB15,mg,豆餅水解液 20,mL,玉米漿 15,mL,pH,7.0~7.2,0.075,,MPa,滅菌 15,min.
1.3 培養方法
活化斜面培養:31,℃恒溫培養36,h.
5,L種子罐(上海保興生物設備工程有限公司)培養:吸取適量無菌生理鹽水于5支活化斜面中,將所有菌懸液接入裝5,L種子罐中,初始裝液量為3,L,初始通氣量 2,L/min,攪拌轉速 300~600,r/min,通過自動流加氨水控制 pH(7.0±0.2),培養溫度 31,℃,以泡敵消泡.培養12,h后,按10%接種量接入發酵培養基中.
30,L發酵罐(上海保興生物設備工程有限公司)培養:按10%接種量將種子液接入30,L發酵罐中,初始裝液量為 16,L,發酵中后期流加 80%液體葡萄糖,初始通氣量1,m3/h;攪拌轉速300~800,r/min;通過自動流加氨水控制pH(7.0±0.2),培養溫度 31,℃,以泡敵消泡,發酵60,h.
1.4 測定方法
菌體濃度測定:發酵液經蒸餾水稀釋20倍后,在波長 560,nm 下用 V–1200型分光光度計(上海美譜達儀器有限公司)測定吸光度.
菌體生物量測定:菌體生物量以菌體干質量表示,取10 mL發酵液,8 000 r/min離心10 min,將菌體用蒸餾水洗滌 2次后置于 DZF–6020型真空干燥箱(上海博迅實業有限公司)中,80,℃干燥至恒質量,用 FA2204B型分析天平(上海精密科學儀器有限公司)稱質量.
溶氧及 pH測定(Oxyferm 225型溶氧電極、Easyferm Plus,225型pH電極,Hamilton公司):在線測定.溶氧標定以飽和亞硫酸鈉溶液中的氧氣濃度為0,以空氣中的氧氣濃度為100%.
葡萄糖及乳酸濃度:采用 SBA–40C型生物傳感儀(山東省科學院生物研究所)進行測定.
L–異亮氨酸、其他氨基酸濃度的測定:L–異亮氨酸及其他氨基酸含量采用 Agilent,1200型高效液相分析系統(Agilent Technologies公司)測定,色譜分離條件:Agilent C18(150,mm×4.6 mm,3.5,μm)為色譜分離柱,2,4–二硝基氟苯柱前衍生測定,乙腈與 NaAc溶液進行梯度洗脫,柱溫 33,℃,流動相流量1,mL/min,檢測波長360,nm.
1.5 數據處理
發酵過程中菌體比生長速率μ根據式(1)計算[5]

式中:X、x均為菌體量;t為時間.用 Origin繪圖軟件對實驗數據進行微分計算,再用 Excel軟件求解不同時刻的μ.
1.6 代謝流計算
MFA以擬穩態假設為基礎,假設細胞內的中間代謝物均處于擬穩態,即其濃度變化速率為 0.本文采用 Vallino等[6]的方法,根據物料平衡按照式(2)計算代謝物的積累速率
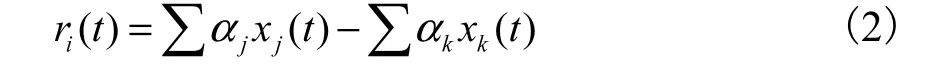
式中:xj(t)為第 j步反應的反應速率,mmol/(L·h);xk(t)為第 k 步反應的反應速率,mmol/(L·h);αj為第 j步反應的反應計量系數;αk為第k步反應的反應計量系數;ri(t)為中間代謝物i的積累速率,mmol/(L·h).
由擬穩態假定可得ri(t)=0.代謝網絡中的m個中間代謝物構成 m個代謝流平衡方程式,可寫成式(3)矩陣形式

式中:A,m×n維矩陣;X,n×1維矩陣,n為選定的速率總數目.
這樣由m個中間代謝物即可得到m個關于速率的約束條件,待解問題的自由度為 F=n-m,通過實驗測出F個不相關速率即可確定胞內整體流量分布,從而對其生理行為進行定量的描述.
2 結果與討論
2.1 不同溶氧濃度條件對菌體生長的影響
由于菌體在不同生理階段對氧的需求不同,溶氧過高或過低都對正常發酵過程不利.溶氧過高會導致后期菌的活力降低,溶氧過低會影響前期菌體的生長[7–8].因此考察 5%、15%、25%、35%和 45%溶氧條件下對 L–異亮氨酸發酵過程中菌體量的影響,結果如圖1所示.
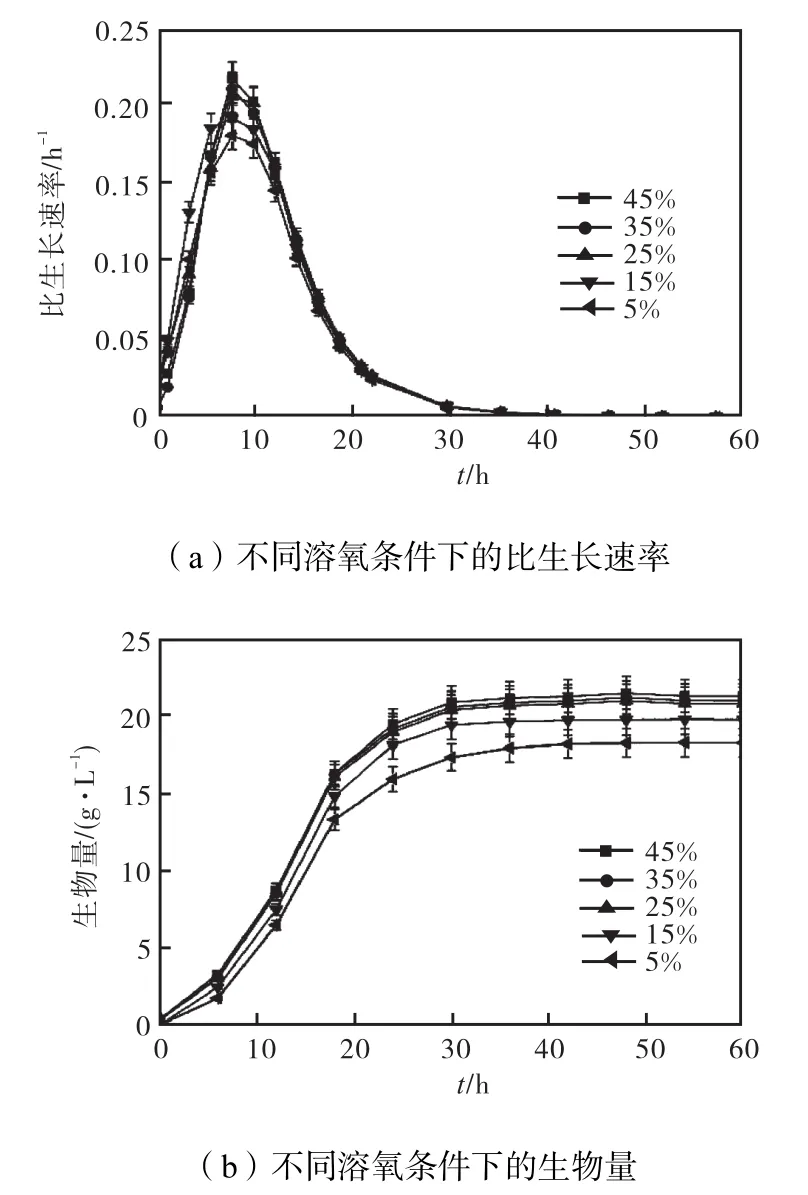
圖1 不同溶氧濃度條件對菌體生長的影響Fig.1 Different dissolved oxygen conditions on cell growth
由圖 1可知:隨著溶氧濃度的增大,比生長速率和生物量都在逐漸增大;當溶氧濃度達到 25%后,溶氧濃度再增加,比生長速率和生物量增加的幅度都很小.這表明當溶氧濃度控制在 25%、35%和 45%時,比較有利于細胞生長,可保持較快的生長速率,且在20,h后 3種情況下的菌體量基本達到穩定,高達21,g/L.當溶氧較低時,菌體的生長呼吸得不到滿足,生長受限,致使菌體濃度過低,影響發酵中后期 L–異亮氨酸的產酸速率.綜合考慮確定 25%溶氧作為菌體生長的最適溶氧濃度.
2.2 不同溶氧條件對產酸穩定期產酸速率的影響
根據上述菌體生長曲線可知,在發酵前 20,h基本上完成了菌體量的積累,20,h后進入產酸穩定期.以下考察了產酸穩定期,即發酵 20,h后,分別以5%、15%、25%、35%、45%的溶氧濃度控制時的產酸速率,結果如圖2所示.
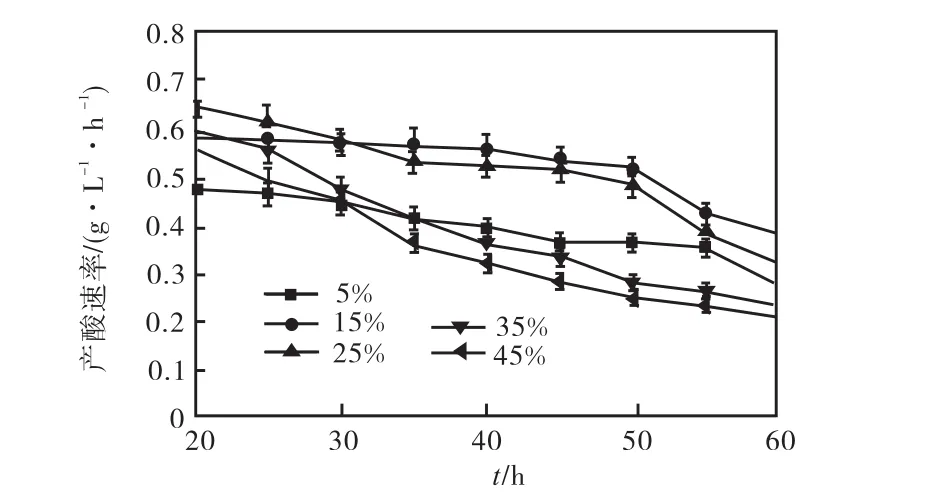
圖2 不同溶氧濃度下的產酸速率Fig.2 Acid production rate under different dissolved oxygen
由圖2可知:在5%溶氧條件下,雖然產酸速率比較穩定,但是產酸速率比較小,對 L–異亮氨酸的積累不利;在 35%和 45%溶氧條件下,雖然在產酸穩定期開始時有較高的產酸速率,但是隨著發酵時間的延長,產酸速率呈下降趨勢,對酸的積累也有影響;而在15%和 25%溶氧條件下,產酸穩定期開始時不但有較高的產酸速率,高達 0.6,g/(L·h),而且較高的產酸速率維持的時間也較長,有利于L–異亮氨酸的積累.
2.3 L–異亮氨酸生物合成代謝流平衡模型的建立
2.3.1 代謝網絡的構建
在黃色短桿菌中,存在 EMP、TCA 和 HMP途徑,HMP途徑能為氨基酸合成提供大量的還原力NADPH,在L–異亮氨酸合成中意義重大.
基于以下原則建立代謝網絡:(1)細胞處于非生長時期或細胞濃度變化不大可以忽略;(2)細胞代謝過程中乙醛酸途徑微弱,所以不考慮乙醛酸循環;(3)反應途徑產生的NADPH與TCA循環、HMP途徑產生的NADPH總數相等;(4)在細胞生長不旺盛階段,由于大量無效循環的存在,ATP 的消耗量和細胞維持能總量并不相等,因此本文不考慮 ATP總量的平衡;(5)按固定比例進行的反應以及無分支的中間反應,盡量簡化為一個反應方程;(6)本文所用菌株為亮氨酸滲漏型,所以不考慮亮氨酸支路.L–異亮氨酸合成代謝網絡圖如圖3所示.
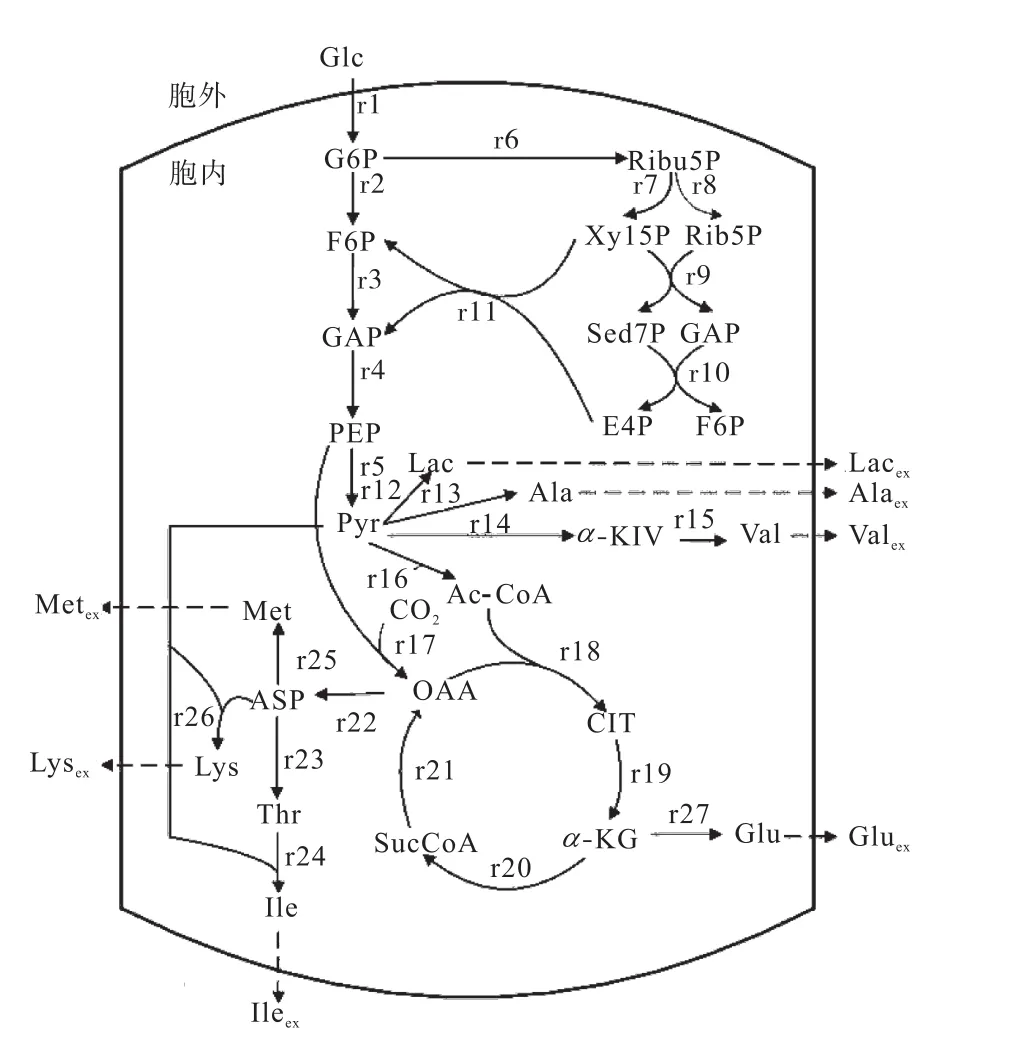
圖3 L–異亮氨酸生物合成代謝網絡Fig.3 Biosynthesis metabolic network of L-isoleucine
2.3.2 代謝流平衡模型方程組的建立
根據以上分析及有關的文獻[9]報道,代謝節點處的方程如下:

方程組由 19個方程組成,27個未知數,自由度為 8,只需要測定發酵液中 8種物質的反應速率就可確定代謝流的分配情況,在本實驗所用的發酵液中檢出葡萄糖、異亮氨酸、丙氨酸、賴氨酸、纈氨酸、蛋氨酸、谷氨酸及乳酸的濃度,計算各自的消耗或積累速率,結果見表1.
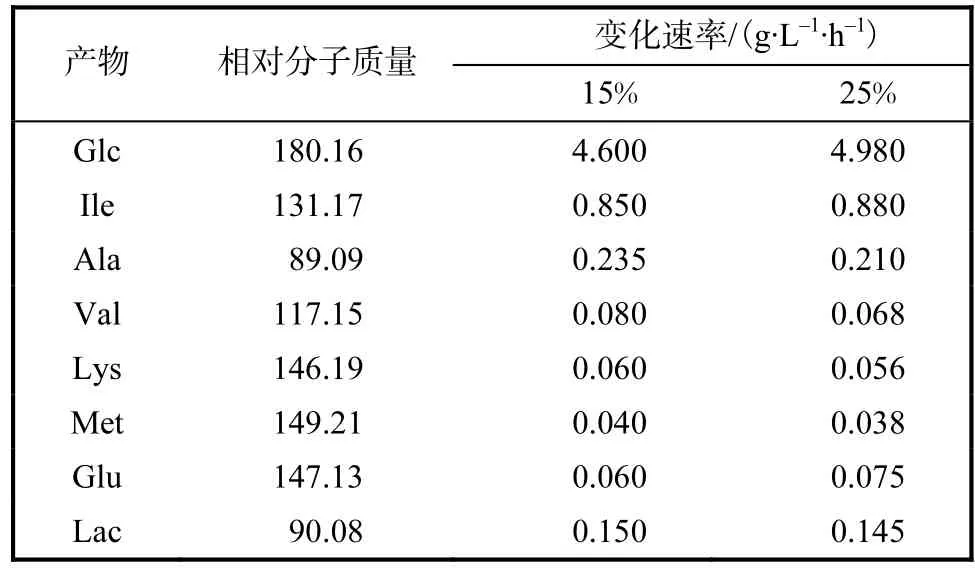
表1 產酸穩定期主要代謝產物變化速率Tab.1 Variation rate of major metabolite in the phase of acid stable
利用 Matlab軟件linprog函數,結合表1中測得的代謝物的消耗或累計速率,為了便于計算,葡萄糖摩爾消耗速率假定為 100,mmol/(L·h),求得兩種溶氧條件下的代謝流分布如圖4所示.
進入產酸穩定期,菌體基本不再增長,碳架導向L–異亮氨酸的合成.天冬氨酸為 L–異亮氨酸生物合成的前體,增大天冬氨酸的代謝流可以提高 L–異亮氨酸產量,而天冬氨酸又由草酰乙酸合成,因此,增大磷酸烯醇式丙酮酸到草酰乙酸的流量有利于更多的碳架流向目的產物.HMP途徑作為提供 NADPH的主要途徑,增大HMP途徑的代謝流是提高L–異亮氨酸生物合成所必需的[10].由圖 4可以看出:產酸穩定期內,在 15%和 25%溶氧條件下,由磷酸烯醇式丙酮酸通往草酰乙酸的r17流量分別為31.78,mmol/(L·h)和 30.11,mmol/(L·h),其中流向 L–異亮氨酸分別為25.38,mmol/(L·h)和 24.30,mmol/(L·h);通往 HMP 途徑的 r,6流量分別為 20.51,mmol/(L·h)和 11.06,mmol/(L·h);同時在 15%溶氧條件下,乳酸、丙氨酸等副酸比在 25%條件下的流量要小.比較兩種情況下的代謝流分布,在15%溶氧下的代謝流分布比在25%溶氧下的更有利于 L–異亮氨酸的積累.故在產酸穩定期,在 15%溶氧控制條件下,更多的碳架導向了 L–異亮氨酸的合成.這也說明了圖 2中 15%溶氧條件下比在25%溶氧下產酸速率高的原因.
綜上所述,發酵前期是菌體生長旺盛的時期,L–異亮氨酸合成量較少,提高溶氧濃度有利于菌體生長,25%溶氧較為適合生長期菌體生長需要.在產酸穩定期,菌體濃度基本不變,L–異亮氨酸大量合成,降低溶氧濃度,可增加前體物質天冬氨酸和NADPH的量,使得通往 L–異亮氨酸的代謝流增加.運用代謝流分析可知:15%溶氧下更有利于產酸穩定期 L–異亮氨酸的積累.
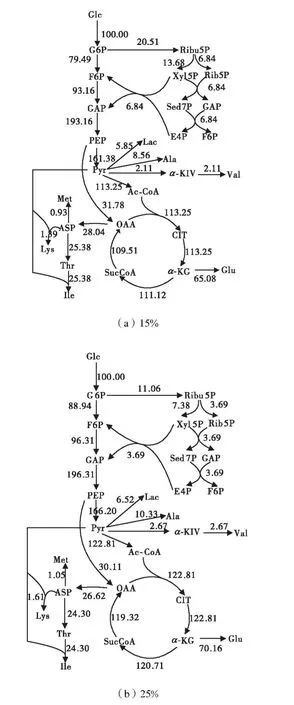
圖4 產酸穩定期的代謝流分布圖Fig.4 Metabolic flux distribution in the phase of acid stable
2.4 產酸穩定期兩種控氧模式下 L–異亮氨酸及主要副酸的變化情況
在產酸穩定期控制不同溶氧,由圖5兩種溶氧控制策略下的目的產物與副酸的累積量可知:在 15%溶氧條件下,目的產物 L–異亮氨酸的累積量比在 25%溶氧條件下的大;而乳酸、丙氨酸等副酸的累積量相對 25%溶氧下有所減少,這與上述代謝流分析結果是一致的.
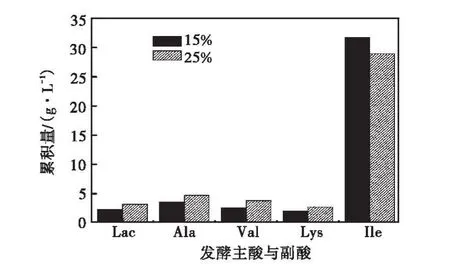
圖5 產酸穩定期的主產物與副酸累積量Fig.5 Accumulation of the main product and vice acid in Fig.5 the phase of acid stable
3 結 論
在 L–異亮氨酸發酵過程中,在不同溶氧條件下,L–異亮氨酸的累積量有很大的不同,15%溶氧時為31.8,g/L,25%時為 27.3,g/L.因此根據代謝流分析結果確立了溶氧分段控制模式:菌體生長期,維持溶氧25%;產酸穩定期,維持溶氧 15%.在該溶氧控制模式下,通過 30,L罐補料分批發酵 60,h,產酸可達31.8,g/L,糖酸轉化率可達 18.3%,同時副酸的積累也大大下降.由此說明,在 L–異亮氨酸發酵過程中,溶氧的控制對發酵過程有很大的影響,在不同的階段控制不同的溶氧水平,不但對目的產物的累積量有很大影響,同時對副產物的積累也有很大的影響,副酸的減少不但可以減少發酵過程中的原料浪費,而且還對下游提取工作有利,可以降低提取難度和減少提取過程中的能耗.
[1] 宋文軍,陳寧,魏春,等. 基于代謝流導向與分析的 L-異亮氨酸發酵條件優化[J]. 天津輕工業學院學報,2003,18(2):15–19.
[2] 常高峰,陳寧. L-異亮氨酸發酵代謝分析[J]. 生物技術通訊,2003,14(6):502–505.
[3] 王健,王志誠,田梁邐霞,等. 產生 L-異亮氨酸的黃色短桿菌的代謝途徑分析[J]. 生物技術通訊,2006,17(4):593–596.
[4] 宋文軍,張克旭,張坤生,等. 不同供氧條件對 L-異亮氨酸合成代謝流的影響[J]. 中國食品學報,2003,3(1):1–6.
[5] 李會,李莎,馮小海,等. Alcaligens sp. NX-3產威蘭膠的補料分批發酵[J]. 食品與發酵工業,2009,35(1):1-4.
[6] Vallino J J,Stephanopoulos G. Metabolic flux distributions in Corynebacterium glutamicum during growth andlysine overproduction[J]. Biotechnol and Bioeng,1993,41:633-646.
[7] 徐慶陽,馮志彬,孫玉華,等. 溶氧對 L-蘇氨酸發酵的影響[J]. 微生物學通報,2007,34(2):312-314.
[8] Okino S,Suda M,Fujikura K,et al. Production of D-lactic acid by Corynebacterium glutamicum under oxygen deprivation[J]. Appl Microbiol Biotechnol,2008,78(3):449-454.
[9] 陳寧,劉輝. 檸檬酸鈉對L-亮氨酸發酵代謝流分布的影響[J]. 高校化學工程學報,2008,22(3):478–482.
[10] Ruklisha M,Paegle L,Denina I. L-Valine biosynthesis during batch and fed-batch cultivations of Corynebacterium glutamicum:Relationship between changes in bacterial growth rate and intracellular metabolism[J].Process Biochemistry,2007,42(4):634–640.
Effect of Dissolved Oxygen Control on L-isoleucine Synthesis by Brevibacterium flavum YILW
BAI Ya-lei,XU Qing-yang,XIE Xi-xian,CHEN Ning
(Key Laboratory of Industrial Microbiology,Ministry of Education,College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
Q815
A
1672-6510(2011)01-0005-05
2010-09-10;
2010-11-16
天津市應用基礎及前沿技術研究計劃項目(08JCZDJC15400)
白亞磊(1985—),男,河南平頂山人,碩士研究生;通信作者:陳 寧,教授,ningch@tust.edu.cn.

