采后青花菜花球抗氧化水平變化與衰老的關系
趙習姮,李進才
(天津大學農業與生物工程學院,天津,300072)
采后青花菜花球抗氧化水平變化與衰老的關系
趙習姮,李進才
(天津大學農業與生物工程學院,天津,300072)
為 研究采后青花菜花球抗氧化水平變化與衰老的關系,將采后青花菜花球貯藏于20℃條件下,連續4 d測定了花蕾衰老生理指標(葉綠素、蛋白質、丙二醛(MDA)含量)及抗氧化水平指標(抗壞血酸(AsA)和β-胡蘿卜素(β-Car)含量、超氧化物岐化酶(SOD)、過氧化氫酶(CAT)、過氧化物酶(POD)和抗壞血酸過氧化氫酶(APX)活性)。結果表明:貯藏過程中,葉綠素和蛋白質含量逐漸減少,MDA含量逐漸增多;AsA和β-Car含量逐漸減少,SOD、CAT和POD活性逐漸升高,APX活性逐漸降低;這些抗氧化水平指標與衰老生理指標的線性相關性均在1%水平顯著。說明采后青花菜花球的抗氧化水平變化與衰老密切相關。
采 后,青花菜,抗氧化水平,衰老,相關性
青花菜(Brassica oleracea L.Var.italica)花球顏色翠綠、質地柔嫩、味道鮮美、營養豐富,但采后花球易衰老黃花,品質劣變較快。不少學者從貯藏溫度[1-2]、包裝方式[2-3]、真空預冷[4]、輻射[5]、冷熱激[6]以及化學物質處理[7-10]等對采后青花菜的保鮮效果進行了研究,但大部分是從抗氧化水平變化探討抑制花球衰老的效果及保鮮機理。
研究采后青花菜花球的抗氧化水平變化與衰老間的關系,可以為青花菜保鮮研究、技術開發及新品種選育等提供重要理論信息。為此,將采后青花菜花球貯藏于20℃條件下,連續4 d測量了花蕾衰老色彩指標(色調角),同時測定了衰老生理指標(葉綠素、蛋白質和丙二醛(MDA)含量)及抗氧化水平指標(抗氧化物質抗壞血酸(AsA)和β-胡蘿卜素(β-Car)含量、抗氧化酶超氧化物岐化酶(SOD)、過氧化氫酶(CAT)、過氧化物酶(POD)和抗壞血酸過氧化氫酶(APX)活性),對各抗氧化水平指標與衰老生理指標之間的相關性進行了分析和討論。
1 材料與方法
1.1 供試材料
供試青花菜品種為‘高地 SP’(‘Heights SP’),春季栽培6月下旬采收,采收基準為所有花球花蕾清晰可見、無花蕾開放,采收后20℃恒溫條件貯藏。
1.2 色彩測量及取樣
20℃貯藏3 h后(作為貯藏開始),隨機取3個花球,用色彩色差儀(CR-10,Minolta)進行花球花蕾的色彩測量,每個花球均勻分散測量6點,據色彩a*(紅-綠)、b*(黃-藍)測量值,算出色調角 h°,h°=180°+tan-1(b*/a*),式中 a*<0,b*>0。色彩測量后迅速進行花蕾取樣,用于衰老生理指標和抗氧化水平指標測定。均勻分散選取花球花蕾,每個花球取樣4份,每份樣品2 g,低溫-80℃保存。以后每天進行一次花蕾的色彩測量和取樣,至貯藏第4天實驗處理結束。
1.3 衰老生理指標測定
實驗處理結束后,迅速進行衰老生理指標測定,葉綠素、蛋白質含量測定分別采用Arnon(1949)[11]和Lowry等(1951)[12]的分光光度比色法,MDA含量測定采用硫代巴比妥酸法[13]。
1.4 抗氧化指標測定
在衰老生理指標測定同時,進行抗氧化指標測定。AsA定量采用2,6-二氯酚靛酚還原滴定法[14]。β-Car定量采用液相色譜法,用80%丙酮磨碎抽出后,加乙醚和水萃取,萃取液在暗處吹氣態氮蒸發除去有機溶劑后,加1 mL乙醚溶解用于液相色譜分析。液相色譜儀系統為L-6200泵(Hitachi)和L-4200 UVVIS檢測儀(Hitachi),采用 Kaseisorb LC ODS-120-5(4.6 mm×250 mm)色譜柱,柱溫30℃,檢出液5.0 μL,移動相為乙酸乙酯50%、乙腈10%和甲醇40%的混合溶液,流速0.7 mL/min,檢出波長450 nm。
SOD 活性測定采用 NBT 法[15],CAT、POD、APX活性測定分別采用 Li等 (2001)[16]、Kochba 等(1977)[17]、Nakano 等(1981)[18]的方法。
1.5 數據分析
用Excel 2000軟件進行數據標準偏差、線性回歸分析,相關系數的差異顯著性分析采用t-檢驗法,以*和**分別表示0.05和0.01水平相關性的顯著差異。
2 結果與分析
2.1 色調角和衰老生理指標的變化
采后青花菜花球,隨著呼吸作用的不斷進行,花蕾逐漸衰老黃化、品質持續下降。色調角是反映花球衰老和品質變化的外觀指標,葉綠素、蛋白質含量減少及膜脂質過氧化終產物MDA積累增多,是綠色植物組織衰老過程中變化顯著的生理現象。
青花菜花球在20℃貯藏條件下,花蕾的色調角在貯藏2 d內下降較小,之后下降很快,貯藏時間與色調角的線性相關性在5%水平顯著;貯藏期間,衰老生理指標花蕾葉綠素和蛋白質含量逐漸減少,MDA含量逐漸增多,貯藏時間與3個衰老生理指標的線性相關性在1%水平顯著(圖1)。葉綠素、蛋白質和MDA含量3個衰老生理指標,較色調角外觀衰老指標更能反映青花菜衰老的時間變化。這些結果與 Li等[1-3,5,7,9-10,19-20]觀測到的結果一致。
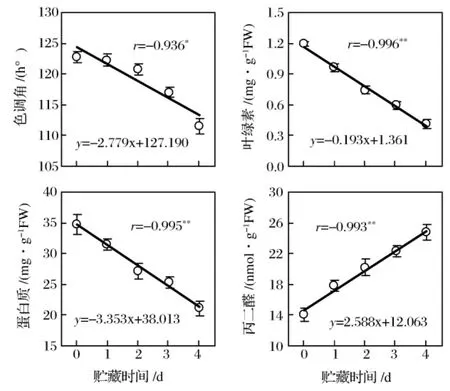
圖1 青花菜在20℃貯藏過程中花蕾的色調角、葉綠素、蛋白質及丙二醛含量的變化及與貯藏時間的相關性
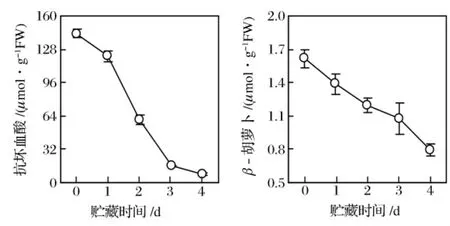
圖2 青花菜在20℃貯藏過程中花蕾的抗壞血酸和β-胡蘿卜素含量的變化
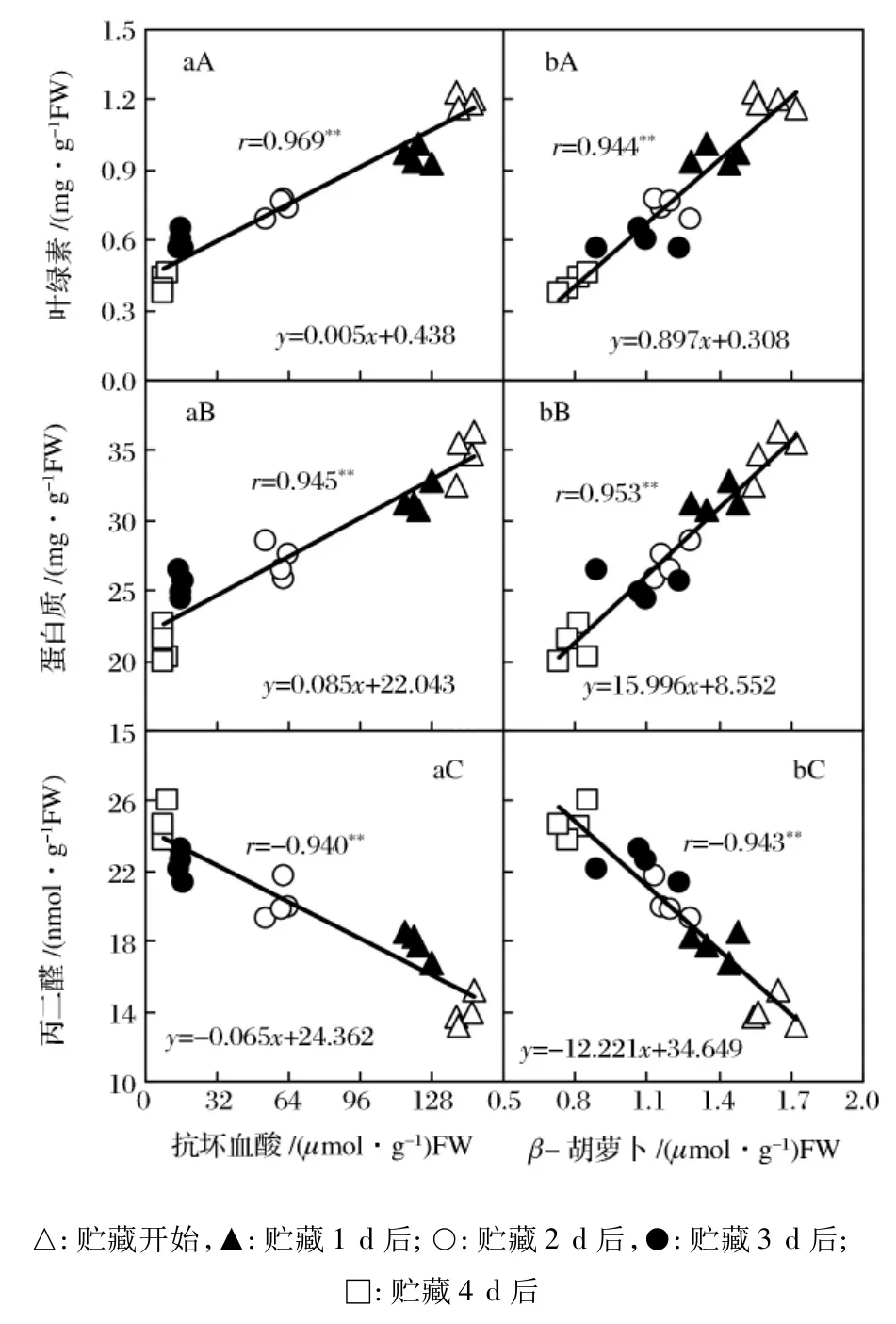
圖3 青花菜在20℃貯藏過程中花蕾的抗壞血酸(a)、β-胡蘿卜素(b)含量與葉綠素(A)、蛋白質(B)及丙二醛(C)含量的相關性
2.2 抗氧化物質含量與衰老生理指標的關系
青花菜花球在20oC貯藏過程中,花蕾的AsA和β-Car含量逐漸減少(圖 2),與 Li等(2004)[1,3,5,8,10,21]觀測到的結果一致。
AsA和β-Car是青花菜花球的主要營養成分,具有消除活性氧、抑制衰老等生理作用:AsA可以捕捉活性氧、抑制膜脂質過氧化反應,還作為特異電子供體對維持APX的活性起重要作用;β-Car具有抑制活性氧發生和消除葉綠體內高氧化活性單線態氧的抗氧化作用。青花菜花球在20℃過程中,花蕾的AsA、β-Car含量與衰老生理指標葉綠素及蛋白質含量線性正相關、與MDA含量線性負相關,且均在1%水平顯著;其中以AsA與葉綠素、β-Car與蛋白質的相關性較高,相關系數大于0.95(圖3)。這些結果表明,采后青花菜花球的AsA和β-Car含量減少與衰老密切相關。
2.3 抗氧化酶活性與衰老生理指標的關系
青花菜花球在20℃貯藏過程中,花蕾的SOD、CAT和POD活性逐漸升高、APX活性逐漸降低(圖4),與 Li等(2004)[1-3,7-9,21]觀測到的結果一致。
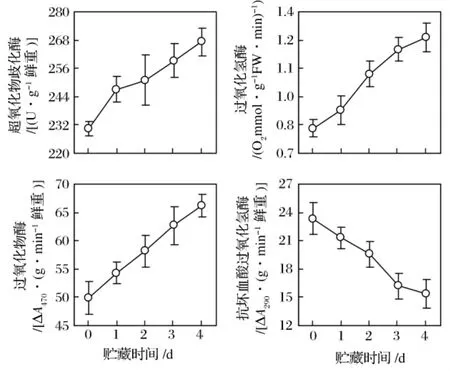
圖4 青花菜在20℃貯藏過程中花蕾的超氧化物岐化酶、過氧化氫酶、過氧化物酶及抗壞血酸過氧化氫酶活性的變化
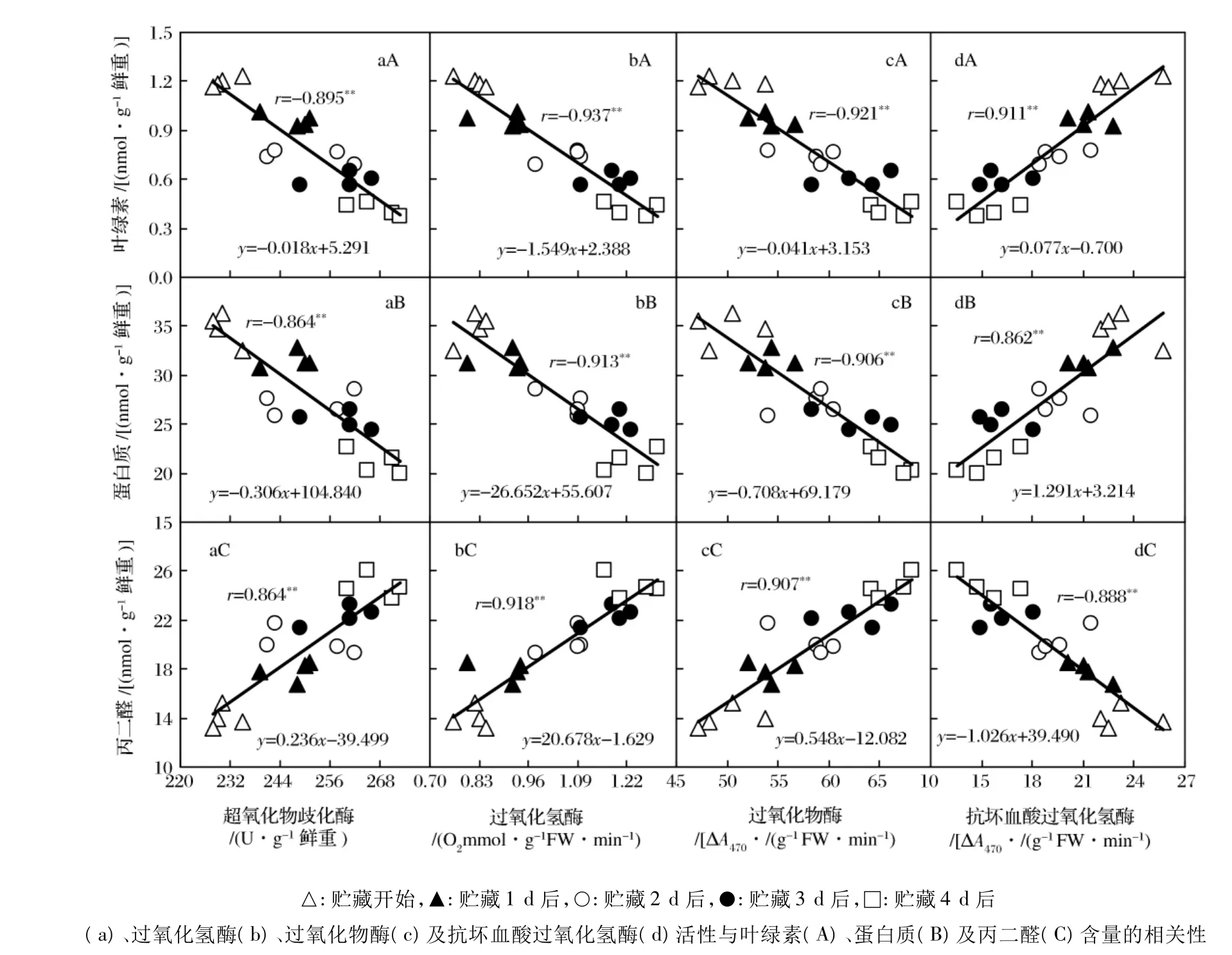
圖5 青花菜在20℃貯藏過程中花蕾的超氧化物歧化酶
在植物細胞內,SOD可歧化活性氧超氧陰離子為過氧化氫(H2O2)和H2O,CAT可分解活性氧H2O2為H2O和O2,這2種抗氧化酶對消除活性氧,減輕氧化脅迫,保護膜結構完整,延緩器官的衰老有重要作用。POD可酶促酚類物質、細胞色素C等與H2O2反應,消除H2O2的氧化毒害作用,但同時形成的其他自由基又會加劇膜脂質的過氧化,促進植物組織衰老,APX則是專一催化AsA與H2O2的反應。在植物組織遭遇逆境脅迫及衰老過程中,較低程度的活性氧積累形成的氧化脅迫,能誘導抗氧化酶活性升高,提高其自衛防御能力。青花菜花球在20℃過程中,花蕾的SOD、CAT、POD活性與衰老生理指標葉綠素及蛋白質含量線性負相關、與MDA含量線性正相關,APX活性與葉綠素及蛋白質含量線性正相關、與MDA含量線性負相關,性關性均在1%水平顯著;其中以CAT、POD與3個衰老生理指標的性關性較高,相關系數大于0.90(圖5)。這些結果表明,采后青花菜花球的SOD、CAT、POD活性升高和APX活性降低與衰老密切相關。
3 結論
采后青花菜花球在20℃貯藏過程中,花蕾的抗氧化物質 AsA和 β-Car含量逐漸減少,抗氧化酶SOD、CAT和POD活性逐漸升高,APX活性逐漸降低;這些抗氧化水平指標與衰老生理指標葉綠素、蛋白質和MDA含量的線性性關性均在1%水平顯著,其中以AsA與葉綠素、β-Car與蛋白質的性關性較高,相關系數大于為0.95,CAT和POD與3個衰老生理指標的性關性也較高,相關系數大于0.90。這些結果表明,采后青花菜花球的抗氧化水平變化與衰老密切相關,這一基礎理論信息可用于青花菜保鮮研究、技術開發及新品種選育等。
[1] Li J,Maezawa S,Nakano K.Correlations between antioxidative enzyme activities and antioxidative substrates and senescence in broccoli(Brassica oleracea L.)flower buds at different storage temperatures[J].Journal of the Japanese Society for Horticultural Science,2004,73(4):399 -403.
[2] Starzyńska A,Leja M,Mareczek A.Physiological changes in the antioxidant system of broccoli flower buds senescing during short-term storage,related to temperature and packaging[J].Plant Science,2003,165(6):1 387 -1 395.
[3] Barth M M,Zhuang H.Packaging design affects antioxidant vitamin retention and quality of broccoli florets during postharvest storage[J].Postharvest Biology and Technology,1996,9(2):141-150.
[4] 劉芬,張愛萍,劉東紅.真空預冷處理對青花菜貯藏期間生理活性的影[J].農業機械學報,2009,40(10):106-110.
[5] Gomes C,Silva P D,Chimbombi E,et al.Electron-beam irradiation of fresh broccoli heads(Brassica oleracea L.italica)[J].LWT-Food Science and Technology,2008,41(10):1 828-1 833.
[6] Zhang Z,Nakano K,Maezawa S.Comparison of the antioxidant enzymes of broccoli after cold or heat shock treatment at different storage temperatures[J].Postharvest Biology and Technology,2009,54(2):101-105.
[7] Costa M L,Civello P M,Chaves A R,et al.Effect of ethephon and 6-benzylaminopurine on chlorophyll degrading enzymes and a peroxidase-linked chlorophyll bleaching during post-harvest senescence of broccoli(Brassica oleracea L.)at 20℃[J].Postharvest Biology and Technology,2005,35(2):191-199.
[8] Mori T,Terai H,Yamauchi N,et al.Effects of postharvest ethanol vapor treatment on the ascorbate-glutathione cycle in broccoli florets[J].Postharvest Biology and Technology,2009,52(1):134-136.
[9] 葉陳亮,柯玉琴,陳偉.自由基清除劑對延緩青花菜花蕾衰老的效應[J].園藝學報,1996,23(3):259-263.
[10] Yuan G,Sun B,Yuan J,et al.Effect of 1-methylcyclopropene on shelf life,visual quality,antioxidant enzymes and health-promoting compounds in broccoli florets[J].Food Chemistry,2010,118(3):774-781.
[11] Arnon D I.Copper enzymes in isolated chloroplasts.Polyphenoloxidase in Beta vulgaris[J].Plant Physiology,1949,24(1):1-15.
[12] Lowry O H,Rosebrough N J,Farr A L,et al.Protein measurement with the folin phenol reaget[J].The Journal Biological Chemistry,1951,193:265-275.
[13] Hodges D M,Delong J M,Forney C F,et al.Improving the thiobarbituric acid reactive-substance assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds[J].Planta,1999,207(4):604-611.
[14] Roe J H,Mary B M,Oesterling M J,et al.The determination of diketo-L-gulonic acid,dehydro-L-ascorbic acid,and L-ascorbic acid in the same tissues by 2,4-dinitrophenyl hydrazine method[J].The Journal Biological Chemistry,1948,174:201-208.
[15] Beauchamp C,Fridovich I.Superoxide dismutase:improved assays and an assay applicable to acrylamide gels[J].Analytical Biochemistry,1971,44(1):276 -287.
[16] Li J,Matsui S.Effects of chilling on antioxidative enzymes in leaves of Cattleya and Cymbidium[J].Journal of the Japanese Society for Horticultural Science,2001,70(3):360-365.
[17] Kochba J,Lavee S,Spiegel-Roy P.Differences in peroxidase activity and isoenzymes in embryogenic and non-embryogenic‘Shamouti’orange ovular callus lines[J].Plant Cell Physiology,1977,18(2):463-467.
[18] Nakano Y,Asada K.Hydrogen peroxide is scavenged by ascobate-specific peroxidase in spinach chloroplast[J].Plant Cell Physiology,1981,22(5):867 -880.
[19] Eason J R,Ryan D,Page B,et al.Harvested broccoli(Brassica oleracea)responds to high carbon dioxide and low oxygen atmosphere by inducing stress-response genes[J].Postharvest Biology and Technology,2007,43(3):358-365.
[20] Lemoine M L,Civello P M,Chaves A R,et al.Effect of combined treatment with hot air and UV-C on senescence and quality parameters of minimally processed broccoli(Brassica oleracea L.var.Italica)[J].Postharvest Biology and Technology,2008,48(1):15(21.
[21] Nishikawa F,Kato M,Kamo T,et al.Enzymatic catabolism of ascorbate in florets of harvested broccoli during senescence[J].Journal of the Japanese Society for Horticultural Science,2001,70(6):709 -715.
Correlation Between Antioxidative Level and Senescence of Broccoli Florets During Postharvest Storage
Zhao Xi-heng,Li Jin-cai
(School of Agriculture and Bioengineering,Tianjin University,Tianjin 300072,China)
In this work,relationship between the senescence of broccoli(Brassica oleracea L.Var.italica)florets and their changes in antioxidative level was investigated.Postharvest broccoli florets were stored at 20℃,and its indicators of senescence(chlorophyll,protein and malondialdehyde(MDA)contents)and antioxidative level(ascorbic acid and β-carotene contents,superoxide dismutase(SOD),catalase(CAT)peroxidase(POD)and ascorbate peroxidase(APX)activities)of flower buds were analyzed in continuous 4 days during the storage.With increasing of the storage time,chlorophyll and protein contents decreased,MDA content increased,ascorbic acid and β-carotene contents decreased,SOD,CAT and POD activities increased and APX activity decreased.These antioxidative level indicators showed linear correlation to senescence indicators at P=0.01.These results showed that senescence of postharvest broccoli florets is closely correlated to antioxidative level.
postharvest,broccoli,antioxidative level,senescence,correlation
博士,講師(李進才為通訊作者)。
2010-10-07,回改日期:2010-11-24

