化學沉淀法回收化學鍍鎳廢水中鎳的研究
施銀燕, 徐玉福, 胡獻國
(合肥工業大學機械與汽車工程學院,安徽合肥 230009)
化學沉淀法回收化學鍍鎳廢水中鎳的研究
施銀燕, 徐玉福, 胡獻國
(合肥工業大學機械與汽車工程學院,安徽合肥 230009)
采用化學沉淀法從化學鍍鎳廢水中回收鎳,通過實驗優化了NaOH處理含鎳廢水的工藝參數,并對沉渣鎳鹽進行了處理。結果表明,化學沉淀法處理化學鍍鎳廢水的最佳工藝參數為:H2O230 mL/L,NaOH 15.67 g/L,絮凝劑聚丙烯酰胺4 g/L。用硫酸處理沉淀物后鎳的回收率可達97.25%。
化學鍍鎳;廢水;化學沉淀;鎳回收
0 前言
化學鍍鎳是以鎳鹽和次磷酸鹽等作用生成Ni-P非晶鍍層[1],具有不需外電源、鍍層均勻、硬度高、耐磨性能好、鍍覆部件不受尺寸形狀限制等優點,已經廣泛應用于機械零件的耐磨與減摩以及表面強化等領域。但目前大部分化學鍍鎳廢水以廢水的形式直接排放,造成資源浪費。同時鎳的毒性較大,含鎳廢水直接排放必將對環境和人體健康造成危害[2-3]。因此,研究化學鍍鎳廢水中Ni2+的回收利用方法已引起國內外廣泛關注。
目前化學鍍鎳廢水的處理方法有很多,如電解法、化學法、吸附法、生物法等。其中化學沉淀法簡便、實用,在含鎳廢水處理中應用最多,且隨著在線監測自動控制儀的使用,有逐漸增加的趨勢。由于化學鍍鎳廢水的化學成分復雜,配位劑的質量濃度高,難以直接用沉淀的方法徹底回收鎳。本文用破配位劑首先破壞化學鍍鎳廢水的配位能力,進而以NaOH為沉淀劑,最大程度地回收化學鍍鎳廢水中的鎳。
1 實驗
1.1 廢水成分分析
本實驗所用化學鍍鎳廢水取自某金屬材料公司,經過濾處理后,廢水的p H值為4.30,主要成分為:Ni2+17 367 mg/L,Fe2+3.0 mg/L,Cu2+15.2 mg/L,Zn2+13.7 mg/L。
由以上水質數據可知:該公司排放的含鎳廢水中,Ni2+的質量濃度很高,回收其中的Ni2+不僅可以減小對環境的污染,更有利于提高企業的經濟效益。
1.2 主要儀器及試劑
采用的主要儀器有721分光光度計,p H計。采用的主要試劑有NaOH(AR),質量分數為30%的H2O2。
1.3 實驗方法
(1)廢水成分分析
取經過過濾除雜的含鎳廢水,用原子吸收光譜分析法分析溶液中的離子組成。
(2)廢水處理
向廢水中加入一定量的 H2O2進行破配位處理,然后加入一定量的 NaOH攪拌0.5 h,靜置分層,測定上層清液中的Ni2+的質量濃度,計算Ni2+的去除率。
(3)聚丙烯酰胺(PAM)對沉淀速率的影響
取100 mL廢水,向廢水中加入30 mL/L的H2O2,常溫下再向廢水中加入15.67 g/L的固體NaOH和一定量的PAM,反應0.5 h后立即轉入到帶有刻度的試管中,記錄沉淀物沉淀至40 mL處時的時間,考察PAM的質量濃度對沉淀速率的影響。
(4)沉淀物的處理
取100 mL廢水,向廢水中加入30 mL/L的H2O2,常溫下再向廢水中加入15.67 g/L的固體NaOH和一定量的 PAM,反應0.5 h后過濾,將濾餅置于烘箱中于120℃下干燥2 h,稱重。然后將Ni(OH)2用0.1 mol/L的 H2SO4溶解,蒸發結晶,得到鎳的硫酸鹽,稱重,計算鎳的回收率。
2 結果與討論
2.1 H2O2對 Ni2+去除率的影響
向100 mL廢水中加入一定量的 H2O2,然后加入1.5 g NaOH,攪拌0.5 h,實驗結果,如圖1所示。
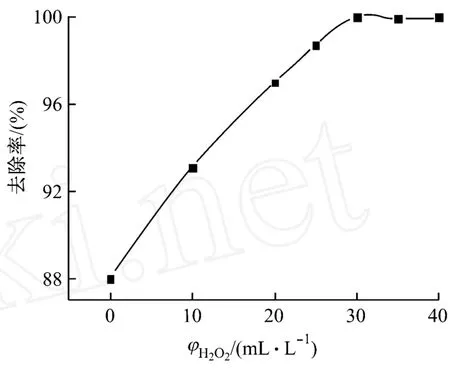
圖1 雙氧水對Ni2+去除率的影響
由圖1可知:在廢水中加入 H2O2,Ni2+的去除效率明顯提高,且隨著 H2O2的體積分數的增加,Ni2+去除率也增加。這是因為在化學鍍鎳廢水中鎳主要以配位物[Ni3(C6H5O7)2]的形式存在,只靠加堿很難使鎳沉淀完全。加入 H2O2可以破壞配位物[4],形成更多的游離Ni2+,使得Ni2+的去除率提高。從圖中還可以看出:當 H2O2的體積分數達到30 mL/L后,去除率不再增加。由此可見,H2O2最佳體積分數為30 mL/L。
2.2 NaOH對廢水pH值的影響
向廢水中加入30 mL/L的 H2O2,常溫下,緩慢添加不同質量濃度的NaOH,同時測定反應體系的p H值,實驗結果,如圖2所示。
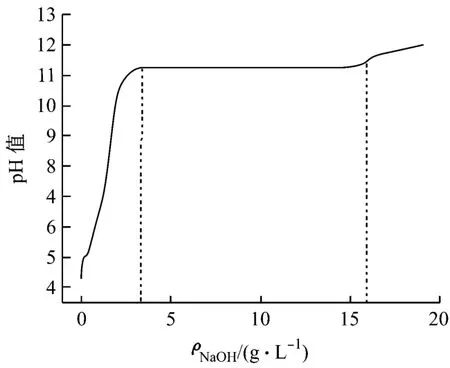
圖2 氫氧化鈉對廢水p H的影響
由圖2可知:當NaOH的質量濃度在3.79 g/L以內時,反應體系的p H值隨著NaOH的質量濃度的增加迅速增加,這是因為添加的NaOH與廢水中的 H+反應,導致p H值迅速上升;當NaOH的質量濃度達到3.79 g/L后,體系的p H值達到11.26,繼續添加NaOH,p H值不再變化,這是因為OH-與廢水中的Ni2+發生反應,生成Ni(OH)2,p H值不變化;而當NaOH的質量濃度達到15.67 g/L后,廢水的p H值開始上升,這時 Ni2+沉淀完全,繼續添加的OH-會導致廢水p H上升。因此,NaOH的最佳質量濃度為15.67 g/L,此時能確保廢水中Ni2+沉淀完全。
2.3 NaOH對 Ni2+去除率的影響
向廢水中加入30 mL/L的 H2O2,常溫下,緩慢添加不同質量濃度的NaOH,并攪拌0.5 h,測定反應體系Ni2+的去除率,實驗結果,如圖3所示。
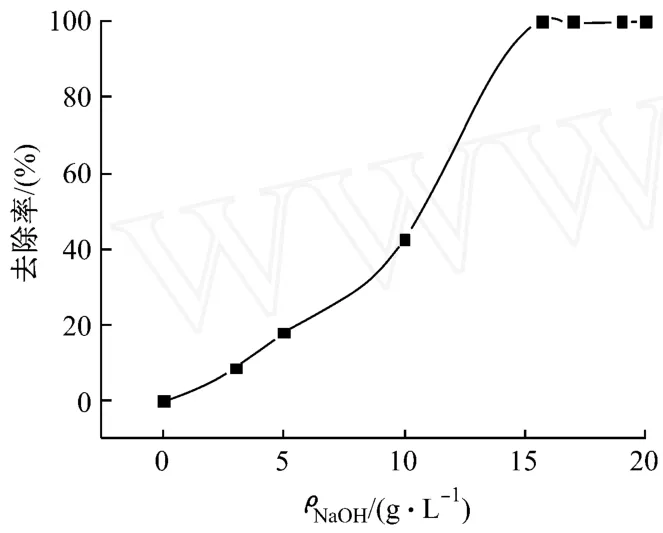
圖3 氫氧化鈉對Ni2+的去除率的影響
由圖3可知:Ni2+的去除率隨著NaOH的質量濃度的增加而上升,當其質量濃度達到15.67 g/L后,Ni2+的去除率不再變化,此時p H值也開始上升,如圖2所示。因此,為使 Ni2+的去除率最大,NaOH的質量濃度應達到15.67 g/L。
2.4 PAM對沉淀速率的影響
在處理過程中加入一定量的PAM,測定其對沉淀速率的影響,實驗結果,如圖4所示。
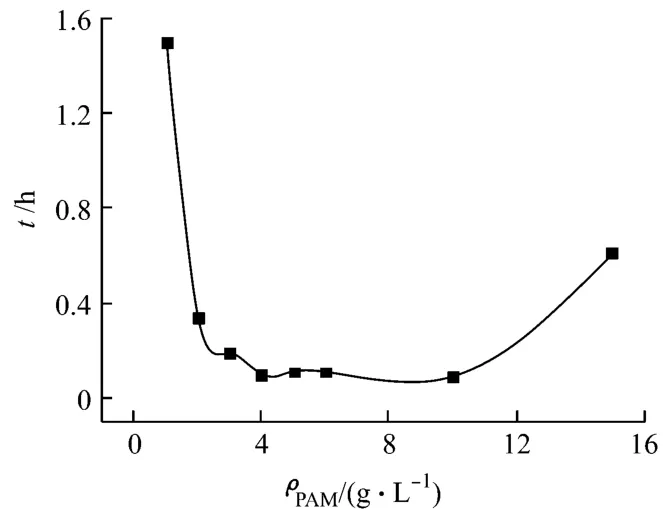
圖4 PAM對沉淀速率的影響
由于反應生成的Ni(OH)2粒度很小,沉淀速率很慢,在不加入絮凝劑的情況下沉淀至40 mL處需要3天左右。由圖4可知:加入PAM后,沉淀速率迅速提高。這是因為在PAM絮凝過程中,當懸浮微粒的質量濃度較低時,吸附在PAM表面上的懸浮微粒可能同時吸附在另一個微粒的表面上,通過“架橋”方式將兩個或更多的微粒連在一起,從而導致絮凝[5]。當 PAM的質量濃度達到4 g/L后,沉淀速率趨于平緩。盡管從圖中可以看出:當 PAM的質量濃度為10 g/L時,沉淀所需時間最少,但考慮到成本問題,PAM的質量濃度取4 g/L為宜。同時從圖中可以看出:當 PAM的質量濃度超過10 g/L后,沉淀時間變長,絮凝效果降低。這是因為PAM過量時,“架橋”作用所必需的粒子表面吸附活性點少了,“架橋”因而變得困難;同時,由于粒子間的相互排斥作用而出現分散穩定現象[6]。
2.5 鎳沉淀的處理
100 mL廢水處理后產生的Ni(OH)2沉淀為2.753 9 g,Ni2+的回收率為99.97%。硫酸溶解后,蒸發結晶,得到 NiSO4·7H2O的質量為7.629 7 g,Ni2+的回收率為97.28%。故廢水中鎳的總回收率=99.97%×97.28%=97.25%。因此使用該工藝可以很大程度地解決含鎳廢水的污染問題,同時可以回收大量的鎳,減少了資源浪費,也能給企業帶來一定的經濟效益。
3 結論
化學鍍鎳廢水中Ni2+的質量濃度高,廢液中含有大量的有機配位劑和添加劑,鎳主要以配位物的形式存在。化學沉淀法處理化學鍍鎳廢水的最佳工藝參數為:H2O230 mL/L,NaOH 15.67 g/L,PAM 4 g/L,在室溫下攪拌0.5 h。此時,Ni2+的去除率最佳。沉淀物用稀硫酸溶解回收鎳鹽,鎳的回收率可達到97.25%。
[1] 陳志勇,王輝.漂白粉氧化處理化學鍍鎳廢液的研究[J].電鍍與環保,2001,21(4):30-31.
[2] 王學鋒,術桂芬.重金屬污染研究新進展[J].環境科學與技術,2003,26(1):54-56.
[3] 盂祥和,胡國飛.重金屬廢水處理[M].北京:化學工業出版社,2000:5-12.
[4] 王曉波,薩如拉,楊潤昌,等.化學鍍鎳廢液處理新工藝及機理研究[J].湘潭大學自然科學學報,2004,26(1):78-80.
[5] 湛含輝,鐘樂,韋小利.聚丙烯酰胺絮凝機理及流體力化學因素的研究[J].選煤技術,2007(1):7-11.
[6] 劉軍.聚丙烯酰胺在工業廢水處理中的應用[J].廣西輕化工,2009(7):98-99.
A Study of Recovering Nickel from Electroless Nickel Plating Wastewater by Chemical Precipitation
SHI Yin-yan, XU Yu-fu, HU Xian-guo(School of Mechanical and Automotive Engineering,Hefei University of Technology,Hefei 230009,China)
Nickel was recovered from electroless nickel wastewater by means of chemical precipitation.The processing parameters for treatment of nickel containing wastewater with sodium hydroxide were optimized through experiment,and the nickel containing sludge produced by chemical precipitation process was also treated.The results show that the optimal process parameters from such treatment are:H2O230 mL/L,NaOH 15.67 g/L,PAM 4 g/L.The recovery rate of nickel after the sediment is treated with sulfuric acid can reach 97.25%.
electroless nickel plating;wastewater;chemical deposition;nickel recycle
X 781.1
A
1000-4742(2011)05-0044-03
2010-12-01

