酸性萃取劑負載Cr(III)的堿反萃取研究
范進軍,鄧聲華,謝芳浩,楊幼明
(江西理工大學材料與化學工程學院,江西 贛州 341000)
酸性萃取劑負載Cr(III)的堿反萃取研究
范進軍,鄧聲華,謝芳浩,楊幼明
(江西理工大學材料與化學工程學院,江西 贛州 341000)
針對酸性萃取劑負載的Cr(III)高酸難反萃、反萃不完全的問題,根據不同酸度條件下Cr(III)與OH-絡合形態的差別,進行了堿作為反萃取劑從負載Cr(III)的酸性萃取劑中回收鉻實驗研究.結果表明,堿反萃取P204負載有機相時的優化條件為0.5 mol/L氫氧化鈉、相比為1、常溫、反萃取反應為10 min,經四級逆流反萃取,反萃取率達到98.3%;堿反萃取P507負載有機相時的優化條件為2 mol/L氫氧化鈉、相比為1、常溫、反萃取反應為20 min,經四級逆流反萃取,反萃取率達到98.8%.
Cr(III);P204;P507;堿;反萃取
0 前言
含鉻資源的回收有溶劑萃取、化學沉淀、微生物以及電解等方法,其中溶劑萃取法具有操作簡單、易連續操作、分離效率高等優點,廣泛地應用于工業生產中.目前,溶劑萃取法回收Cr(III)的研究較多,主要集中在酸性萃取劑D2EHPA(P204)[1-3],Cyanex272[4],Cynaex302[5],H2MEHP[6]萃取 Cr(III)工藝研究,D2EHPA 的萃取 Cr(III)機理[7]及陳化特性[8]研究,Cr(III)在萃取劑中的縮合反應[9-12]研究,研究的重點集中在鉻的萃取分離,未對負載鉻的有機相進行系統的反萃取行為研究;研究過程中采用的反萃取劑均為酸,但酸反萃Cr(III)不完全,尤其是負載有機相存放時間越長越難反萃.萃取法回收含鎳電鍍污泥的生產實踐表明,用酸再生負載鉻的有機相困難或再生不完全,造成有機相萃取能力下降甚至失效,即使采用高酸反萃,失效的有機相亦不能再生,給企業造成極大的經濟損失.
本文根據鉻在不同酸性環境中與OH-絡合形態的差別,以常用的酸性萃取劑P204和P507為研究對象,進行了堿反萃取負載Cr(III)有機相實驗研究.
1 實 驗
1.1 實驗原理
酸性萃取劑P204,P507是一元弱酸HR,萃取金屬元素離子時其中含有的H+基團先被皂化基團替換,皂化基團再被金屬元素離子替換,金屬元素離子占有原先的H+基團位置.Cr(III)易萃,但難反萃,低酸很難達到反萃取效果,即使高酸也難反萃完全.
Cr(III)在溶液pH<4時才存在,往Cr(III)溶液中加入堿,首先生成灰綠色的Cr(OH)3沉淀,當堿過量時Cr(OH)3沉淀溶解生成亮綠色的[Cr(OH)4]-:
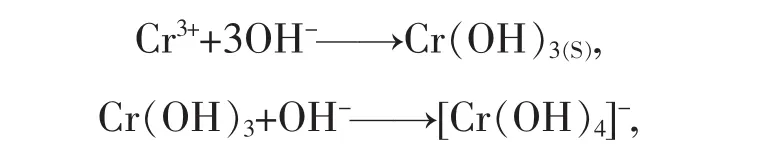
Cr(III)在含有機膦酸的有機溶劑存在縮合反應[9-10],Cr(III)與酸性萃取劑形成Cr(OH)[OP(OR)2O]2萃合物,則用堿反萃取可表示為
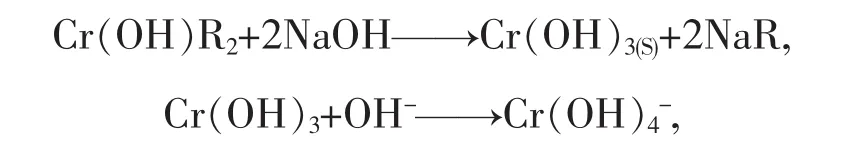
其中,R代表酸性萃取劑中去除羥基上的H后所有基團.
1.2 試劑
50%硫酸鉻[Cr2(SO4)3,分析純],P204(工業純),P507(工業純),正辛醇(分析純),璜化煤油(工業純),氫氧化鈉(分析純).
1.3 主要儀器
KS型康氏振蕩器,江蘇中大儀器廠生產.
SHA-C數顯水浴恒溫振蕩器,金壇市白塔金昌實驗儀器廠生產.
DSG-Ⅲ型電感耦合等離子體發射光譜儀,上海泰倫儀器股份有限公司生產.
分液漏斗.
1.4 反萃取系統裝置
反萃取系統裝置如圖1.
圖1 反萃取系統裝置圖
1.5 實驗方法
有機相負載鉻:有機相組成為10%萃取劑+10%正辛醇+80%璜化煤油,皂化劑為10 mol/L NaOH,將硫酸鉻溶液與皂化后的有機相按相比(O/A)要求加入分液漏斗中,振蕩、靜置分相,測定水相鉻的濃度,負載鉻的有機相濃度由物料平衡計算得到.
負載有機相反萃:取負載鉻的有機相,在分液漏斗中加入NaOH溶液,振蕩,靜置分相,測定反萃液中鉻的濃度,計算反萃取率.
萃取分離后的萃余液及反萃取后的反萃液,采用電感耦合等離子體發射光譜儀(ICP-AES)來測定.
2 結果與討論
2.1 堿濃度的選擇
常溫下,將負載 1.53 g/L Cr(III)的 P204、負載1.08 g/L Cr(III)的 P507 分別用 0.5、1、2、4 mol/L 的氫氧化鈉按相比(O/A)1∶1進行反萃,振蕩時間10 min,靜止分層后,取反萃液化驗分析,結果如圖2所示.
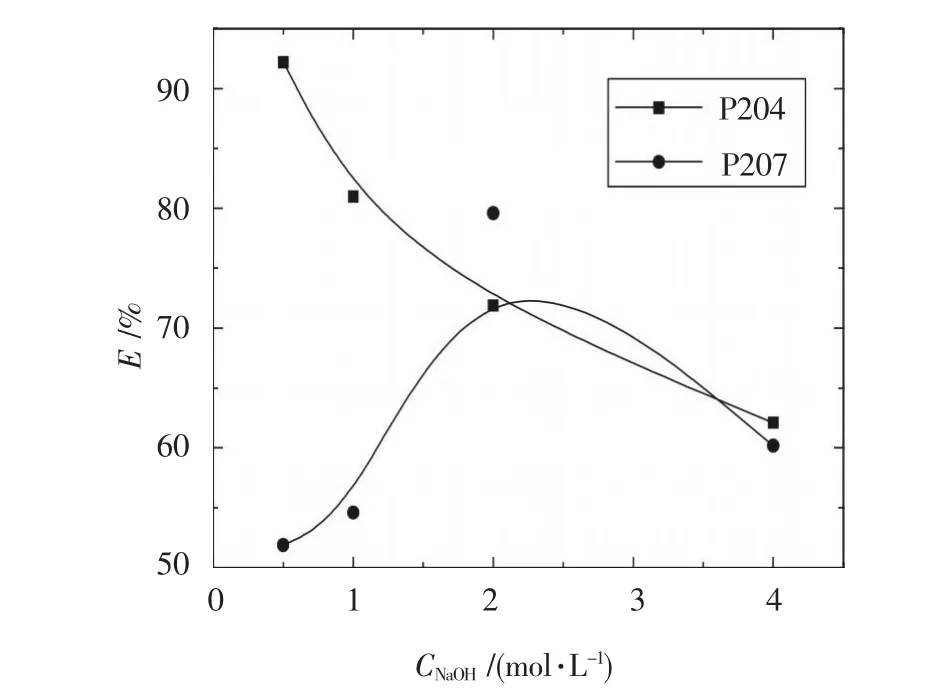
圖2 堿濃度與反萃取率E的關系
實驗表明:①氫氧化鈉的濃度高達4 mol/L時,鉻的反萃取率反而較低,這是因為堿反萃取過程也即形成有機鈉皂的過程,堿過量造成有機相深度皂化,過程中易形成油包水乳狀液,使部分鉻絡陰離子被“包裹”于有機相中;②對于P204,反萃取率隨氫氧化鈉濃度的增加并沒有增大,反而下降,當氫氧化鈉濃度為0.5 mol/L時,一級反萃取率大于90%,且反萃后的有機相清澈透明.但并不表明堿的濃度越低越好,實驗中發現,當氫氧化鈉濃度為0.2 mol/L時,反萃取時發生乳化現象,這主要是因為鈉皂使有機相處于一種易于深入水相并易于與金屬離子反應狀態,皂具有比酸強得多的表面活性,使兩相的分散能下降,當堿反萃進行時,反萃下來的鉻離子與氫氧根先形成沉淀,當堿濃度低時沉淀溶解緩慢,所形成的固體顆粒便起到了乳化劑的作用;另外,堿濃度低也使有機相與水相比重差減小,不利于油水分相.因此,選擇0.5 mol/L左右的氫氧化鈉溶液作為負載鉻的P204的反萃取劑;③對于P507,隨堿濃度增大,反萃取率先升后降呈現峰值,在2 mol/L時達到最高.說明在低堿度條件下,P507負載的鉻較P204負載的鉻相對難反萃,這與采用酸反萃時P507負載的鉻較P204負載的鉻相對易反萃的結論剛好相反.因此,選用2 mol/L左右的氫氧化鈉作為負載鉻的P507的反萃取劑.
2.2 反萃取相比的確定
實驗分別考查了相比對負載1.27 g/L鉻的P204與0.5 mol/L的NaOH溶液的反萃取和負載1.13 g/L鉻的P507與2 mol/L的NaOH溶液的反萃取率的影響.負載有機相與NaOH溶液按一定的相比(O/A)加入分液漏斗中,室溫,振蕩10 min,靜止分層,取樣分析.結果如表1所示.
由表1可看出:①P204與P507的反萃取現象與效果相差較大,P507為萃取劑時在實驗條件下的反萃取未出現乳化現象;②雖然P507的反萃取劑濃度高,但其反萃取率還是略低于P204為萃取劑時的反萃取率,再一次說明P507負載的鉻相對難反萃;③當萃取劑為P204時,相比(O/A)減小,鉻的反萃取率增加,但增加幅度不大;相比為3∶1和 2∶1時,發生乳化.從實驗結果以及節約成本考慮,反萃取相比O/A為1∶1較適宜,其一級反萃取率超過90%;④當萃取劑為P507時,隨相比(O/A)減小,反萃取率先下降后上升,在O/A為1∶1時出現低谷,反萃取率只有83.2%;相比(O/A)越大,即相比 O/A 由 1∶1 到 3∶1 時,反萃取率越高,但相比太大時反萃液中形成大量的沉淀物,發生乳化不利于分相以及連續操作;相比越小,即相比O/A由1∶1到1∶3時,反萃率相反地增大,但反萃率提高的不明顯;盡管相比為1∶1時反萃取率最低,但分相快,因此選擇相比O/A為1∶1,此時,一級反萃取率也超過80%.
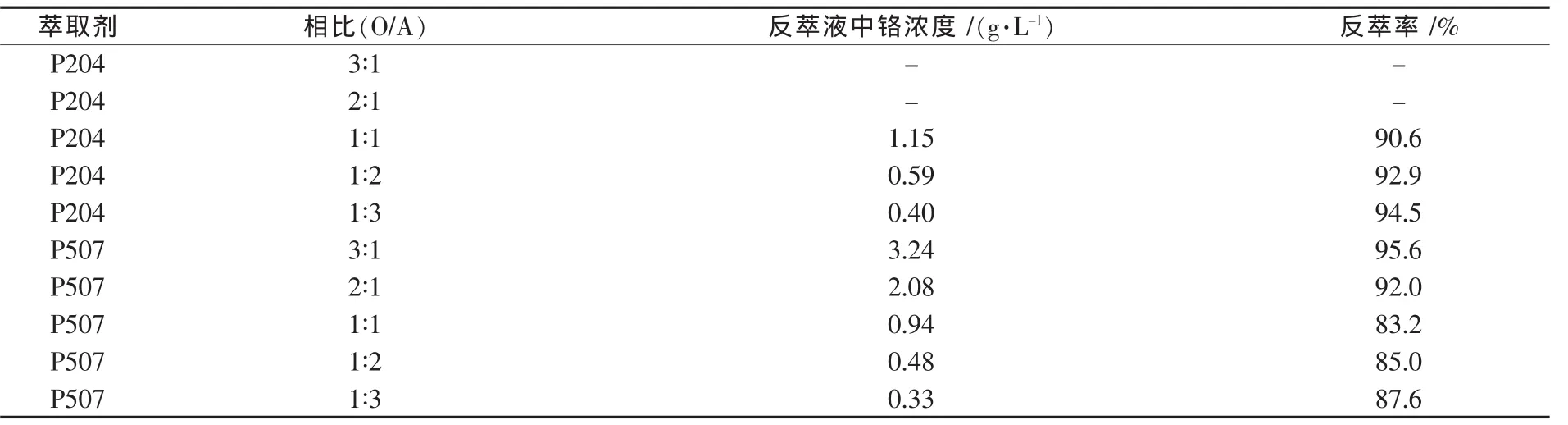
表1 相比與反萃取率的關系
2.3 溫度對反萃取的影響
不同溫度下,負載鉻1.52 g/L的P204和0.5 mol/L的氫氧化鈉溶液,負載鉻1.19 g/L的P507和2 mol/L的氫氧化鈉溶液,分別按相比(O/A)1∶1加入分液漏斗,振蕩10 min,靜止分層后,取反萃液化驗分析,結果如表2所示.
結果顯示:①溫度對反萃取反應產生一定的影響,隨著溫度的升高,反萃取率下降,說明堿反萃取過程可能放熱,低溫有利于反萃取反應的進行,綜合考慮,萃取劑的再生以及負載物鉻的回收安排在常溫下進行;②相同或相近溫度條件下,P507為萃取劑時的反萃取率要低于P204為萃取劑時的反萃取率.
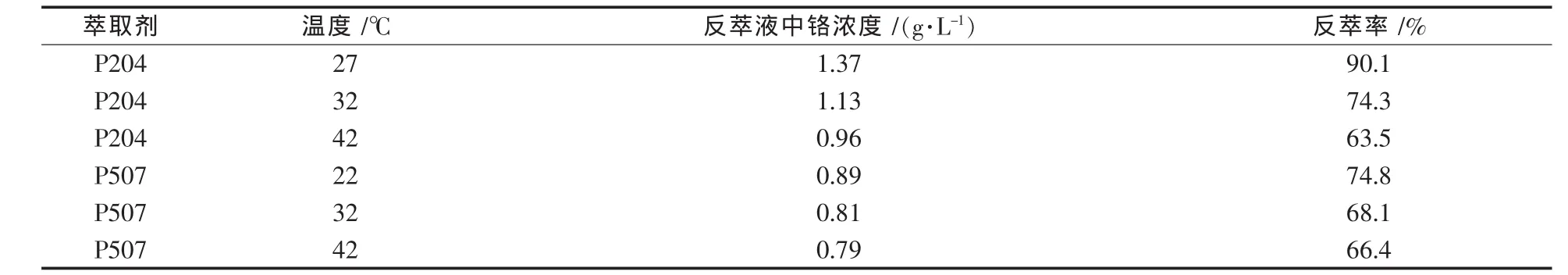
表2 溫度與反萃取率的關系
2.4 反萃取時間的影響
室溫下,0.5 mol/L的氫氧化鈉溶液與負載鉻1.28 g/L的P204,2 mol/L的氫氧化鈉溶液與負載鉻1.18 g/L 的 P507,分別按相比(O/A)1∶1 加入到分液漏斗中,振蕩一定時間后,靜止分層,取反萃液化驗分析,結果如圖3所示.
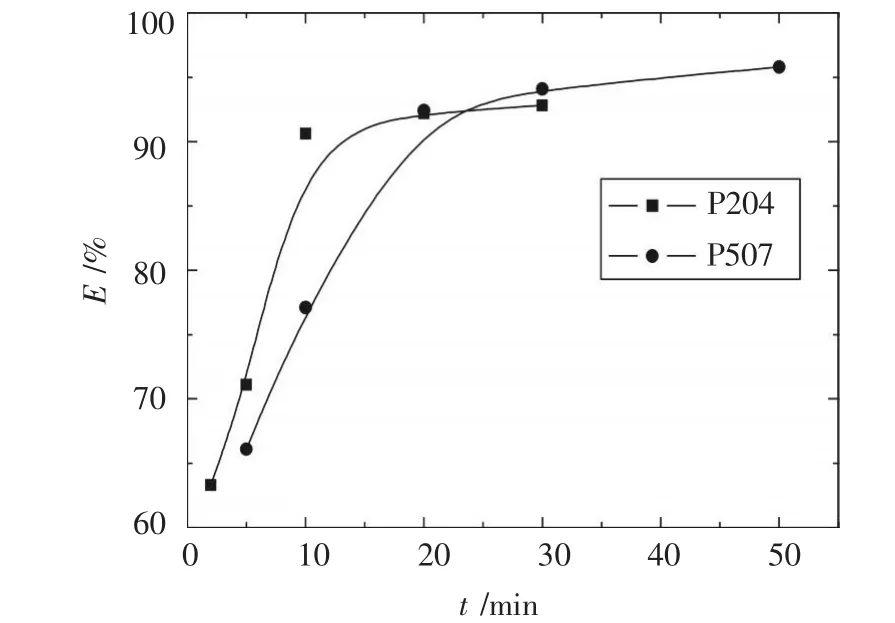
圖3 時間與反萃取率E的關系
圖3顯示,隨時間增加,反萃取率增大;當反萃取反應進行10 min以后,P204為萃取劑時的反萃率變化很小,說明堿反萃取負載鉻的P204進行10 min即達到平衡,0.5 mol/L的氫氧化鈉一級反萃取率可以達到90%左右.而萃取劑為P507時,一級反萃取率達到90%以上的反萃取反應時間則需20 min以上,該結果也說明表2中P507為萃取劑時的反萃取率相對低的原因是反萃取時間不夠造成的.
2.5 堿反萃取串級實驗
分別對負載Cr(III)的P204和P507進行了堿反實驗.負載鉻1.39 g/L的P204,氫氧化鈉溶液濃度為0.5 mol/L,相比 O/A=1∶1,振蕩 10 min,四級逆流反萃取;負載鉻1.19 g/L的P507,氫氧化鈉溶液濃度為2 mol/L,相比 O/A=1∶1,振蕩 20 min,四級逆流反萃取;結果如表3所示.由表3可見,經四級逆流反萃取后,鉻的反萃取率均可達到98%以上.
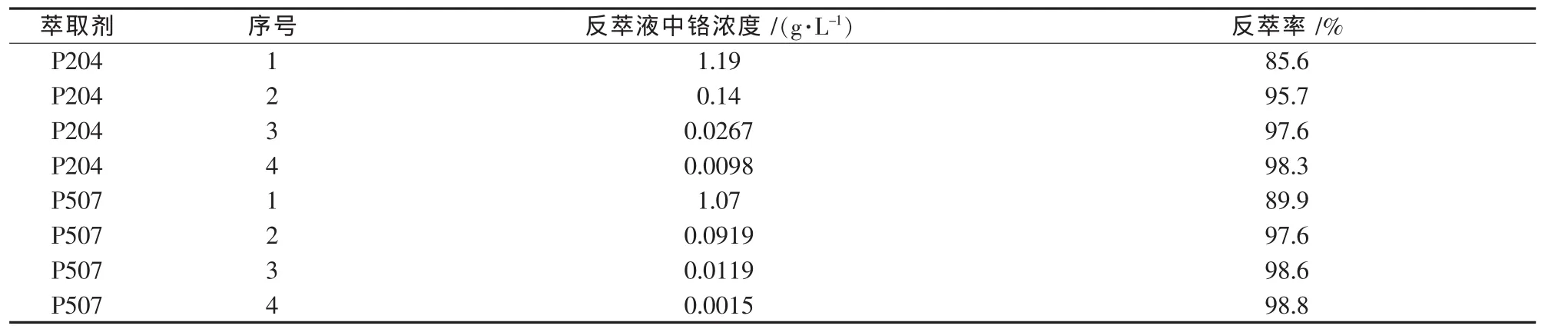
表3 四級逆流反萃取Cr(III)實驗結果
3 結 論
以氫氧化鈉堿溶液為反萃取劑,對負載三價鉻的P204和P507進行反萃取條件實驗,獲得了優化實驗條件.
(1)堿反萃取P204負載鉻有機相條件:0.5 mol/L氫氧化鈉,相比O/A=1∶1,常溫,反萃取反應時間為10 min,四級逆流反萃取,反萃取率達到98.3%.
(2)堿反萃取P507負載鉻有機相條件:2 mol/L氫氧化鈉,相比O/A=1∶1,常溫,反萃取反應時間為20 min,四級逆流反萃取,反萃取率達到98.8%.
[1]霍小平,秦 煒,孫曉瑋,等.D2EHPA萃取回收Cr(III)的研究 [J].高校化學工程學報,2007,21(5):849-852.
[2]祝萬鵬,楊志華.溶劑萃取法回收電鍍污泥中得有價金屬 [J].給水排水,1995,21(2):16-18.
[3]祝萬鵬,葉波清.溶劑萃取法提取電鍍污泥氨浸出渣中的金屬資源[J].環境科學,1998,19(3):35-38.
[4]Pandey B D,Cote G,Bauer D.Extraction of Chromium(III)from Spent Tanning Baths[J].Hydrometallurgy,1996,40(3):343-357.
[5]Yu K,Peter S,Xue L Z.Extraction of Zinc and Chromium(III)and Its Application to Treatment of Alloy Electroplating Wastewater[J].Sep.Sci.Technol.,2003,38(2):405-425.
[6]Khwajadbbp A R,Singh R,Tandon S N.Mono(2-ethylhexyl)Phosphoric Acid as an Extractant for Cr(III)and Its Application to Industrial Waste[J].Sep.Sci.Technol.,2000,35(3):447-455.
[7]Senthilnathan J,Mohan S,Palanivelu K.Recovery of Chromium from Electroplating Wastewater Using Di 2-(ethylhexyl)phosphoric Acid[J].Sep.Sci.Technol.,2005,40(10):2125-2137.
[8]秦 煒,薛亞卓,霍小平,等.二(2-乙基已基)膦酸萃取Cr(III)的陳化特性[J].化學學報,2009,60(9):2221-2225.
[9]Nannelli P,Gillman H D,Block B P.Inorganic Coordination Polymers(XI):A New Family of Chromium(III)Bis(phosphinate)polymers,[Cr(OH)(OPRRO)2]x[J].J.Polym.Sci.Pol.Chem.,1971,9(10):3027-3038.
[10]Finholt J E,Thompson M E,Connick R E.Hydrolytic Polymerization of Chromium(III)(II):A Trimeric Species[J].Inorg.Chem.,1981,20(12):4151-4155.
[11]Lanagan M D,Ibana D C.The Solvent Extraction and Stripping of Chromium with Cyanex 272[J].Miner.Eng.,2003,16(3):237-245.
[12]大連理工大學無機化學教研室.無機化學(第4版)[M].北京:高等教育出版社,2001:531-533.
Experiment on Back-extraction of Cr(Ⅲ)in Acidic Extractant by Alkali
FAN Jin-jun,DENG Sheng-hua,XIE Fang-hao,YANG You-ming
(Faculty of Materials and Chemical Engineering,Jiangxi University of Science and Technology,Ganzhou 341000,China)
Back-extraction of chromium from acidic extractant is difficult,whose recovery is generally low.This paper studies the back-extraction of Cr(III)in acidic extractant by alkali based on the different complexing speciation of Cr(III)and OH-in various acidic solution.The optimized conditions for P204 and P507 extractants are as follows:O/A is 1,sodium hydroxide concentrations are 0.5 mol/L and 2 mol/L,separately;back-extraction times are 10 and 20 min,and the recoveries reach 98.3%and 98.8%after 4 steps back-extraction at room temperature.
Cr(III);P204;P507;alkali;back-extraction
TQ028.3
A
1674-9669(2011)04-0097-04
2011-01-26
范進軍(1985- ),男,碩士研究生,主要從事有色金屬濕法冶金研究,E-mail:fan3652@yahoo.com.cn.

