磁性微球固定化Alcalase酶與水解酪蛋白動力學模型的建立
徐英操,馮志彪
(東北農業大學理學院應用化學系,哈爾濱 150030)
磁性微球固定化Alcalase酶與水解酪蛋白動力學模型的建立
徐英操,馮志彪
(東北農業大學理學院應用化學系,哈爾濱 150030)
采用化學沉積過程,以羥基Fe3O4為核、SiO2為殼進行核殼包被,再以氨基硅烷化試劑和戊二醛為交連試劑實現Alcalase酶的固定化,電鏡及紅外譜圖分析作為表征手段,并將其用于酪蛋白的水解過程,通過雙曲線回歸模型建立水解全過程動力學模型。
固定化Alcalase;磁性高分子;酪蛋白水解
0 引言
納米磁性高分子微球具有超順磁性,作為酶的結合載體,使得固定化酶在外加磁場作用下從水解反應體系中實現有效的磁性聚集、分離和回收再利用。利用固定化蛋白酶水解蛋白制備生物活性肽,能克服游離酶穩定性差、分離回收困難等缺點,因此磁性高分子微球在酶的固定化上得到廣泛的應用研究[1-4]。
牛奶中蛋白質的質量分數為3.0%~3.5%,其中約80%為酪蛋白。酪蛋白含有全部蛋白質氨基酸,其中人體必需氨基酸含量豐富,有很高的營養價值,因此在食品工業和其它工業部門都得到了廣泛的應用。但是酪蛋白在被消化吸收時在胃中易形成大凝塊,影響人體(特別是嬰、幼兒)對它的吸收利用。通過酶解酪蛋白的方法制備生物活性肽,既可以促進蛋白的消化吸收,又可以改善酪蛋白的生物活性。
1 材料與方法
1.1 試劑與儀器
Alcalase(2.4 L,Novozymes),N-(β-氨乙基)-γ-氨丙基三甲氧基硅烷(WD51),酪氨酸,酪蛋白,福林-酚試劑(自配),水合茚三酮,可見紫外分光光度計(SP-755PC),恒溫振蕩儀,冷凍干燥機(FDU-1100),傅立葉紅外,電鏡等,其余試劑均為市售分析純。
1.2 酶的固定化及酶活力測定
酶的固定化原理如圖1所示。
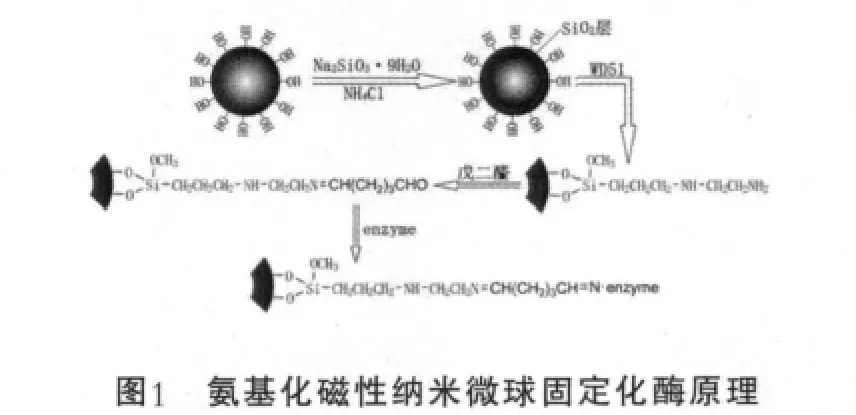
NH4Fe(SO4)2·12H2O和(NH4)2Fe(SO4)2·6H2O按照1.7∶1(Fe3+和Fe2+摩爾比)溶解在重蒸餾水中,加入PEG4000,使其濃度為10%。50℃恒溫振蕩20 min,再逐滴滴加濃度為3 mo1/L的NaOH溶液至pH值為5.5~5.7(Fe3O4等電點),然后50℃恒溫振蕩20 min,繼續滴加濃度為3 mol/L的NaOH溶液至pH值為9.8,繼續50℃恒溫振蕩5 h。即得到黑色水基Fe3O4磁流體。磁體吸附,洗滌后于4℃冰箱中保存。
10 g Na2SiO3·9H2O溶于100 mL重蒸餾水中,滴加Fe3O4,加入氨基化硅烷化試劑,再滴加質量分數為10%的(NH4)2SO4,50℃恒溫振蕩5 h,磁鐵吸附,洗滌后于4℃冰箱中保存。
向氨基化的Fe3O4(Core)/SiO2(Shell)載體溶液中加戊二醛,使其質量分數為10%,50℃反應4 h,磁鐵吸附,洗滌后冷凍干燥。取此載體加到稀釋好的酶液中于4℃冰箱中反應一定時間完成酶的固定化。
酶活力測定采用福林-酚比色法[5],此固定化酶的酶活力回收率=55%。
1.3 固定化酶水解酪蛋白
固定化酶經磁性分離并冷凍干燥后,根據比酶活稱取一定酶活單位的此固定化酶,加入酪蛋白液中,超聲10 s后,在恒溫震蕩儀中(130 r/min)進行固定化酶水解酪蛋白。
1.4 蛋白質質量分數測定
測定方法folin-酚/Lowry法[6-7]。
1.5 游離氨基數測定
采用水合茚三酮法[8]。
1.6 水解度計算及速率方程的定義[9]
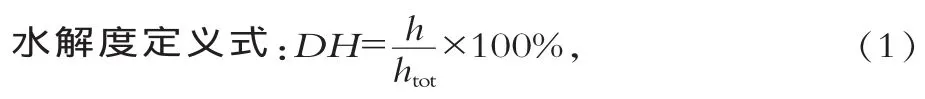
式中:h為被裂解的肽鍵數;htot為原蛋白質中的總肽鍵數,這里的h和htot單位均為mmol/g表示。htot(酪蛋白)=8.2 mmol/g。
每一個肽鍵的斷裂均會產生一個游離氨基,因此實驗采用下面公式計算水解度:

式中:At為水解t小時后水解液中增加的游離氨基數,At單位為mmol/g。
實驗中定義水解速率公式為

2 結果與討論
2.1 透射電鏡
圖2(a)是Fe3O4透射電鏡照片,可以看出制備的Fe3O4粒徑較均勻,直徑在20 nm左右,具有順磁性。圖2(b)是固定化酶之后的透射電鏡照片,可以看出絮狀的酶分子結合在載體上。

2.2 紅外譜圖分析
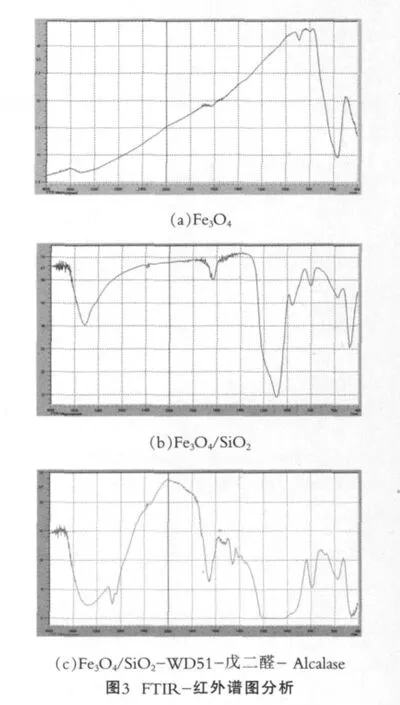
在紅外燈下用溴化鉀壓片分別對不同固體樣品進行紅外分析,結果如圖3所示。
由圖3(a)可以看出,567.499cm-1是Fe3O4的特征吸收峰;由圖3(b)可知,3436.43為Si-OH的伸縮振動吸收峰,1090.48出現的寬峰正是Si-O-Si的反對稱伸縮特征吸收峰,958.595出現的包峰是Fe-O-Si的特征吸收峰,同時可以看到Fe3O4的特征吸收峰由原來的567.499移動到471.999,說明Fe3O4與SiO2之間不僅僅是簡單的包被關系,而是形成了Fe-O-Si鍵;圖3(c)中,在2927.31的CH2的對稱伸縮振動吸收峰,3 400左右峰形增強變寬即N-H和O-H特征峰的重合出現,及在1 650~1 700出現的C=O伸縮振動吸收峰,都屬于酶的特征吸收峰,說明酶與載體的結合。
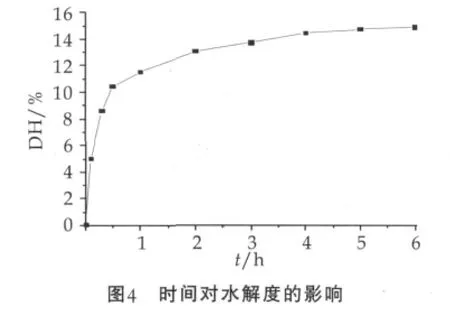
2.3 時間對水解度的影響
圖4為時間對水解度的影響。由圖4可以看出,水解度先是隨著水解時間而明顯增加,當1 h后,水解度逐漸趨于平緩。分析納米載體固定化酶水解蛋白質主要是受三方面影響:表面吸附現象;酶催化水解與酶催化合成的可逆性;酶的失活。一方面納米微球增加了吸附表面積,另一方面短時間酶活的保持,使得最初短時間內水解度增加明顯,可以看成一級動力學,而后隨酶活的降低及水解可逆平衡的影響水解度逐漸呈現平緩趨勢,不屬于一級動力學。
2.4 表觀動力學方程的建立
圖4表明水解度與反應時間符合雙曲線關系為

用1/DH對1/t做圖,結果為線性關系如圖5所示,其線性方程為
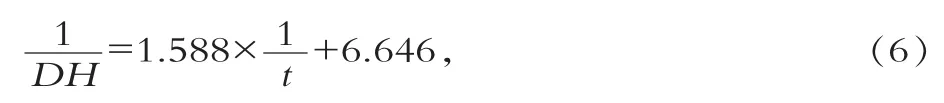
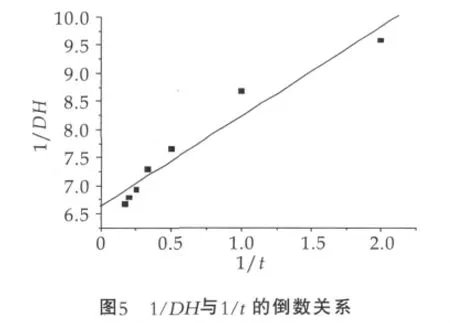

式(10)即為硅烷化磁性納米微球固定化Alcalase酶水解酪蛋白的表觀動力學方程。
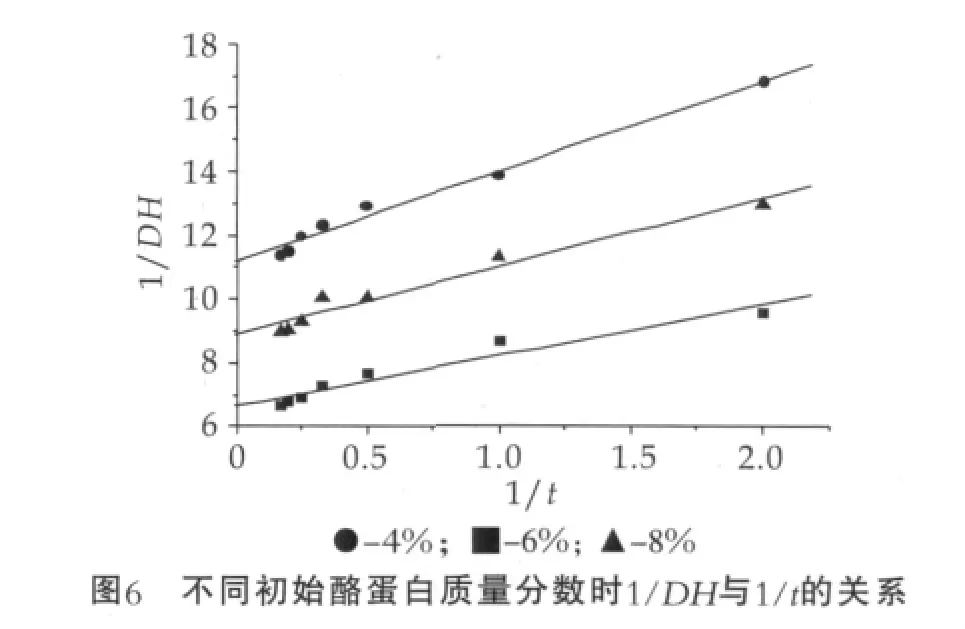
并且采用不同初始底物酪蛋白濃度實驗,如圖6所示,均符合雙曲線規律,并且斜率近乎相等。
3 結論
實驗中利用具有柔性手臂的硅烷化納米Fe3O4(核)/SiO2(殼)磁性高分子載體,以其優越的比表面積及在磁場中可分離的順磁性,對Alcalase酶實現固定化,并對酪蛋白進行固定化酶水解。
研究結果表明:磁性納米微球直徑20 nm左右較均勻,具有順磁性,核殼包被的硅烷試劑與Fe3O4之間形成了Fe-O-Si鍵,通過戊二醛完成了對Alcalase酶的固定化;用此固定化酶對酪蛋白進行水解,在優化了水解條件基礎上主要討論了其水解全過程的表觀動力學模型。
[1]TORU M,NORIYUKI W,YUTAKA N,et al.Activity of an Enzyme Immo Bilized on Superpara Magneticparticles in a Rotational Magnetic Field[J].Biochemical and Biophysical Research Communications,2010,393(4):779-782.
[2]李鴻玉,厲重先,李祖明.磁性殼聚糖微球固定化果膠酶的研究[J].食品科學,2008(9):399-403.
[3]XIE W,MA N.Enzymatic Transesterification of Soybean oil by Using Immobilized Lipase on Mag netic Nano-Particles[J].Biomass and Bioenergy,2010,34(6):890-896.
[4]楊可可,楊婉身.硅烷化氨基磁性微球的制備及其固定化酶應用研究[J].四川農業大學學報,2008,26(2):135-140.
[5]YYSWDB0090.蛋白質含量測定福林酚法.中國分析網.http://www. analysis.org.cn.
[6]汪家政,范明.蛋白質技術手冊[M].北京:科學出版社,2000:47-51.
[7]蛋白酶活力測定法.中華人民共和國專業標準.SB/T 10317~1999[S].
[8]張金桐,葉非.實驗化學[M].北京:中國農業出版社,2010:206-208.
[9]趙新淮,馮志彪.大豆蛋白水解物水解度測定的研究[J].東北農業大學學報,1995.26(2):178-181.
Research on immobilization of Alcalase on magnetic microsphere and establishment of casein hydrolysis kinetics model
XU Ying-cao,FENG Zhi-bao
(Department of Chemistry,College of Science,Northeast Agriculture University,Harbin 150030,China)
The objective of this paper was to study on immobilization of Alcalase on Fe3O4/SiO2(core/shell)magnetic nanoparticles,aminosilane reagent and glutaraldehyde as the cross-linking agent,electron microscopy and FTIR spectra as the characterization methods.The kinetics model of casein hydrolyzed by immobilized Alcalase was also studied,and established by hyperbolic kinetic equation.
immobilized Alcalase;magnetic microsphere;casein hydrolysate
Q816
A
1001-2230(2012)05-0024-03
2011-11-10
黑龍江省自然科學基金(D200804)。
徐英操(1977-),男,講師,研究方向為食品科學與環境工程。
馮志彪

