基于微電極技術的反硝化濾池生物膜特性分析
宋慧敏,周小紅,張永明,施漢昌* (.清華大學環境學院,北京 00084;.上海師范大學生命與環境科學學院,上海 0035)
由氮磷等營養元素排放引起的水體富營養化問題對環境造成了嚴重的負面影響.因此,現有城市污水處理廠的脫氮能力需要大幅提升以滿足日益嚴格的總氮排放標準.反硝化濾池通過在填料或多孔介質上附著反硝化細菌等微生物聚集體獲得穩定的反硝化效果,已經在國內城市污水處理廠二級生物處理以及深度處理中得到了應用[1].在工程運行中,反硝化濾池不能保證嚴格的缺氧條件,高溶解氧濃度成為阻礙反硝化作用順利進行的限制性因素并會消耗反硝化所需的碳源,然而目前尚未有該方面的定量考察和研究.
微電極技術自20世紀60年代以來逐漸在環境工程領域中得到應用,電極尖端直徑可以小至1μm,可以在對檢測對象損害不大的前提下獲得微環境中特征參數的濃度分布曲線,而特征參數的濃度分布情況又與微生物的種類、活性、分布以及外環境影響因素緊密相關,從而為探究微生物聚集體的功能提供了新的視角.目前用于生物膜內部微環境特性測試的常用微電極包括氧、銨鹽(NH4+)、硝酸鹽(NO3-)和亞硝酸鹽(NO2-)、pH值以及氧化還原電位(ORP)等[2].通過微環境在線原位測試分析,微電極技術在研究生物膜生長條件、外部水力條件、基質負荷以及生物膜結構對生物膜內外微觀傳質的影響及生物膜反應動力學參數的估值計算中發揮了重要作用[3-5].
本研究以廈門市筼筜污水處理廠反硝化生物濾池中的火山燒結石濾料為研究對象,制備尖端直徑在 30μm以內的氧及硝酸鹽微電極,以此為測試工具,對反硝化濾池中生物膜內部 O2、NO3-微環境分布進行測試,通過建立擴散-反應方程,獲得反硝化濾池生物膜微環境耗氧及反硝化活性的分布特征,為解析反硝化濾池中溶解氧對反硝化作用的影響提供研究手段及基礎數據.
1 筼筜污水處理廠工藝分析
筼筜污水處理廠2006年投入運行,采用法國得利滿的S3D+BIOFOR工藝技術,設計規模30萬t/d,實際運行規模25萬t/d,夏天雨季峰值可超過設計規模.來水大部分都是生活污水,雨季有雨水,不含工業廢水.進水 COD:200~300mg/L, TN:30~40mg/L,TP:6mg/L左右.污水通過S3D沉淀池進行一級強化處理,再進入BIOFOR生物濾池,即反硝化濾池(DN池)與硝化濾池(CN池)串聯工藝進行二級處理,工藝流程如圖1.其中,快速混合池溶解氧濃度約 5.0~5.3mg/L,混合池出水經過跌落后進入DN池,采用下部進水,上部溢流出水.DN池進水溶解氧濃度達到6.2~6.4mg/L,池內溶解氧接近 0.毫無疑問,混合池投加的碳源部分用于消氧,而且,高濃度的溶解氧也會對反硝化過程造成影響.此外,該工藝受回流比的限制,實現《城鎮污水處理廠綜合排放標準》一級A排放標準(TN<15mg/L)存在困難.
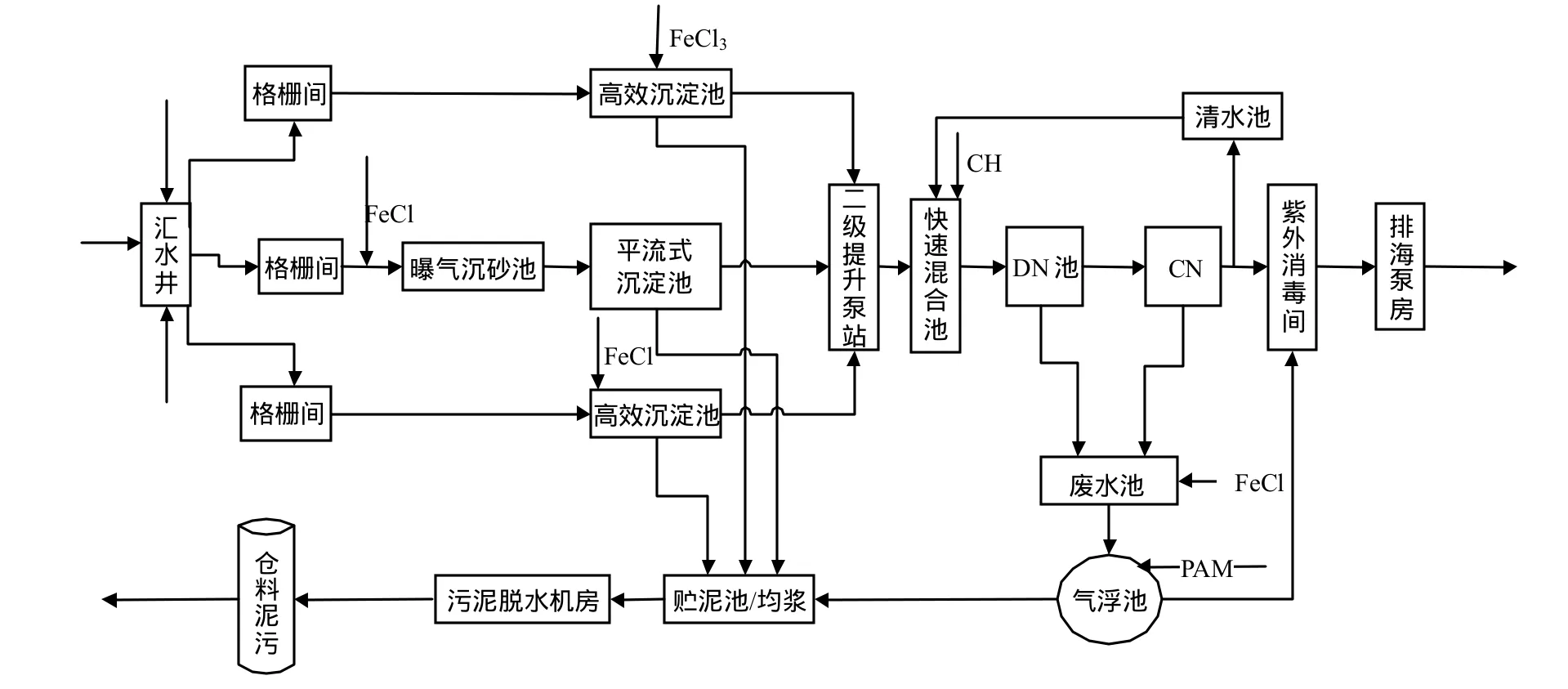
圖1 笎筜污水處理廠工藝流程Fig.1 Flow chart in Yuandang wastewater treatment plant
2 實驗方法
2.1 反硝化濾池模擬裝置的運行
將取自筼筜污水處理廠反硝化濾池的濾料放置于實驗室模擬反應裝置中.反應器由聚丙烯有機玻璃制成,體積 0.16L[面積(4×4)cm2,高10cm],填料層高度為6cm,清水區2cm,采用下部進水,連續流方式運行反應器,進水流量為5.38L/d,水力停留時間約為40min,運行溫度為室溫[(20±2)℃],反應器進水溶解氧濃度為6~7mg/L.進水采用人工配水,由甲醇、硝酸鉀、氯化銨、多聚磷酸二氫鉀混合而成,其中多聚磷酸二氫鉀中含有微生物生長所需要的多種微量元素,水質如表1所示.
2.2 測試項目與方法
對連續流反應器的監測指標和方法如下[6]:氨氮、硝氮、TN:分光光度法,COD:重鉻酸鉀滴定法,溶解氧濃度:電極法.

表1 人工配水水質(mg/L)Table 1 Chemical compositions of synthetic wastewater(mg/L)
2.3 氧和硝酸鹽微電極制備及標定
按照文獻[7]的方法制作分離式氧微電極及液膜離子選擇性硝酸鹽微電極.分離式氧微電極尖端直徑在15μm左右.測試中以Ag/AgCl/飽和KCl電極為參比電極,兩極間添加0.6~0.8V的極化電壓,產生極限擴散電流,此電流與溶解氧濃度成正比,用皮安計(PA2000,Unisense,瑞典)記錄此電流的變化情況,通過繪制標定曲線進一步換算出溶解氧濃度.
液膜離子選擇性硝酸鹽微電極尖端直徑在25μm 左右,液膜采用 Fluka 74529,測試中以Ag/AgCl/飽和KCl電極為參比電極,以電化學工作站(CHI660,上海辰華)記錄開路電壓,通過繪制標準曲線進一步換算出硝酸鹽濃度.
2.4 濾料生物膜內特征參數濃度分布曲線的測定
從運行15d的模擬反應器中取出一粒濾料,放置于載玻片上,以模擬反應器出水覆蓋濾料.開始用氧以及硝酸鹽微電極依次測試沿濾料半徑方向上的氧及硝酸鹽分布曲線.為減小電磁干擾和機械振動對微電極測試的干擾,反應器及皮安計均放于屏蔽箱中,整個屏蔽箱置于防震平臺(63-500型,美國TMC公司)上.微電極由三維微動平臺固定和控制方向(MAMS-02型,北京金達清創環境科技有限公司),在體式顯微鏡(XTL-20型,北京泰克儀器有限公司)的觀察下,調節微動平臺,使微電極尖端位于測試通道與主體溶液的交界面,然后以50μm為調節步長向下移動微電極.Ag/AgCl飽和KCl電極(218型,上海羅素科技有限公司)固定于主體溶液中的某一位置充當參比電極.
3 結果與討論
3.1 氧、硝酸鹽微電極的標定
根據氧微電極對測定溶液的響應電流值與溶液中溶解氧濃度成正比,對多支氧微電極進行三點標定(氧分壓分別是0%、10.5%和21%),圖2為典型的氧微電極標定曲線.此外,以去離子水配置系列濃度梯度的硝酸鹽標定溶液,對硝酸鹽微電極進行多點標定,圖3為典型的硝酸鹽微電極標定曲線,檢測下限為5×10-6mol/L.
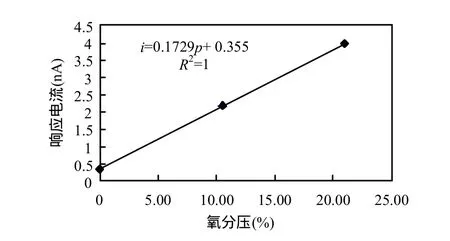
圖2 分離式氧微電極標定曲線Fig.2 Calibration curve of separated oxygen microelectrode
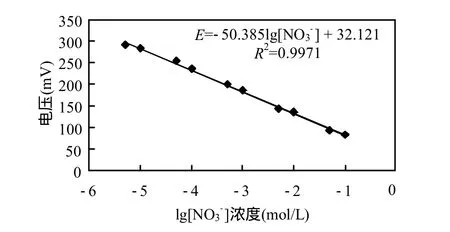
圖3 硝酸鹽微電極的Nernst響應曲線Fig.3 Nernst response curve of nitrate microelectrode
3.2 反硝化濾池生物膜內氧及硝酸鹽分布測試
生物膜內部特征參數的濃度分布情況與活性直接相關,是揭示生物膜內部傳質及生化反應特性的重要依據.圖4為微電極測試獲得的生物膜內部溶解氧及硝酸鹽分布曲線,其中溶解氧濃度為2次測量后的平均值及標準方差.由圖可知,隨著氨氮以及有機物的耗氧作用下,生物膜內溶解氧濃度呈現明顯的下降趨勢,主體溶液溶解氧濃度約1mg/L,在生物膜內部不足300μm深度處下降至 0.硝酸鹽濃度也有明顯的下降趨勢,由主體溶液的約6.5mg/L下降至約4.5mg/L,下降區域延續到生物膜內部600μm深度范圍.在生物膜深度 600μm以下,硝酸鹽濃度沒有明顯的變化,表明該區域反硝化活性很低,對硝酸鹽的去除沒有明顯貢獻.此外,結合溶解氧及硝酸鹽的分布曲線來看,在生物膜表層 300μm,即溶解氧>0mg/L區域內,硝酸鹽隨生物膜深度下降幅度不大,且呈上凸拋物線分布,根據參考文獻[3-4]對生物膜反應過程的判斷,反硝化發生的范圍應該在生物膜內部300~600μm范圍內,也證實了溶解氧先于硝酸鹽作為電子受體得到利用.
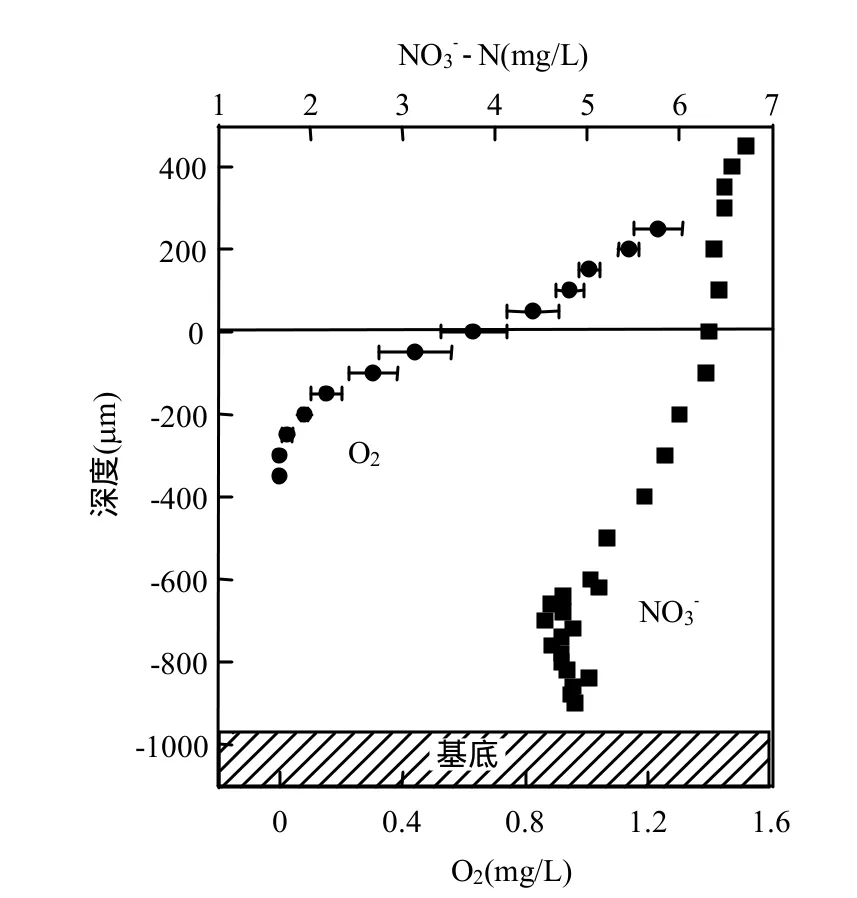
圖4 反硝化濾料生物膜溶解氧及硝酸鹽分布曲線Fig.4 Oxygen and nitrate profiles measured in biofilm taken from the denitrification biofilter
3.3 生物膜內氧及硝酸鹽反應動力學及競爭分析
假設生物膜內部物質傳輸形式符合Fick第一擴散定律,隨深度方向上擴散系數不發生變化,物質分布近似處于穩態.此外,氧以及硝酸鹽的生物反應過程通常可以通過零級反應方程式來描述[8-9].而且自配水中氨氮濃度低,硝化反應過程可以忽略不計.綜上,建立生物膜內部的擴散-反應方程來描述生物膜內氧利用及反硝化過程,如式(1)及式(2)所示.
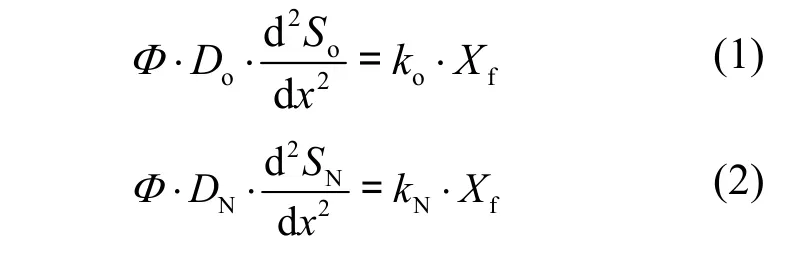
式中: So、SN分別為氧和硝酸根濃度, g/m3;Φ為孔隙率;Do、DN分別為氧和硝酸鹽的分子擴散系數, m2/d;x為生物膜深度, m; ko為氧反應速率常數,g/(g VSS·d);kN為反硝化速率常數,g/(g VSS·d); Xf為生物膜密度,g VSS/m3.根據文獻[10],氧和硝酸鹽分子擴散系數分別是 1.81×10-4m2/d和1.06×10-4m2/d.
由式(1)及式(2)可知,生物膜內溶解氧及硝酸根隨深度方向的分布符合拋物線形式,即:
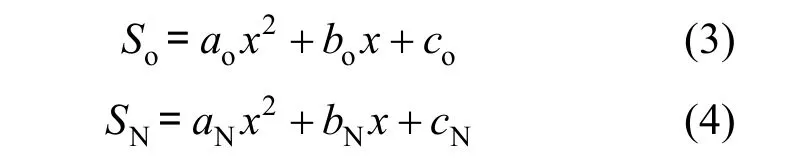
其中:
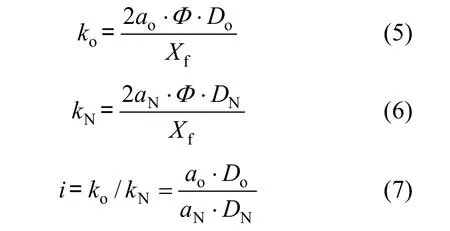
根據式(1)及式(2)以及測量獲得的氧和硝酸鹽沿生物膜深度方向的濃度分布曲線(圖4),通過數據擬合可以推導出反硝化濾池生物膜氧反應速率常數以及反硝化速率常數,兩者的比值為 i= 1.46.
當主體溶液溶解氧為1mg/L左右時,生物膜內部仍然會有明顯的耗氧過程,而且氧利用速率常數略高于反硝化速率常數,體現了氧與硝酸根的競爭關系,且生物膜內部反硝化速率不高的一個可能原因是氧消耗過程中耦合了有機物利用,使得生物膜內部有機物不充分.
4 結論
4.1 研制出性能良好的分離式氧微電極和硝酸鹽微電極,尖端直徑都在30μm以內,為研究反硝化濾池中溶解氧對反硝化作用的影響提供了技術手段.
4.2 通過對反硝化濾池生物膜內部氧及硝酸鹽濃度的分布測試表明,生物膜內溶解氧和硝酸鹽濃度都呈下降趨勢,在生物膜深度300μm內溶解氧濃度下降至約為 0,而發生反硝化的區域在生物膜內300~600μm深度范圍,證實了生物膜內部溶解氧先于硝酸鹽作為電子受體而得到利用.
4.3 通過生物膜內氧及硝酸鹽反應動力學及競爭分析,推導出反硝化濾池生物膜氧利用速率常數與反硝化速率常數的比值為 1.46,溶解氧對反硝化過程的影響是顯著的.
[1] 沈曉玲,李大成,蔣嵐嵐,等.深床反硝化濾池在污水廠提標擴建工程中的應用 [J]. 中國給水排水, 2010,26(4):32-34.
[2] 周小紅,施漢昌,蔡 強.基于微電極的生物膜分析技術的研究進展 [J]. 環境監測管理與技術, 2006,18(1):32-35.
[3] W?sche S, Horn H. Influence of growth conditions on biofilm development and mass transfer at the bulk/biofilm interface [J]. Water Research, 2002,36(19):4775-4784.
[4] Lewandowski Z, Stoodley P, Altobelli S, Fukushima E. Hydrodynamics and kinetics in biofilm systems-recent advances and new problems [J]. Water Science and Technology,29(10/11): 223-229.
[5] Li B K, Bishop P L. Micro-profiles of activated sludge floc determined using microelectrodes [J]. Water Research, 2004, 38(5):1248-1258.
[6] 國家環境保護總局.水和廢水監測分析方法 [M]. 4版.北京:中國環境科學出版社, 2002.
[7] 周小紅.基于微電極的懸浮球填料內部特性測試和脫氮過程研究 [D]. 北京: 清華大學, 2007.
[8] ZHOU Xiaohong, Yu Tong, SHI Hanchang, et al. Temporal and spatial inhibitory effects of zinc and copper on wastewater biofilms from oxygen concentration profiles determined by microelectrodes [J]. Water Researh, 2011,45(2):953-959.
[9] Mogens Henze, Poul Harremoes, Jes la Cour Jansen.污水生物與化學處理技術(丹)[M]. 國家城市給水排水工程技術研究中心譯.
[10] 許保玖,龍騰銳.當代給水與廢水處理原理 [M]. 2版.北京:高等教育出版社, 2000.

