鈦氧化物熔鹽電脫氧工藝用氯化物熔鹽的選擇
陳志遠(yuǎn),劉俊昊,周國治,2
(1.北京科技大學(xué)鋼鐵冶金新技術(shù)國家重點(diǎn)實(shí)驗(yàn)室,北京100083)(2.上海大學(xué)材料科學(xué)與工程學(xué)院,上海200072)
鈦氧化物熔鹽電脫氧工藝用氯化物熔鹽的選擇
陳志遠(yuǎn)1,劉俊昊1,周國治1,2
(1.北京科技大學(xué)鋼鐵冶金新技術(shù)國家重點(diǎn)實(shí)驗(yàn)室,北京100083)(2.上海大學(xué)材料科學(xué)與工程學(xué)院,上海200072)
氧化鈦熔鹽電脫氧工藝所使用的熔鹽電解質(zhì)體系的選擇是其走向工業(yè)化應(yīng)用過程中必然需要解決的問題,然而現(xiàn)有文獻(xiàn)中還沒有較系統(tǒng)的研究。熔鹽成分設(shè)計(jì)應(yīng)該從熔鹽的密度、粘度、表面性質(zhì)、電導(dǎo)、離子遷移數(shù)及氧溶量等多方面考慮。因此在氯化物范圍內(nèi)從蒸汽壓、熔點(diǎn)、分解電壓及經(jīng)濟(jì)性等方面對氧化鈦熔鹽電脫氧工藝可以使用的各種熔鹽做了考察,結(jié)果表明,可以使用的熔鹽主要成分為CaCl2-KCl-NaCl三元系。BaCl2和LiCl及稀土氯化物等也可以適量加入電解質(zhì)中。
熔鹽;電脫氧;鈦
1 前言
2000年以來,鈦氧化物熔鹽電脫氧工藝從FFCCambridge 法[1-2]發(fā)展到 OS 法[3-4]、SOM 法[5]、USTB法[6]及EMR/MSE法[7]等眾多制備金屬鈦或鈦合金的方法,并且有部分工藝已經(jīng)向放大實(shí)驗(yàn)階段發(fā)展。人們對熔鹽電脫氧原理[8-10]、電解工藝參數(shù)[4]、陰極材料的制備和影響[10-12]、惰性陽極材料[13-14]等一系列的問題都已進(jìn)行了大量的研究。眾所周知,電解質(zhì)性質(zhì)對電解過程的影響十分重要,但在熔鹽成分的選擇優(yōu)化方面,文獻(xiàn)并沒有給出系統(tǒng)和全面的考慮。現(xiàn)有工作中采用的電解質(zhì)主要是氯化物體系,因?yàn)橄鄬Ψ锒月然锔g性較弱,便于廢棄物處理,其熔點(diǎn)也比氟化物和氧化物低,相對儲量也較高。如表1所示,研究所用的電解質(zhì)集中在單一的CaCl2,CaCl2配加一定量的NaCl以及KCl和NaCl混合物這幾種熔鹽體系上。也就是說,CaCl2,KCl和NaCl是現(xiàn)有研究考慮的基本體系,而且大多數(shù)研究采用純CaCl2的電解質(zhì)體系。但是在選擇這些熔鹽的必要性以及熔鹽具體成分設(shè)計(jì)方面,文獻(xiàn)中并沒有詳細(xì)的闡述,工藝路線是不完備的。如FFC-Cambridge工藝最開始采用CaCl2熔鹽電解,但最終與OS法一樣都采用了除CaCl2熔鹽外還加入少量CaO。加入CaO對于OS法是工藝原理的要求,而FFC-Cambridge法是從動力學(xué)來考慮的。但是它們都沒有對熔鹽作用機(jī)理進(jìn)行更深入地探討。另外,隨著工藝路線不斷拓展,熔鹽從單一的CaCl2向多種氯化物混合發(fā)展,雖然在這方面有一些評估和研究[15-18],然而卻沒有相關(guān)熔鹽性質(zhì)的詳細(xì)論述,更多的研究工作是必要的。
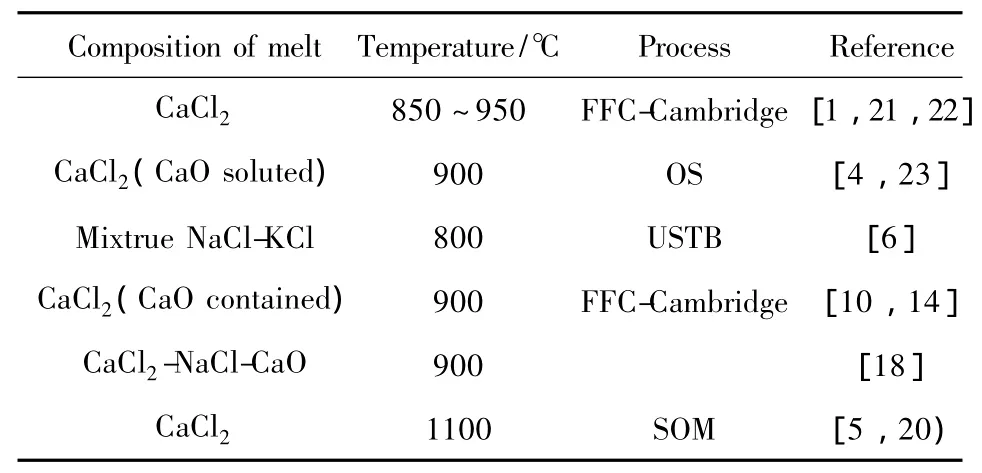
表1 文獻(xiàn)中鈦熔鹽電脫氧生產(chǎn)方法研究采用的熔鹽成分Table 1 The composition of melt using the electro-deoxidation process to produce Ti
使用氯化鈣的原因在于氯化鈣價格較低、熔點(diǎn)適宜、蒸氣壓低、氧溶量較高等。作為一項(xiàng)基礎(chǔ)性的工作,本文將從以下幾個因素來評價氯化物熔鹽的可用性,并通過篩選得出合適的氯化物熔鹽體系。在此基礎(chǔ)上,通過對熔鹽具體性能的評價和綜合討論,我們將進(jìn)一步提出適合這一工藝體系的較優(yōu)熔鹽。
2 熔鹽的選擇
2.1 常見的氯化物熔鹽
在進(jìn)行物理化學(xué)性質(zhì)的考量之前,首先從其價格因素來考慮。鈦的生產(chǎn)需要向低成本的方向發(fā)展,因此成本過高、產(chǎn)量太少的氯化物不能做為主要成分使用。但稀土氯化物ReClx這一類熔鹽可能對電解過程有所幫助,也可以做為微量添加劑加入。圖1元素周期表中氯化物可作為本文研究的氯化物范圍。表中給出了各元素對應(yīng)的常見氯化物的熔點(diǎn)和相應(yīng)陽離子價態(tài)[19]。其中有的元素有2種對應(yīng)常見的氯化物。接近室溫以液態(tài)形式存在、或直接從固態(tài)升華成氣態(tài)的部分氯化物并未列出。
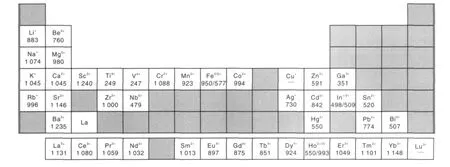
圖1 氯化物對應(yīng)陽離子價態(tài)及相應(yīng)熔點(diǎn)(K)Fig.1 Melting point of chlorides(K)and valence state of corresponding cations
2.2 熔鹽的熔點(diǎn)
大多數(shù)研究工作是在800~900℃范圍進(jìn)行的。這個溫度的選擇和熔融CaCl2的粘度、電導(dǎo)率變化及蒸汽壓等有關(guān)。對于純CaCl2來說,這樣溫度下的單位揮發(fā)量較少,同時由于比熔點(diǎn)高出一些,因此流動性和導(dǎo)電性都有較大提高。在一些文獻(xiàn)中采用的實(shí)驗(yàn)溫度更低一些,是因?yàn)榧尤肓薑Cl等熔鹽,使電解質(zhì)的熔點(diǎn)下降。決定熔鹽電脫氧溫度的一個重要因素是高溫時氧化鈦陰極中氧的脫除速率比較快。溫度較高可以使電脫氧的動力學(xué)有較明顯的改善,但是溫度升高也伴隨著熔鹽蒸氣壓升高、腐蝕性增強(qiáng)以及工藝成本增加。就以上溫度考量,電脫氧工藝中熔鹽的熔點(diǎn)比800~900℃這個范圍低數(shù)十?dāng)z氏度較好。這樣既保證了熔鹽流動性,也避免溫度相對熔點(diǎn)過高帶來的弊端。因此熔鹽主要成分的熔點(diǎn)須滿足這一條件,而其它成分可以在這一范圍上下浮動。一些熔點(diǎn)接近于室溫的氯化物如AlCl3,ZnCl2,BiCl3等就不能做為熔鹽的主要成分。大多數(shù)的稀土氯化物的熔點(diǎn)正好在電解溫度附近。就熔點(diǎn)來說,Ca,K,Na,Mg,Zr,Co,Cr等元素的氯化物都適宜做電解質(zhì)主要成分,Ba,Sc,Sr等元素的氯化物可適量加入。
2.3 熔鹽的蒸氣壓
有些氯化物在熔點(diǎn)以上不多的溫度下就能達(dá)到較大蒸氣壓值。蒸氣壓過高會使氯化物在電解過程中氣相揮發(fā),造成損失,影響電解進(jìn)行。氯化物在電解槽的低溫部位凝集,電解質(zhì)成分波動等都對生產(chǎn)過程不利。研究中采用的CaCl2,NaCl,KCl都是蒸氣壓較低的熔鹽。根據(jù)文獻(xiàn)[19]計(jì)算,在800~900℃范圍內(nèi)接近這3種氯化物蒸氣壓的氯化物如圖2所示。其中KCl,NaCl,MgCl2,LiCl等熔鹽由于存在多種氣相,圖中只選取了其中氣相分壓較高的相。由圖可見BaCl2,CaCl2,AgCl及圖中ReClx的蒸氣壓較低,KCl,NaCl,LiCl和MgCl2等次之。可做電脫氧熔鹽主要成分的除了稀土氯化物以外,以上氯化物都適宜。

圖2 氯化物蒸氣壓與溫度的關(guān)系Fig.2 Vapor pressure of chlorides
2.4 熔鹽的分解電壓
據(jù)Factsage計(jì)算,在鈦熔鹽電脫氧過程中發(fā)生的反應(yīng)式為:

脫氧工藝電壓以此為基礎(chǔ)來設(shè)計(jì)。在不同工藝中,采用的脫氧電壓有所不同。如FFC-Cambridge法和OS法等通常采用2.5~3.2 V操作電壓[2,4];由于 SOM 法采用固體透氧膜防止了某些副反應(yīng)的發(fā)生,所以采用的電壓值可以更高[20]。這些電壓值必須超過TiO2及其電解過程產(chǎn)生的中間生成物的分解電壓。一般來說,熔鹽的分解電壓應(yīng)該在工作電壓之上。圖3列出了除稀土元素以外的常見氯化物的分解電壓以及電脫氧總反應(yīng)式對應(yīng)電壓值。可以看出在碳作為陰極的情況下,相對于氯化物分解電壓,TiO2電脫氧所需電壓值不大。那么,結(jié)合其蒸氣壓值情況,從熔鹽分解電壓來考慮,Ba,K,Na,Ca,Li,Mg,Zr,Cr,Pb,F(xiàn)e 等對應(yīng)的氯化物都可以做為鈦氧化物熔鹽電脫氧所使用的電解質(zhì)。但Zr,Cr,F(xiàn)e,Pb均為變價元素,其氯化物做為電解質(zhì)會產(chǎn)生電流空耗等問題。考慮到毒性和價格因素,BaCl2與LiCl不能做為主要成分使用。另外,如果對現(xiàn)有熔鹽電解中常采用的電解電壓來說,MgCl2僅有的2 V左右的分解電壓是不太合適的。因此,KCl,NaCl,CaCl2是應(yīng)考慮的基本氯化物電解質(zhì)。
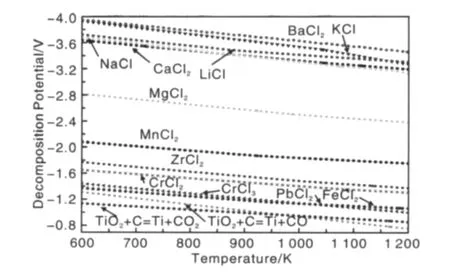
圖3 氯化物熔鹽分解電壓與氧化鈦電解電壓值的比較Fig.3 Comparison of decomposition voltage of chlorides and electro-deoxidation voltage of titanium oxide
如果考慮電脫氧工藝中的陽極材料為惰性材料,那么反應(yīng)過程就應(yīng)該是以下方程:

這樣一來,電脫氧所需電壓值就大大上升了。如圖3所示,KCl,NaCl,CaCl2,MgCl2,BaCl2與 LiCl可以滿足要求。
鈦有多種價態(tài),相應(yīng)也有許多氧化物形式存在,另外如果考慮在熔鹽中電解,又可能與熔鹽中的成分反應(yīng)生成另外的復(fù)雜氧化物。這樣使鈦在電脫氧過程中的存在形式隨電解時間的延長而會發(fā)生多次變化。由于動力學(xué)條件和觀察手段等不同,不同文獻(xiàn)檢測到的反應(yīng)中間產(chǎn)物中鈦存在形式也不同。Fray及Bhagat等的研究觀察到電解過程中鈦的高價氧化物向低價氧化物方向依次出現(xiàn),并且CaCl2作為電解質(zhì)時會有鈣鈦氧化物的出現(xiàn)[10,21-22,24]。因此在這種多種氧化物存在的復(fù)雜情況下,避免不利于電脫氧過程的氧化物也是一項(xiàng)重要的研究內(nèi)容。
就熔鹽的選擇來說,中間產(chǎn)物的分解電壓也是需要考慮的影響因素之一。因?yàn)槿恐虚g產(chǎn)物在施加的工作電壓下均希望向有利于電脫氧過程的方向轉(zhuǎn)變。圖4根據(jù)文獻(xiàn)中提及的常見的反應(yīng)中間產(chǎn)物給出了可能發(fā)生的一些電化學(xué)反應(yīng)對應(yīng)電位值。其中,根據(jù)Suzuki的研究,電解質(zhì)中對應(yīng)最佳氧含量范圍的是0.5% ~1.0%(物質(zhì)的量)的 CaO[23]。因此,圖4還給出了一組不同活度的CaO電解還原反應(yīng)對應(yīng)的電位值曲線。這一組曲線對應(yīng)的電位值是最高的。從圖4中可知,對于OS法,電脫氧無論是否使用惰性陽極,所選擇氯化物電解質(zhì)均是 KCl,NaCl,CaCl2,BaCl2與LiCl。FFC-Cambridge法的氯化物選擇范圍除此之外還有MgCl2。由于SOM法有固體電解質(zhì)膜存在,所以電解質(zhì)可選范圍應(yīng)該可以在FFC-Cambridge法的基礎(chǔ)上適當(dāng)增加。

圖4 電脫氧工藝中可能出現(xiàn)的部分電化學(xué)反應(yīng)對應(yīng)電位值Fig.4 The potential value of some electrichemical reaction in electro-deoxidation process
2.5 KCl-NaCl-CaCl2三元系的研究
從以上幾個因素可以看出KCl-NaCl-CaCl2三元系作為電脫氧工藝生產(chǎn)金屬鈦或鈦合金的基礎(chǔ)三元系是較合適的。因此對以這個三元系為基礎(chǔ)的多元系熔鹽性質(zhì)進(jìn)行深入研究是必要的。
熔鹽性質(zhì)研究屬于高溫?zé)崃W(xué)范疇。通常,精確測定熱力學(xué)數(shù)據(jù)對于實(shí)驗(yàn)設(shè)備、人員操作和經(jīng)費(fèi)要求是很高的。高溫操作使實(shí)驗(yàn)更加困難,花費(fèi)時間更長,還要保證數(shù)據(jù)具有足夠的精確度。針對熔體的復(fù)雜性和測量上的困難,近年發(fā)展起來的半經(jīng)驗(yàn)半理論的熱力學(xué)模型,是解決上述困難的一種十分有效的方法。尤其以基于二元系計(jì)算多元系的“幾何模型”,在相圖計(jì)算和熱力學(xué)性質(zhì)的預(yù)測中,起到了重要的作用。其準(zhǔn)確性和廣泛的適用性已得到了檢驗(yàn)。
幾何模型是一類利用二元系熱力學(xué)性質(zhì)去計(jì)算三元系乃至多元系熱力學(xué)性質(zhì)的模型。我們已經(jīng)將其成功應(yīng)用到了四元系的計(jì)算中,并對多種熱力學(xué)性質(zhì)作了成功的預(yù)測。幾何模型的發(fā)展經(jīng)過了2個階段。第一代模型有很多種,總體劃分為對稱模型和非對稱模型。前者不能由三元系還原到二元系,而后者則會由于非對稱造成了計(jì)算中選點(diǎn)的不唯一性。新一代幾何模型打破了對稱和非對稱的界限,并克服了幾何模型中的缺陷[25-28]。用這一模型預(yù)測熔鹽性質(zhì),將有助于電脫氧電解質(zhì)體系的優(yōu)化工作。
新一代幾何模型的核心在于提出了權(quán)重因子等相關(guān)概念,認(rèn)為三元系計(jì)算所需的二元系點(diǎn)的選取與對應(yīng)的體系有關(guān)。計(jì)算的基本思路是通過權(quán)重因子的分配,將三元系熱力學(xué)超額量用邊界上的二元系量求出。
三元系i-j-k的熱力學(xué)性質(zhì)超額量YE可用下式表示:
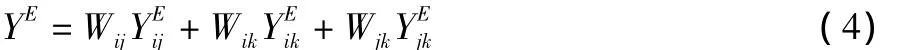

這里的xi和xj表示三元系中組元i和j各自占的量。它們與二元系i-j中組元i的量的關(guān)系如下所示::

這里,相似系數(shù):
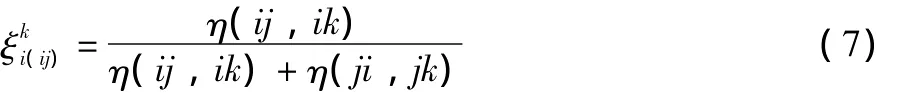
表示i-j和j-k兩個二元系之間相偏離的偏差函數(shù)為:

在電脫氧熔鹽性質(zhì)研究中,我們利用幾何模型初步進(jìn)行了計(jì)算,根據(jù) Janz的數(shù)據(jù)[29-30]得到在1 080 K溫度時的KCl-NaCl-CaCl2三元系熔鹽當(dāng)量電導(dǎo)圖如圖5所示。由圖5可知,NaCl的當(dāng)量電導(dǎo)是最高的,而CaCl2-KCl的當(dāng)量電導(dǎo)是最低的。除了這一體系電導(dǎo)的計(jì)算外,其它性質(zhì)和體系也正在計(jì)算和評估中。

圖5 KCl-NaCl-CaCl2三元系在1 080 K的當(dāng)量電導(dǎo)值Fig.5 The equivalent conductance of KCl-NaCl-CaCl2at 1 080 K
3 結(jié)論
熔鹽的成分設(shè)計(jì)應(yīng)該還從熔鹽的密度、粘度、表面性質(zhì)、電導(dǎo)、離子遷移數(shù)及氧溶量等多方面考慮。研究結(jié)果表明,KCl-NaCl-CaCl2三元系可以作為電脫氧生產(chǎn)金屬鈦或鈦合金的基礎(chǔ)三元系。BaCl2,LiCl及稀土氯化物可少量加入。K,Na,Ca,Ba,Li對應(yīng)的氯化物的分解電壓絕對值都在3 V以上,因此電解時操作電壓可大幅提升,有利于提高還原速率。實(shí)際上,多元系熔鹽性質(zhì)的信息還比較缺乏,需要大量的理論估算和實(shí)驗(yàn)測定。一些有關(guān)KCl-NaCl-CaCl2三元系性質(zhì)的詳細(xì)研究已經(jīng)展開,我們對摩爾電導(dǎo)和熔鹽密度等性質(zhì)的計(jì)算及測定已經(jīng)部分完成。其它性質(zhì)的測定和優(yōu)化,以及電脫氧熔鹽體系的評定工作也正在計(jì)劃中。
在電解過程中,由于碳、氧化物、氯化物等多種化學(xué)物質(zhì)共存,副反應(yīng)的發(fā)生在所難免。因此,減少副反應(yīng)的發(fā)生和促進(jìn)電脫氧反應(yīng)的進(jìn)行也是研究的重要內(nèi)容,熔鹽成分配比對這兩者的影響十分顯著。因此,探索熔鹽成分、性質(zhì)、結(jié)構(gòu)與電脫氧過程中一些工藝參數(shù)之間的關(guān)系是非常必要的。
References
[1]Chen G Z,F(xiàn)ray D J,F(xiàn)arthing T W.Direct Electrochemical Reduction of Titanium Dioxide to Titanium in Molten Calcium Chloride[J].Nature,2000,407(6 802):361 -364.
[2]Schwandt C,Doughty G R,F(xiàn)ray D J.The FFC-Cambridge Process for Titanium Metal Winning[J].Key Engineering Materials,2010,436:13-25.
[3]Ono K,Suzuki R.A New Concept for Producing Ti Sponge:Calciothermic Reduction[J].JOM-Journal of the Minerals Metals &Materials Society,2002,54(2):59-61.
[4]Suzuki R O,Ono K,Teranuma K.Calciothermic Reduction of Titanium Oxide and In-Situ Electrolysis in Molten CaCl2[J].Metallurgical and Materials Transactions B—Process Metallurgy and Materials Processing Science,2003,34(3):287 -295.
[5]Ye X S,Lu X G,Li C H,etal.Preparation of Ti-Fe Based Hydrogen Storage Alloy by SOM Method[J].International Journal of Hydrogen Energy,2010,36(7):4 573-4 579.
[6]Jiao S,Zhu H.Electrolysis of Ti2CO Solid Solution Prepared by TiC and TiO2[J].J Alloys Compd,2007,438(1 -2):243 -246.
[7]Abiko T,Park I,Okabe T H.Reduction of Titanium Oxide in Molten Salt Medium[C]//Procedings of 10thWoild Conference on Titanium.Hamburg:10thWorld Conference on Titanium,2003:261-268.
[8]Fray D.Emerging Molten Salt Technologies for Metals Production[J].JOM—Journal of the Minerals Metals& Materials Society,2001,53(10):27-31.
[9]Suzuki R O.Direct Reduction Processes for Titanium Oxide in Molten Salt[J].JOM—Journal of the Minerals Metals& Materials Society,2007,59(1):68 -71.
[10]Alexander D T L,Schwandt C,F(xiàn)ray D J.The Electro-Deoxidation of Dense Titanium Dioxide Precursors in Molten Calcium Chloride Giving a New Reaction Pathway[J].Electrochimica Acta,2011,56(9):3 286-3 295.
[11]Ma M,Wang D,Wang W,etal.Extraction of Titanium from Different Titania Precursors by the FFC Cambridge Process[J].Journal of Alloys and Compounds,2006,420(1-2):37-45.
[12]Centeno-Sanchez R L,F(xiàn)ray D J,Chen G Z.Study on the Reduction of Highly Porous TiO2Precursors and Thin TiO2Layers by the FFC-Cambridge Process[J].Journal of Materials Science,2007,42(17):7 494-7 501.
[13]Jiao S,F(xiàn)ray D.Development of an Inert Anode for Electrowinning in Calcium Chloride-Calcium Oxide Melts[J].Metallurgical and Materials Transactions B,2010,41(1):74-79.
[14]Barnett R,Kilby K T,F(xiàn)ray D J.Reduction of Tantalum Pentoxide Using Graphite and Tin-Oxide-Based Anodes via the FFC-Cambridge Process[J].Metallurgical and Materials Transactions B—Process Metallurgy and Materials Processing Science,2009,40(2):150-157.
[15]Lebedev V A,Sal Nikov V I,Sizikov I A,etal.Mechanism and Kinetics of Processes Occurring at TiO2Cathode in CaCl2-CaO Melt[J].Russian Journal of Applied Chemistry,2007,80(9):1 503-1 508.
[16]Suzuki R O.Calciothermic Reduction of TiO2and in Situ Electrolysis of CaO in the Molten CaCl2[J].Journal of Physics and Chemistry of Solids,2005,66(2-4):461-465.
[17]Freidina E B,F(xiàn)ray D J.Study of the Ternary System CaCl2-NaCl-CaO by DSC[J].Thermochimica Acta,2000,356(1 -2):97-100.
[18]Wang S,Wang W,Li S,etal.Cathodic Behavior of Molten CaCl2-CaO and CaCl2-NaCl-CaO[J].International Journal of Minerals,Metallurgy and Matericals,2010,17(6):791 -794.
[19]Hesselmann K,Kubaschewski O,Knacke O.Thermochemical Properties of Inorganic Substances[M].Berlin:Springer,1991.
[20]Zou X L,Lu X G,Li C H,etal.A Direct Electrochemical Route from Oxides to Ti-Si Intermetallics[J].Electrochimica Acta,2010,55(18):5 173-5 179.
[21]Schwandt C,F(xiàn)ray D.Determination of the Kinetic Pathway in the Electrochemical Reduction of Titanium Dioxide in Molten Calcium Chloride[J].Electrochim Acta,2005,51(1):66 -76.
[22]Alexander D,Schwandt C,F(xiàn)ray D.Microstructural Kinetics of Phase Transformations during Electrochemical Reduction of Titanium Dioxide in Molten Calcium Chloride[J].Acta Materialia,2006,54(11):2 933-2 944.
[23]Suzuki R.Calciothermic Reduction of TiO and in Situ Electrolysis of CaO in the Molten CaCl2[J].Journal of Physics and Chemistry of Solids,2005,66(2-4):461-465.
[24]Bhagat R,Dye D,Raghunathan S L,etal.In Situ Synchrotron Diffraction of the Electrochemical Reduction Pathway of TiO2[J].Acta Mater,2010,58(15):5 057 -5 062.
[25]Zhang G H,Wang L J,Chou K C.A Comparison of Different Geometrical Models in Calculating Physicochemical Properties of Quaternary Systems[J].Calphad,2010,34(4):504 -509.
[26]Chou K C.A General Solution Model for Predicting Ternary Thermodynamic Properties[J].Calphad,1995,19(3):315 -325.
[27]Chou K C.A New Solution Model for Predicting Ternary Thermodynamic Properties[J].Calphad,1987,11(3):293 -300.
[28]Chou K C,Wei S K.A New Generation Solution Model for Predicting Thermodynamic Properties of a Multicomponent System from Binaries[J].Metallurgical and Materials Transactions B,1997,28(3):439-445.
[29]Janz G J,Allen C B,Bansal N P,etal.Physical Properties Data Compilations Relevant to Energy Storage.Ⅱ.Molten Salts:Data on Single and Multi-Component Salt Systems[R].NY:Rensselaer Polytechnic Inst,Cogswell Lab,1979.
[30]Janz G J.Physical Properties Data Compilations Relevant to Energy Storage[M].Washington:US Dept of Commerce,National Bureau of Standards,1981.
Selection of Chlorides Melt in Titanium Oxide Electro-Deoxidation Process
CHEN Zhiyuan1,LIU Junhao1,ZHOU Guozhi1,2
(1.State Key Laboratory of Advanced Metallurgy,University of Science and Technology of Beijing,Beijing 100083,China)(2.School of Materials Science and Engineering,Shanghai University,Shanghai 200072,China)
It is an important issue to be solved that how to select suitable electrolyte in the research of electro-deoxidation process to produce titanium from oxides.But there is no systemic study in literatures.A molten salt composition should be designed from the molten salt density,viscosity,surface properties,conductivity,ion migration number and dissolved oxygen etc..This paper discussed the proper chlorides which could be used in this process.Melting point,vapor tension,decomposition voltage,and other aspects have been investigated.CaCl2-KCl-NaCl tertiary was proposed to be the basis electrolyte system.BaCl2,LiCl and rare earth chlorides were important adjunct too.Some systematic study of these melts should be carried out with the consider of some phenomenon surveyed in previous research and properties of chlorides.
fused salt;electro-deoxidation;titanium

周國治
O645.5;TF823
A
1674-3962(2012)01-0044-06
2011-11-02
國家自然科學(xué)基金資助項(xiàng)目(50974084,51174022)
陳志遠(yuǎn),男,1987年生,博士
周國治,男,1937年生,中國科學(xué)院院士

