羧甲基硫脲殼聚糖的結構表征及抑菌活性研究
李小芳,馬金滿,馮小強,王廷璞,楊 聲,張紅娟,孔旭娥
(1.天水師范學院生命科學與化學學院,甘肅 天水 741001;2.甘谷一中,甘肅 甘谷 741200)
羧甲基硫脲殼聚糖的結構表征及抑菌活性研究
李小芳1,馬金滿2,馮小強1,王廷璞1,楊 聲1,張紅娟1,孔旭娥1
(1.天水師范學院生命科學與化學學院,甘肅 天水 741001;2.甘谷一中,甘肅 甘谷 741200)
運用紅外光譜、紫外光譜和差熱-熱重分析對合成的羧甲基硫脲殼聚糖進行結構表征,并研究羧甲基硫脲殼聚糖對大腸桿菌、金黃色葡萄球菌的抑菌活性。結果表明:硫脲殼聚糖中羥基發生了羧甲基化反應,與殼聚糖相比熱穩定性降低;羧甲基硫脲殼聚糖對大腸桿菌、金黃色葡萄球菌的抑菌活性較殼聚糖本身增強,對大腸桿菌、金黃色葡萄球菌最小抑菌質量濃度(MIC)均為0.20mg/mL。
殼聚糖;羧甲基硫脲殼聚糖;表征;抑菌活性
殼聚糖(chitosan,CS)具有無毒無害、安全、可靠、易生物降解,具有抑菌活性高、廣譜、殺滅率高和無毒等優點[1-4],但殼聚糖只溶于酸或酸性溶液中,而不溶于水,故對殼聚糖進行化學改性以提高其溶解性,是殼聚糖研究中最活躍的課題。其中,對羧甲基殼聚糖和硫脲殼聚糖(thiourea chitosan,TCS)研究較多[5-6]。但是,對于羧甲基硫脲殼聚糖(carboxymethyl thiourea chitosan,CMTCS)的制備卻鮮有報道。
本實驗合成了羧甲基硫脲殼聚糖,采用紅外、紫外和差熱-熱重分析手段表征其結構與性質,并考察其對大腸桿菌、金黃色葡萄球菌的抑菌活性。該研究旨在為殼聚糖及其衍生物的臨床應用提供更加充分的實驗依據,擴大殼聚糖在醫藥和食品工業等領域的應用范圍。
1 材料與方法
1.1 材料、試劑與儀器
殼聚糖(Mw=50kD,純度90%,用體積分數1.0% HAc溶解) 浙江玉環殼聚糖有限公司;氯乙酸、硫脲(分析純) 天津化學試劑公司。
大腸桿菌(E.coli,ATCC 35218)、金黃色葡萄球菌(St.aureus,ATCC 26113)由天水市中醫院化驗科提供。
Spectrum One 3.0傅里葉變換紅外光譜儀、差熱-熱重分析儀 美國Perkin Elmer公司;UV-2450紫外-可見分光光度計 日本島津公司。
1.2 方法
1.2.1 羧甲基硫脲殼聚糖的制備
稱取3.22g殼聚糖和3.04g硫脲,加入到含有60mL無水乙醇的燒瓶中,80℃回流12h后,冷卻至室溫,抽濾,用無水乙醇洗滌3次,將濾餅溶解在500mL1% HAc溶液中,向該溶液中加入10g/100mL NaOH溶液至沉淀完全,過濾,用蒸餾水洗滌,干燥,得硫脲殼聚糖[7]。元素分析法測得硫脲基團的取代度為10%。
稱取1.81g硫脲殼聚糖,加人23mL 42g/100mL NaOH溶液,冰水浴中攪拌2h。將4.53g氯乙酸溶于23mL異丙醇中,0.5h內滴入硫脲殼聚糖的NaOH溶液中,溫度控制在40~60℃,回流48h,過濾,將濾渣溶解在92mL蒸餾水中,用2.5mol/L的HCl調節pH值為7.0,離心分離,向濾液中加入無水乙醇,至不再有沉淀析出,抽濾,用無水乙醇洗滌3次,干燥得羧甲基硫脲殼聚糖。酸堿滴定法測得羧甲基基團的取代度為65%[8]。
1.2.2 結構表征
采用KBr壓片法,400~4000cm-1范圍掃描紅外光譜;用1.0% HAc溶解配制1.0mg/mL羧甲基硫脲殼聚糖、硫脲殼聚糖和殼聚糖溶液,在波長200~500nm范圍內掃描紫外光譜;以α-Al2O3為參比,N2保護下以10℃/min升溫速度升溫至800℃,測定殼聚糖、硫脲殼聚糖和羧甲基硫脲殼聚糖的差熱-熱重曲線。
1.2.3 抑菌實驗
將受試標準菌株接種于液體培養基(0.6g牛肉膏、2.0g蛋白胨、1.0g氯化鈉、200mL 水,調pH值為7.4~7.6),37℃活化24h。分別配制5.0mg/mL的殼聚糖、硫脲殼聚糖和羧甲基硫脲殼聚糖作為母液備用。1.0mL 5.0mg/mL殼聚糖、硫脲殼聚糖、羧甲基硫脲殼聚糖和15mL含有受試菌的液體培養基混合于試管中,以1.0mL1.0% HAc溶液作為空白對照,37℃、120r/min搖床振蕩培養24~48h,測定不同時間內的OD610nm值。光密度越小,抑菌活性越強。
1.2.4 最小抑菌質量濃度測定
將一定體積的5mg/mL羧甲基硫脲殼聚糖和固體培養基混合均勻,使其最終質量濃度分別為0、0.025、0.05、0.1、0.15、0.20mg/mL和0.25mg/mL,滅菌后倒平板,待冷卻后,接入100μL菌懸液涂布均勻,置于37℃條件下恒溫培養,計算菌落數并拍照。以肉眼觀察不到菌落時對應的質量濃度即為羧甲基硫脲殼聚糖對E.coli和St.aureus的最小抑菌質量濃度(MIC)。
2 結果與分析
2.1 紅外光譜分析結果
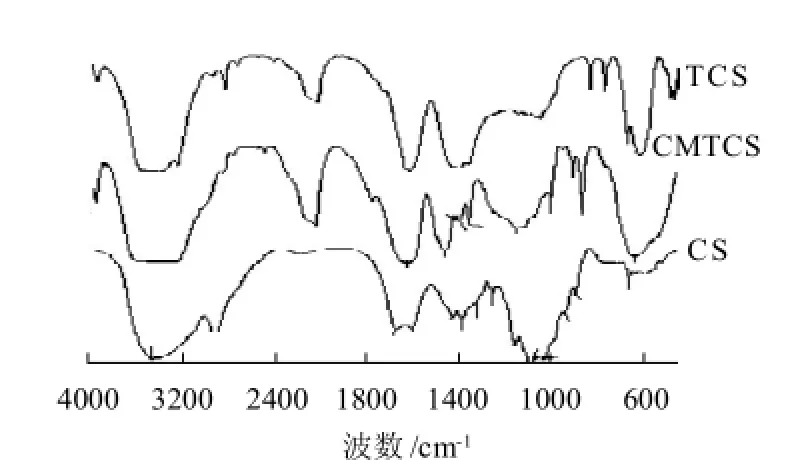
圖1 殼聚糖、硫脲殼聚糖和羧甲基硫脲殼聚糖的紅外光譜Fig.1 IR spectra of CS, TCS and CMTCS
殼聚糖、硫脲殼聚糖和羧甲基硫脲殼聚糖的紅外光譜如圖1所示。殼聚糖位于3445cm-1處寬且強的吸收峰為N-H和O-H的伸縮振動峰,在脲殼聚糖中該吸收峰明顯變窄,體現-NH2和-OH形成的氫鍵能力減弱;890cm-1附近的吸收峰始終存在β-構型糖苷鍵的特征吸收峰,這就說明反應前后殼聚糖的環狀構型未發生任何改變;在1455cm-1附近有一新吸收峰,說明殼聚糖分子中引入了-C=S基團[9];殼聚糖1600cm-1處N-H剪式振動吸收峰位移至1615、1035cm-1和1082cm-1處伯醇和仲醇C-O伸縮振動峰分別位移至1050cm-1和1069cm-1,說明殼聚糖中的氨基和羥基均參與了反應。
羧甲基硫脲殼聚糖在890cm-1附近有β-構型糖苷鍵的特征吸收峰,說明接枝反應沒有破壞殼聚糖分子鏈節中的吡喃苷的六元環結構;在1774cm-1處產生新吸收峰,歸屬于羧基中-C=O的伸縮振動峰;原硫脲殼聚糖1050cm-1和1069cm-1處伯醇和仲醇C—O伸縮振動峰,在羧甲基硫脲殼聚糖中分別位移至1055cm-1和1119cm-1,表明硫脲殼聚糖中羥基發生了羧甲基化反應;位于1615cm-1處的氨基吸收帶仍然存在,表明硫脲殼聚糖分子鏈上的大量-NH2沒有發生羧甲基化反應。
2.2 紫外光譜分析結果

圖2 殼聚糖、硫脲殼聚糖、羧甲基硫脲殼聚糖的紫外光譜Fig.2 Ultraviolet spectra of CS, TCS and CMTCS
殼聚糖、硫脲殼聚糖和羧甲基硫脲殼聚糖分別在波長 224.50、235.00nm和232.00nm處有強吸收峰(圖2),這是由于配合物中氮、氧和硫的孤對電子發生n→σ*躍遷和π→π*躍遷,導致電子光譜發生的變化所致,且在同一質量濃度下,硫脲殼聚糖的吸收強度強于殼聚糖。
2.3 差熱熱重分析結果
殼聚糖、硫脲殼聚糖、羧甲基硫脲殼聚糖的差熱-熱重分析如圖3所示。殼聚糖的降解分為3個階段[10]:第一個階段在80℃開始,失重7.6%,主要是失去水分子;第二個階段失重在219℃開始,到283.6℃失重達最大,失重58.6%,主要是殼聚糖的分解,也涉及氧化分解等;第三個階段失重在382.9℃開始,到543℃時殼聚糖完全分解,失重38.8%。硫脲殼聚糖的降解的第一個階段在75℃開始,主要是水的失重;第二個階段在187.3℃開始,在250.8℃失重達最大,失重37%,當溫度升至800℃時,質量還剩余37%。羧甲基硫脲殼聚糖降解的第一個階段在76℃開始,失重12%,第二個階段在203℃開始,在360℃失重達最大值為32%,在276℃出現一個強放熱峰,當溫度升至800℃時,質量還剩余35%。由此表明,硫脲殼聚糖和羧甲基硫脲殼聚糖主鏈斷裂的溫度明顯低于殼聚糖主鏈斷裂的溫度,與殼聚糖相比不穩定,它們的不穩定性是由于缺少自由的氨基,在制備衍生物時氨基被硫脲基團取代,殼聚糖因其自由的氨基而更穩定[11]。因此,溫度較低時殼聚糖比較穩定,而溫度較高時硫脲殼聚糖和羧甲基硫脲殼聚糖比較穩定。
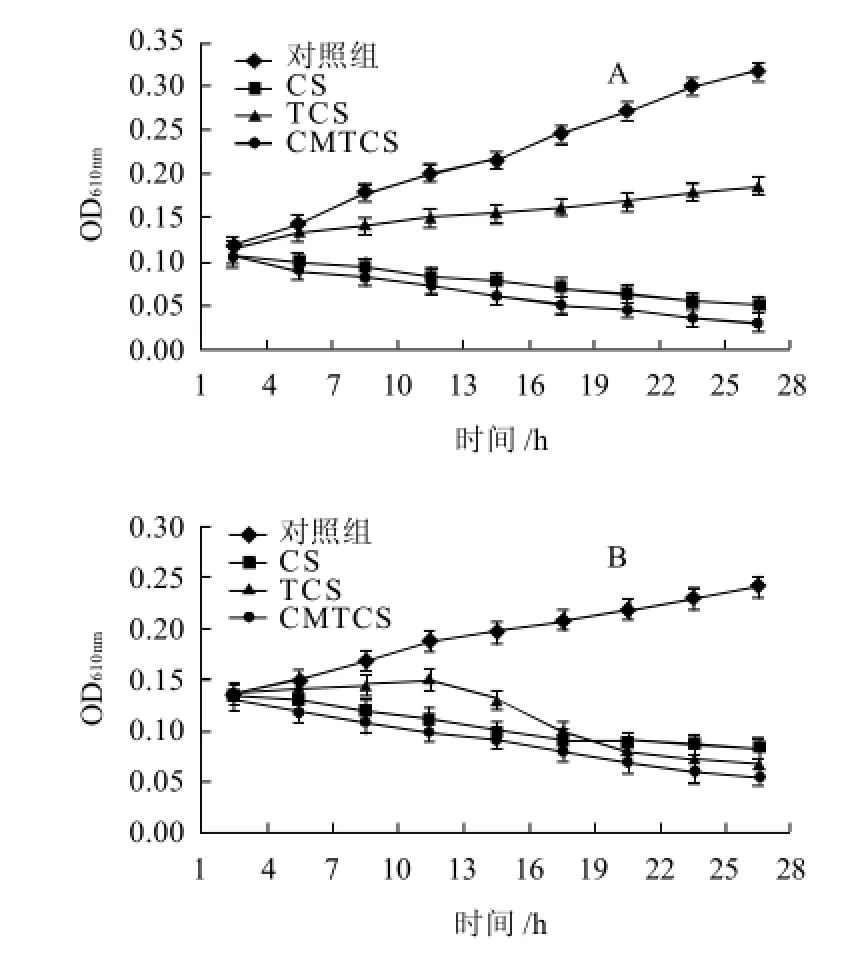
圖4 不同作用時間內殼聚糖及其衍生物E.coli(A)、St.aureus (B)的OD610nm值Fig.4 Growth inhibitory effects of CS, TCS and CMTCS on E.coli and St.aureus
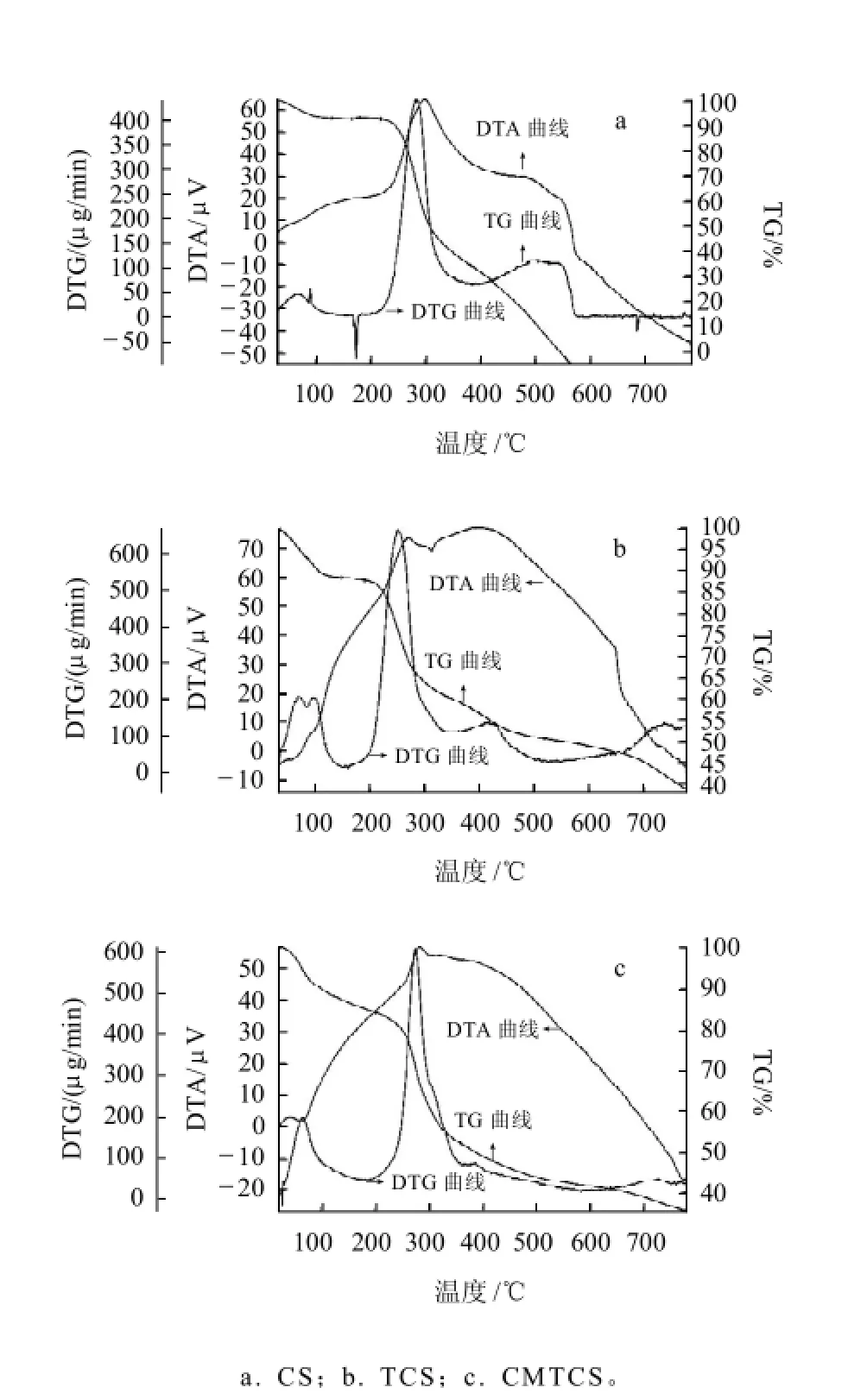
圖3 殼聚糖、硫脲殼聚糖和羧甲基硫脲殼聚糖的差熱-熱重分析Fig.3 TG-DTA-DTG analysis of CS, TCS and CMTCS
2.4 抑菌實驗結果
由圖4可知,殼聚糖、硫脲殼聚糖和羧甲基硫脲殼聚糖與大腸桿菌和金黃色葡萄球菌作用后,對應的OD610nm均小于對照組,表明殼聚糖、硫脲殼聚糖和羧甲基硫脲殼聚糖均具有較好的抑菌性能,并且羧甲基硫脲殼聚糖的抑菌活性最強,其次為殼聚糖,硫脲殼聚糖抑菌活性最弱。
一般認為殼聚糖的抑菌活性與其胺基含量有關[12]。硫脲改性的殼聚糖抑菌活性較殼聚糖大大降低,是由于硫脲殼聚糖中-NH2上引入了硫脲基團,減少了殼聚糖自身自由胺基的含量,同時也說明了殼聚糖對大腸桿菌和金黃色葡萄球菌的抑制作用主要與-NH2的質子化有關。但是硫脲殼聚糖仍然具有抑菌活性,并且發現隨著時間的延長,對金黃色葡萄球菌的抑菌活性較殼聚糖稍有增強,這可能是硫脲殼聚糖中存在-C=S,容易螯合細菌細胞膜表面的Ca2+和Mg2+,紊亂了細菌細胞正常的生理功能而引起的。在羧甲基硫脲殼聚糖中,NH2上引入了硫脲的同時,在C6位上亦引入了親水性的羧甲基基團,一方面增加了其在水中的溶解性,另一方面,增加了和細菌表面接觸的可能性程度,故對大腸桿菌和金黃色葡萄球菌的抑制作用均強于殼聚糖和硫脲殼聚糖。
由圖5可知,當羧甲基硫脲殼聚糖的質量濃度為0.20mg/mL時,培養基中不再有細菌生長,說明羧甲基硫脲殼聚糖對大腸桿菌和金黃色葡萄球菌的MIC均為0.20mg/mL。而殼聚糖對大腸桿菌和金黃色葡萄球菌的MIC均為0.5mg/mL[13]。所以,與殼聚糖相比,羧甲基硫脲殼聚糖對大腸桿菌和金黃色葡萄球菌的MIC均所降低,該結果亦表明:羧甲基硫脲殼聚糖對大腸桿菌和金黃色葡萄球菌的抑菌活性較殼聚糖本身增強。

圖5 羧甲基硫脲殼聚糖對E.coli (a)和St.aureus (b)生長的影響Fig.5 Effect of CMTCS on the growth of E.coli and St.aureus
3 結 論
硫脲殼聚糖中羥基發生了羧甲基化反應,與殼聚糖相比熱穩定性降低。羧甲基硫脲殼聚糖對大腸桿菌、金黃色葡萄球菌的抑菌活性較殼聚糖增強,且對兩種細菌的最小抑菌質量濃度均0.20mg/mL。
[1]CHUNG Y C, CHEN C Y. Antibacterial characteristics and activity of acid-soluble chitosan[J]. Bioresource Technol, 2008, 99: 2806-2814.
[2]JE J Y, KIM S K. Chitosan derivatives killed bacteria by disrupting the outer and inner membrane[J]. Journal of Agricultural and Food Chemistry, 2006, 54(18): 6629-6633.
[3]SEBTI I, MARTIAL-GROS A, CARNET-PANTIEZ A, et al. Chitosan polyer as bioactive coating and film against Aspergillus niger contamination[J]. Journal of Food Science, 2005, 70(2): 100-104.
[4]KIM C H, KIM S Y, CHOI K S. Synthesis and antibacterial activity of water-soluble chitin derivatives[J]. Polymers of Advanced Technologies, 1997, 8: 319-325.
[5]彭時軍, 趙紀強. 硫脲乙酸殼聚糖(C6)的合成[J]. 安徽化工, 2006(1): 35-36.
[6]趙愛杰, 原繼波, 常津. O-羧甲基化殼聚糖的制備及應用研究進展[J]. 高分子通報, 2004(4): 59-63.
[7]CHEN Shuiping, WU Guozhong, ZENG Hongyan. Prepration of high antimicrobial activity thiourea chitosan-Ag+complex[J]. Carbohydrate Polymers, 2005, 60: 33-38.
[8]陳凌云, 杜予民, 肖玲, 等. 羧甲基殼聚糖的取代度及保濕性[J]. 應用化學, 2001, 18(1): 5-8.
[9]PADHYE S B, KAUFFMANN G B. Transition metal complexes of semicarbazones and thiosemicarbazones[J]. Coordination Chemical Review, 1985, 63: 127-135.
[10]蔣挺大. 殼聚糖[M]. 北京: 化學工業出版社, 2003: 17-18.
[11]TOIDA T, CHAIDEDGUMJORN A, LINHARDT R J. Structure and bioactivity of sulfated polysaccharides[J]. Trends in Glycoscience and Glycotechnology, 2003, 15: 29-46.
[12]王鴻, 沈月新. 不同脫乙酰度殼聚糖的抑菌性[J]. 上海水產大學學報, 2001, 10(4): 380-382.
[13]馮小強, 李小芳, 楊聲, 等. 殼聚糖對細菌細胞膜及膜蛋白的作用[J].食品科學, 2009, 30(13): 84-88.
Structural Characterization and Antibacterial Activity of Carboxymethyl Thiourea Chitosan
LI Xiao-fang1,MA Jin-man2,FENG Xiao-qiang1,WANG Ting-pu1,YANG Sheng1,ZHANG Hong-juan1,KONG Xu-e1
(1. College of Life Science and Chemistry, Tianshui Normal University, Tianshui 741001, China;2. No. 1 Middle School of Gangu, Gangu 741200, China)
Carboxymethyl thiourea chitosan (CMTCS) was prepared and characterized by infrared spectrometry (FT-IR), ultraviolet spectrometry (UV) and differential thermal and thermogravimetry analysis (TG-DTA) methods. The antibacterial activity of CMTCS against E.coli and St.aureus were investigated in vitro. The results showed that the antibacterial activity of CMTCS was obviously higher than that of chitosan with an MIC of 0.20 mg/mL against both E.coli and St.aureus.
chitosan;carboxymethyl thiourea chitosan;characterization;antibacterial activity
TQ929.2
A
1002-6630(2012)01-0064-04
2011-01-05
天水師院物理無機化學重點學科基金項目(ZD0840);天水師院“青藍”人才工程和中青年教師科研資助項目(TSA1003)
李小芳(1983—),女,助教,碩士,主要從事天然高分子生物活性研究。E-mail:lixiaofang1982@lzu.cn

