重組枯草芽孢桿菌豬尿酸氧化酶基因工程菌的構(gòu)建和分泌表達(dá)
李輝,陳思,馬嬌穎,戴君,謝光蓉,陳建華
·論著·
重組枯草芽孢桿菌豬尿酸氧化酶基因工程菌的構(gòu)建和分泌表達(dá)
李輝,陳思,馬嬌穎,戴君,謝光蓉,陳建華
目的構(gòu)建重組枯草芽孢桿菌豬尿酸氧化酶基因工程菌及其目的蛋白的分泌表達(dá),并對其酶活性進行測定。
芽孢桿菌,枯草; 尿酸氧化酶; 高尿酸血癥; 分泌表達(dá)
www.cmbp.net.cn 中國醫(yī)藥生物技術(shù), 2012, 7(3):187-190
尿酸氧化酶又稱尿酸酶(urate oxidase; uricase,EC 1.7.3.3,UOX),是生物體內(nèi)嘌呤降解代謝途徑中的關(guān)鍵酶,它以分子氧為受體催化尿酸分解生成溶解度高的尿囊素、CO2和 H2O2[1-2]。許多物種體內(nèi)均發(fā)現(xiàn)有尿酸氧化酶,但在鳥類及一些高等靈長類動物(如猿和人類)的體內(nèi)卻缺乏具有功能的尿酸酶,而是以尿酸作為嘌呤代謝的終產(chǎn)物[3-4]。尿酸及其鹽類在水中溶解度很低,血液中積累過多會導(dǎo)致高尿酸血癥,尿酸在患者體內(nèi)軟組織、關(guān)節(jié)、器官等處形成結(jié)晶而沉積,從而導(dǎo)致痛風(fēng)等臨床癥狀。
目前使用的降低體內(nèi)尿酸水平的藥物主要分為三類:促進尿酸排泄藥、抑制尿酸合成藥和尿酸氧化酶[5]。有研究表明,尿酸氧化酶降低體內(nèi)尿酸水平的幅度和速度遠(yuǎn)遠(yuǎn)優(yōu)于其他藥物[6]。隨著基因工程技術(shù)的發(fā)展,工程菌表達(dá)尿酸酶能顯著提高酶的產(chǎn)量,現(xiàn)在已有多種生物來源的重組尿酸酶得到表達(dá)[5, 7]。2010 年 9月,美國 FDA 批準(zhǔn)了一種PEG 修飾的豬尿酸酶—— Krystexxa(pegloticase)的上市[8]。但是目前豬尿酸酶主要在大腸桿菌中表達(dá),易于形成包涵體,且在提取時需要破壁、變性、復(fù)性等操作,降低了收率,增加了成本,使其工業(yè)化潛力及其他更為廣泛的研究應(yīng)用受到了一定的限制。因此,本實驗通過將豬尿酸氧化酶基因與nprB 信號肽基因相連,導(dǎo)入穿梭載體 pP43X,在P43 啟動子的調(diào)控下,首次實現(xiàn)了重組枯草芽孢桿菌豬尿酸氧化酶基因工程菌的高效分泌表達(dá)[9]。枯草芽孢桿菌是目前公認(rèn)較為安全的宿主菌之一,且具有良好的合成分泌蛋白的能力。因此,重組枯草芽孢桿菌豬尿酸氧化酶基因工程菌的構(gòu)建不僅簡化了豬尿酸酶的分離提取步驟,同時具有潛在的市場前景和社會效益。
1 材料與方法
1.1 材料
1.1.1菌株和質(zhì)粒 大腸桿菌 DH5α,枯草芽孢桿菌 WB800,重組質(zhì)粒 pET-22b/pUOX,穿梭載體 pP43X、pP43NMK 均為本實驗室保存。
1.1.2試劑 引物由上海英濰捷基生物有限公司合成。限制性內(nèi)切酶 Xba I、Pst I 與 T4 DNA 連接酶購自加拿大 Fermentas 公司;DNA 凝膠回收試劑盒、重組 Taq DNA 聚合酶、低分子量標(biāo)準(zhǔn)蛋白質(zhì)購自寶生物工程(大連)有限公司;培養(yǎng)基成分購自英國 Oxoid 公司;其余均為分析純試劑。
1.2 方法
1.2.1pUOX 基因的獲取 從重組豬尿酸酶工程菌 pET-22b/pUOX 中抽提重組質(zhì)粒 pET-22b/ pUOX,根據(jù) Gene-Bank 公布的豬尿酸氧化酶基因序列合成引物,下游引物 5′ 端設(shè)計 Xba I 的酶切位點。
以 pET-22b/pUOX 重組質(zhì)粒為模板,PCR 擴增獲得 pUOX 基因。反應(yīng)條件為:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,共 25 個循環(huán);72 ℃ 延伸 7 min,4 ℃ 保存。
1.2.2nprB 信號肽基因與 pUOX 基因相連 根據(jù) nprB 信號肽(signial peptide,SP)基因序列合成引物,上游引物 5′ 端設(shè)計PstI 的酶切位點。
PCR 擴增獲得 nprB 信號肽基因后,分別將SP 基因與 pUOX 基因用凝膠回收試劑盒進行回收。
分別以回收純化后的 SP 基因與 pUOX 基因為模板,通過重疊延伸 PCR 使之相連。反應(yīng)條件為:無引物 PCR,94 ℃ 5 min;94 ℃ 30 s,55 ℃30 s,72 ℃ 1 min,共 5 個循環(huán);72 ℃ 延伸 7 min。反應(yīng)完成后,加入兩端引物,94 ℃ 5 min;94 ℃30 s,65 ℃ 30 s,72 ℃ 1 min,共 25 個循環(huán);72 ℃延伸 7 min,4 ℃ 保存,并回收純化。
1.2.3重組表達(dá)載體 pP43X/pUOX 的構(gòu)建 將純化好的目的基因擴增產(chǎn)物 SP/pUOX,用PstI 和XbaI 進行雙酶切,同樣的方法處理穿梭載體pP43X,再分別凝膠回收純化。將雙酶切后的載體與 PCR 回收產(chǎn)物按一定比例于 16 ℃ 過夜連接,重組質(zhì)粒 pP43X/pUOX 轉(zhuǎn)化到大腸桿菌 DH5α感受態(tài)中,并送上海英駿生物技術(shù)有限公司進行測序。將重組工程菌 37 ℃ 培養(yǎng) 12 h 后抽提質(zhì)粒,并將重組質(zhì)粒通過化學(xué)轉(zhuǎn)化法轉(zhuǎn)化蛋白酶缺陷型枯草芽孢桿菌 WB800[10],經(jīng)過含卡那霉素的抗性平板篩選獲得陽性克隆。
1.2.4重組枯草芽孢桿菌 pP43X/pUOX 工程菌的分泌表達(dá) 挑取重組工程菌單菌落至 30 ml LB液體培養(yǎng)基中,37 ℃ 振蕩培養(yǎng) 10 h 后,2% 接種至發(fā)酵培養(yǎng)基中,在轉(zhuǎn)接 12、18、24、30 h 后分別取樣收集發(fā)酵菌液,5600 ×g離心取上清液,同時以空白宿主枯草芽孢桿菌 WB800 作對照。12% SDS-PAGE 電泳分析,電泳結(jié)束后用考馬斯亮藍(lán)R-250 染色 2 h,脫色液脫色 2 ~ 3 h 后觀察結(jié)果。
1.2.5重組豬尿酸氧化酶活性的測定 將菌株接入 LB 液體培養(yǎng)基中,37 ℃ 搖瓶培養(yǎng) 10 h,轉(zhuǎn)接至發(fā)酵培養(yǎng)基中,分泌表達(dá) 24 h 后,離心取上清液并稀釋于硼酸-硼砂緩沖液(pH 8.4),即為粗酶液。
活性單位的定義和酶活的測定方法參照文獻[11]進行。
尿酸酶活力單位(U)定義為:在 37 ℃ 和 pH 8.4 條件下,每分鐘轉(zhuǎn)化 1 μmol 尿酸成尿囊素所需要的酶量。
2 結(jié)果
2.1 pUOX 基因與 SP 基因擴增產(chǎn)物的鑒定及重組質(zhì)粒的構(gòu)建過程
以 pET-22b/pUOX、pP43NMK 重組質(zhì)粒為模板,采用 PCR 方法分別獲得的產(chǎn)物經(jīng)瓊脂糖凝膠電泳后,分別在約 900 bp、100 bp 處有單一且清晰的 DNA條帶即為擴增的 pUOX 基因和 SP 基因(圖 1),采用重疊延伸 PCR 方法將兩基因片段連接后,經(jīng)瓊脂糖凝膠電泳后,在 1000 bp 處有單一且清晰的 DNA條帶,與理論大小 1008 bp 相符合(圖 2)。將目的基因與載體分別雙酶切后,通過 T4 DNA 連接酶相連完成重組質(zhì)粒的構(gòu)建。
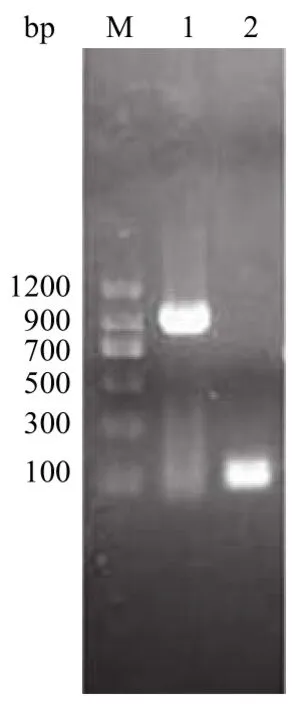
圖1 瓊脂糖凝膠電泳檢測 PCR 產(chǎn)物Figure 1 Agarose electrophoresis analysis of PCR product
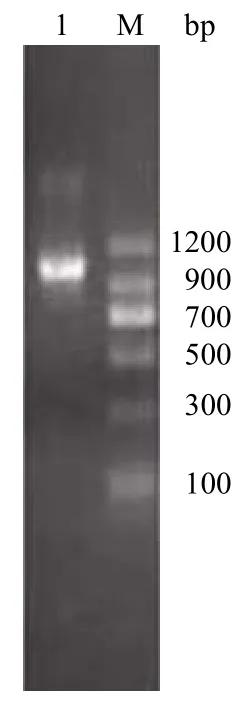
圖2 瓊脂糖凝膠電泳檢測重疊延伸 PCR 產(chǎn)物Figure 2 Agarose electrophoresis analysis of SOE-PCR product
2.2 重組豬尿酸氧化酶的分泌表達(dá)
對重組豬尿酸酶基因工程菌 pP43X/pUOX 發(fā)酵條件進行優(yōu)化,37 ℃ 下,在含尿酸的發(fā)酵培養(yǎng)基中誘導(dǎo)目的基因在枯草芽孢桿菌中的分泌表達(dá),同時以空白宿主的發(fā)酵表達(dá)作對照。結(jié)果表明,構(gòu)建的重組工程菌經(jīng)誘導(dǎo)后,發(fā)酵上清液在分子量為34 kD 處有一條明顯的蛋白表達(dá)條帶,而對照在同一位置無明顯條帶,這與豬尿酸酶基因序列推測的由 303 個氨基酸殘基組成的理論相對分子質(zhì)量34 kD相符,證明重組豬尿酸酶基因工程菌 pP43X/ pUOX 能夠分泌表達(dá)目的蛋白。電泳結(jié)果如圖 3所示。發(fā)酵上清中豬尿酸氧化酶活力為 2.322 U/ml。
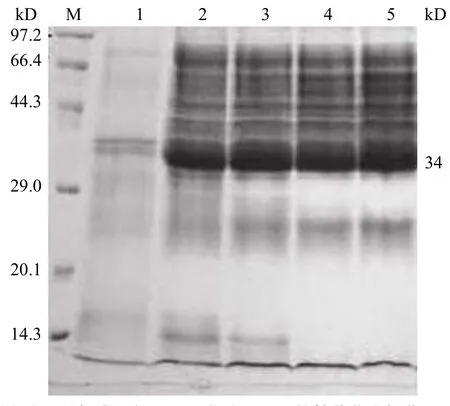
圖3 重組枯草芽孢桿菌豬尿酸氧化酶基因工程菌分泌表達(dá)目的蛋白的 SDS-PAGE 電泳圖譜Figure 3 Analysis of recombinant urate oxidase produced fromBacillus subtilisWB800 by SDS-PAGE
3 討論
近年來,隨著人類生活水平的不斷提高,痛風(fēng)和高尿酸血癥的發(fā)病率呈持續(xù)上升趨勢,曾經(jīng)被稱之為“王之病,病之王”的痛風(fēng),再也不是上流社會專屬的“富貴病”,而是進入了尋常百姓家[12],成為了危害人類健康的最為常見的疾病之一。此外,在腫瘤化學(xué)治療過程中,出現(xiàn)腫瘤溶解綜合征(tumor lysis syndrome,TLS)[13],引起新陳代謝紊亂。高尿酸血癥及并發(fā)癥最容易在 TLS 中出現(xiàn),即細(xì)胞大量死亡引起血液中的尿酸濃度升高,導(dǎo)致急性腎功能衰竭。重組尿酸氧化酶已經(jīng)成為治療這種繼發(fā)引起的高尿酸血癥的有效藥物[14]。
從黃曲霉中直接提取的天然尿酸氧化酶 2001 年 6 月在德國和英國上市,2002 年 7 月 FDA 批準(zhǔn)在美國上市,用于治療和預(yù)防具有高危腫瘤溶解綜合征的血液惡性腫瘤患者的急性高尿酸血癥[15]。但重復(fù)使用該酶易誘導(dǎo)產(chǎn)生抗體而降低療效,而且易過敏,僅適于短期使用。因此,與人同源性較高的豬尿酸酶正受到越來越多的關(guān)注。
本研究通過 PCR 方法獲得豬尿酸酶基因與nprB 基因擴增產(chǎn)物,并且運用重疊延伸 PCR 的方法使之相連接,選取本實驗室構(gòu)建的高效穿梭載體pP43X,采用化學(xué)轉(zhuǎn)化法轉(zhuǎn)化枯草芽孢桿菌蛋白酶缺欠型菌株 WB800 中,實現(xiàn)了重組豬尿酸酶的胞外分泌表達(dá),且酶活與大腸桿菌中表達(dá)的重組豬尿酸酶相比略有提高[16],并未受到枯草芽孢桿菌中蛋白水解酶的影響而導(dǎo)致重組蛋白末端氨基酸降解引起重組蛋白末端不齊降低活性,因此本研究為重組豬尿酸酶的制備提供了一條更為有效、簡捷的途徑。
[1] Hayashi S, Fujiwara S, Noguchi T. Degradation of uric acid in fish liver peroxisomes. Intraperoxisomal localization of hepatic allantoicase and purification of its peroxisomal membrane-bound form. J Biol Chem, 1989, 264(6):3211-3215.
[2] Alamillo JM, Cárdenas J, Pineda M. Purification and molecular properties of urate oxidase from Chlamydomonas reinhardtii. Biochim Biophys Acta, 1991, 1076(2):203-208.
[3] Terkeltaub R. Update on gout: new therapeutic strategies and options. Nat Rev Rheumatol, 2010, 6(1):30-38.
[4] Oda M, Satta Y, Takenaka O, et al. Loss of urate oxidase activity in hominoids and its evolutionary implications. Mol Biol Evol, 2002, 19(5):640-653.
[5] Li J, Chen Z, Hou L, et al. High-level expression, purification, and characterization of non-tagged Aspergillus flavus urate oxidase in Escherichia coli. Protein Expr Purif, 2006, 49(1):55-59.
[6] Bardin T. Current management of gout in patients unresponsive or allergic to allopurinol. Joint Bone Spine, 2004, 71(6):481-485.
[7] Chen Z, Wang Z, He X, et al. Uricase production by a recombinant Hansenula polymorpha strain harboring Candida utilis uricase gene. Appl Microbiol Biotechnol, 2008, 79(4):545-554.
[8] FDA approves new drug for gout. Mol Cell Pharmacol, 2010, 2(4): 169-171.
[9] Zhang XZ, Cui ZL, Hong Q, et al. High-level expression and secretion of methyl parathion hydrolase in Bacillus subtilis WB800. Appl Envir Microbiol, 2005, 71(7):4101-4103.
[10] Wu SC, Yeung JC, Wong SL, et al. Functional production and characterization of a fibrin-specific single-chain antibody fragment from Bacillus subtilis: effects of molecular chap-erones and a wall-bound protease on antibody fragment production. Appl Environ Microbiol, 2002, 68(7):3261-3269.
[11] Friedman TB, Barker AP. Purification and partial characterization of urate oxidase from Drosophila Melanogaster. Insect Biochem, 1982, 5(12):563-570.
[12] Kamienski M. Gout: not just for the rich and famous! Everyman’s disease. Orthop Nurs, 2003, 22(1):16-20.
[13] Baeksgaard L, Sorensen JB. Acute tumor lysis syndrome in solid tumor--a case report and review of the literature. Cancer Chemother Pharmacol, 2003, 51(3):187-192.
[14] Campara M, Shord SS, Haaf CM. Single-dose rasburicase for tumor lysis syndrome in adults: weight-based approach. J Clin Pharm Ther, 2009, 34(2):207-213.
[15] Liu CY, Sims-McCallum RP, Schiffer CA. A single dose of rasburicase is sufficient for the treatment of hyperuricemia in patients receving chemotherapy. Leuk Res, 2005, 29(4):463-465.
[16] Xue J, Wang WY, Chen JH. Cloning and expression of porcine urate oxidase. J Anhui Agric Univ, 2011, 38(4):592-595. (in Chinese)薛璟, 汪維云, 陳建華. 豬尿酸氧化酶基因的克隆及表達(dá). 安徽農(nóng)業(yè)大學(xué)學(xué)報, 2011, 38(4):592-595.
Construction of recombinant Bacillus subtilis for secreted expression of the porcine urate oxidase
LI Hui, CHEN Si, MA Jiao-ying, DAI Jun, XIE Guang-rong, CHEN Jian-hua
ObjectiveConstruction of recombinant Bacillus subtilis for secreted expression of the porcine urate oxidase (pUOX).MethodspUOX-encoding gene pUOX was placed under the control of the P43 promoter and Bacillus subtilis signal peptide-encoding sequence. The pUOX was connected with a nprB signal peptide by SOE-PCR, then imported the shuttle vector pP43X. High-level expression and secretion of mature, authentic, and stable pUOX were achieved using the protease-deficient strain B. subtilis WB800 as the host.ResultsSDS-PAGE detected shows a clear protein band of about 34 kD, which is consistent with the expected molecular weight. Determination of enzyme activity of the recombinant protein is 2.322 U/ml.ConclusionsConstruction of recombinant Bacillus subtilis for secreted expression of the porcine urate oxidase is successful. Porcine urate oxisase can be expressed with a high activity.
Bacillus subtilis; Urate oxidase; Hyperuricemia; Secreted expression
CHEN Jian-hua, Email: jhchen@cpu.edu.cn
10.3969/cmba.j.issn.1673-713X.2012.03.005
國家自然科學(xué)基金(81072560)
210009 南京,中國藥科大學(xué)生命科學(xué)與技術(shù)學(xué)院
陳建華,Email:jhchen@cpu.edu.cn
2012-03-05
方法從 pET-22b/pUOX 重組質(zhì)粒上 PCR 獲得 pUOX基因,然后通過重疊延伸 PCR 技術(shù)將 pUOX 與一段 nprB信號肽基因相連,導(dǎo)入穿梭載體 pP43X,構(gòu)建重組載體pP43X/pUOX,運用化學(xué)轉(zhuǎn)化法轉(zhuǎn)化枯草芽孢桿菌 WB800中。
結(jié)果發(fā)酵表達(dá)后胞外分泌液經(jīng) SDS-PAGE 檢測,在約34 kD 處有一清晰蛋白條帶,這與預(yù)期分子量一致。發(fā)酵液中該重組蛋白的酶活力達(dá) 2.322 U/ml。
結(jié)論成功構(gòu)建重組枯草芽孢桿菌豬尿酸氧化酶基因工程菌,目的蛋白分泌表達(dá)并具有較高活性。
Author Affiliations:School of Life Science and Technology, China Pharmaceutical University, Nanjing 210009, China.
www.cmbp.net.cn Chin Med Biotechnol, 2012, 7(3):187-190
- 中國醫(yī)藥生物技術(shù)的其它文章
- 如何用SAS軟件正確分析生物醫(yī)學(xué)科研資料XVII.R×2列聯(lián)表與2×C列聯(lián)表資料的統(tǒng)計分析與SAS實現(xiàn)
- 以結(jié)核分枝桿菌H37Rv莽草酸脫氫酶為靶點的高通量篩選模型的建立及應(yīng)用
- 結(jié)核分枝桿菌鐵氧還蛋白還原酶FdrA 和FprA在CYP125A1的電子傳遞鏈中的作用分析
- 鼠疫F1蛋白原核分泌性表達(dá)及鑒定
- 《中國醫(yī)藥生物技術(shù)》雜志第二屆編輯委員會第一次工作會議紀(jì)要
- 諾卡菌屬菌株04-5195發(fā)酵產(chǎn)物5195B的分離鑒定及其體外抗骨質(zhì)疏松活性研究

