新生大鼠海馬神經元原代無血清培養與鑒定
黃立寧,韓建民,劉 雅,劉 悅,曹翠麗
(河北醫科大學1.第二醫院麻醉科;2.神經生物研究室,河北石家莊 050000)
新生大鼠海馬神經元原代無血清培養與鑒定
黃立寧1,韓建民1,劉 雅1,劉 悅1,曹翠麗2*
(河北醫科大學1.第二醫院麻醉科;2.神經生物研究室,河北石家莊 050000)
目的 建立一種簡單、易行的海馬神經元無血清體外培養方法以獲得高純度、高活力的海馬神經元。方法取新生24 h內SD大鼠,分離海馬,經消化后種植于包被有Matrigel基膜的玻片上,24 h后換含有N2、B27的Neurobasal無血清培養基,于不同時間在倒置相差顯微鏡下觀察細胞的生長狀態;采用β-tublinⅢ免疫熒光細胞化學技術鑒定海馬神經元純度。結果 大部分海馬神經元于3~24 h貼壁且可長出細長突起,3 d細胞具有典型神經元的形態特征,5d后神經元突起進一步增多并形成稠密的網絡連接,7 d后神經元胞體豐滿,趨于成熟。經β-tublinШ免疫熒光技術鑒定純度為94.2%±3.6%。結論 此方法簡單有效,可獲得高純度的海馬神經元。
海馬;神經元;原代培養;新生大鼠
對于眾多神經領域研究,諸如神經元發育分化、神經再生、神經疾病的發生機制,原代培養的神經元是一個很好的實驗模型,具有影響因素單一、機體干擾因素少和結果易分析等優點。所以,常用于細胞和分子水平上深入研究神經元物質代謝、生理、藥理及形態特征[1-2]。海馬屬于大腦的邊緣系統,在學習、記憶、情緒反應及神經系統疾病的病理生理變化等方面有重要作用,而且海馬組織是中樞神經系統內主要的神經干細胞聚集區,具有高度序化板層結構和神經元相對獨立分布的特點,境界相對清晰,便于取材,因此,海馬神經元體外培養模型被廣大基礎醫學和臨床醫學研究者當做理想的實驗模型。但在原代培養中海馬神經元的純度、活力及產量還存在一些急待解決的問題。本研究參考原有的培養方法并進行改進,獲得了一種簡單、易行的海馬神經元培養方法,為今后研究麻醉藥對海馬神經元毒性作用提供高純度的海馬神經元。
1 材料與方法
1.1 材料
1.1.1 實驗動物:新生24 h內清潔級SD大鼠,體質量4.8~6.5 g,雌雄不限,(河北醫科大學動物實驗中心提供,合格證號:1106088)。
1.1.2 主要試劑:DMEM培養基和胎牛血清(FBS)、B27、N2培養基添加劑(Gibco公司);Neurobasal培養基(Invitrogen公司);Accutase酶、Hoechst 33258(Sigma公司);小鼠抗大鼠β-tublinШ單克隆抗體(Millipore公司);FITC標記山羊抗鼠IgG(KPL公司);Matrigel基膜(BD公司);青鏈霉素(華北制藥集團)。
1.1.3 主要儀器:倒置相差顯微鏡、倒置熒光顯微鏡TE2000-S(Nikon公司),二氧化碳恒溫培養箱(Thermo公司)。
1.2 方法
1.2.1 培養板的預處理:24孔塑料培養板放入蓋玻片平鋪 Matrigel基膜(1∶30,DMEM 稀釋),放入培養箱,孵育1 h,接種細胞前吸出待用。
1.2.2 海馬神經元的分離、純化和培養:取新生24 h內SD大鼠經75%乙醇浸泡、消毒。剪開皮膚和顱骨,暴露兩側大腦半球,用彎鑷取出大腦并放入含預冷PBS液的培養皿中,培養皿置于冰床上,用眼科無齒尖鑷小心分開皮層,暴露并取出雙側海馬組織,冷PBS液反復沖洗,去除殘留血管和腦膜后用眼科虹膜剪將海馬組織剪成1 mm×1 mm×1 mm的小塊,將其移入離心管,以800 r/min 5 min離心棄上清,加入3倍于海馬組織體積的Accutase酶,放入培養箱消化10~20 min,其間震蕩數次,當消化液混濁、不含有明顯組織塊時,加入含10%FBS的DMEM液終止消化,經充分吹打,200目銅濾網過濾。收集過濾后的細胞以800 r/min 5 min離心,棄上清,加入含10%FBS的DMEM液,吹打成細胞懸液。轉至塑料培養瓶中,放入培養箱經差速貼壁1 h,收獲貼壁速度較膠質細胞慢的神經元,吹打后以0.4%臺盼藍染色計數活細胞并調整懸液的細胞密度,按1×106/mL的濃度將細胞種植在Matrigel基膜包被后的蓋玻片上,每片加150 μL細胞懸液,將接種好的24孔板置于含有去離子水的濕盒中,將其放入二氧化碳恒溫培養箱,24 h內全量換含有1%N2、2%B27的Neurobasal培養液,其后,每2天半量換液,并在倒置相差顯微鏡下觀察神經元生長情況。
1.3 大鼠海馬神經元的免疫熒光細胞化學鑒定
1.3.1 免疫熒光細胞化學:取出蓋玻片,4%多聚甲醛室溫固定15 min,0.3%Triton X-100透膜15~20 min,10%牛血清白蛋白(bovine serum albumin,BSA)37℃孵育30 min封閉非特異性結合位點,傾去血清加入2%BSA稀釋的小鼠抗大鼠β-tublinШ單克隆抗體(1∶200)4℃過夜,加入2%BSA稀釋的1∶50 FITC標記的羊抗小鼠IgG二抗、50 mg/L Hoechst 33258復染細胞核,濕盒內室溫避光孵育1 h,所有操作步驟前經1×PBS輕洗3遍,每次5 min,濾紙吸干蓋玻片多余液體。倒置熒光顯微鏡下觀察,同一視野用不同的激發光激發FITC和Hoechst33258分別攝取細胞和細胞核的熒光圖片,利用顯微鏡自帶NIS成像軟件將所得圖片進行組合。
1.3.2 大鼠海馬神經元純度的鑒定:以β-tublinШ單克隆抗體熒光染色顯示海馬神經元,用 Hoechst33258復染顯示所有細胞核。神經元純度計算方法:在高倍顯微鏡下隨機選取5個視野,計算出其中陽性細胞的個數,換算成百分比,重復5次,取其均值作為陽性神經元的純度。
2 結果
2.1 海馬神經元的形態觀察
在倒置相差顯微鏡下觀察,剛接種的細胞呈圓形,體積小、透亮呈懸浮狀態,單個均勻分布,培養3 h后開始貼壁,細胞接種20 h后可見大部分細胞已貼壁,但培養液內組織殘渣較多,換液去除殘渣。貼壁細胞形態多呈梭形、三角形,長出細長突起,長短不一。3 d后細胞具有典型神經元的形態特征,胞體飽滿,多呈梭形,少數呈不規則形,胞漿豐富,突起較前明顯增長、增粗,連接成網絡,仍可見少量扁平狀的神經膠質細胞。5 d后神經元胞體繼續增大,互相遷移靠近,開始形成集落樣神經元群落,突起已形成較稠密的神經纖維網絡。7~10 d神經元胞體最豐滿,周圍光暈明顯,突起交織成更加稠密的網絡,突起增粗增長且光暈明顯,立體感增強。14 d后細胞聚集現象明顯,培養板上出現明顯的細胞間空白區域。20 d后神經細胞開始退化,細胞邊緣光暈變淡,突起開始退縮,部分細胞核固縮明顯(圖1)。
2.2 海馬神經元純度鑒定
經β-tublinШ單克隆抗體和Hoechst33258在熒光倒置顯微鏡下鑒定(圖2),計算海馬神經元純度為94.2%±3.6%。
3 討論
海馬是神經元相對獨立分布并較為集中的組織,涉及學習、記憶及情緒反應等許多復雜生理功能,因此,海馬神經元的原代培養在基礎和臨床研究應用十分廣泛。但是,一直以來神經元在原代培養中都是死亡率較高的一類細胞,在海馬神經元的培養過程中,如何提高神經元的純度、貼壁率和活力一直困擾著廣大的研究者。
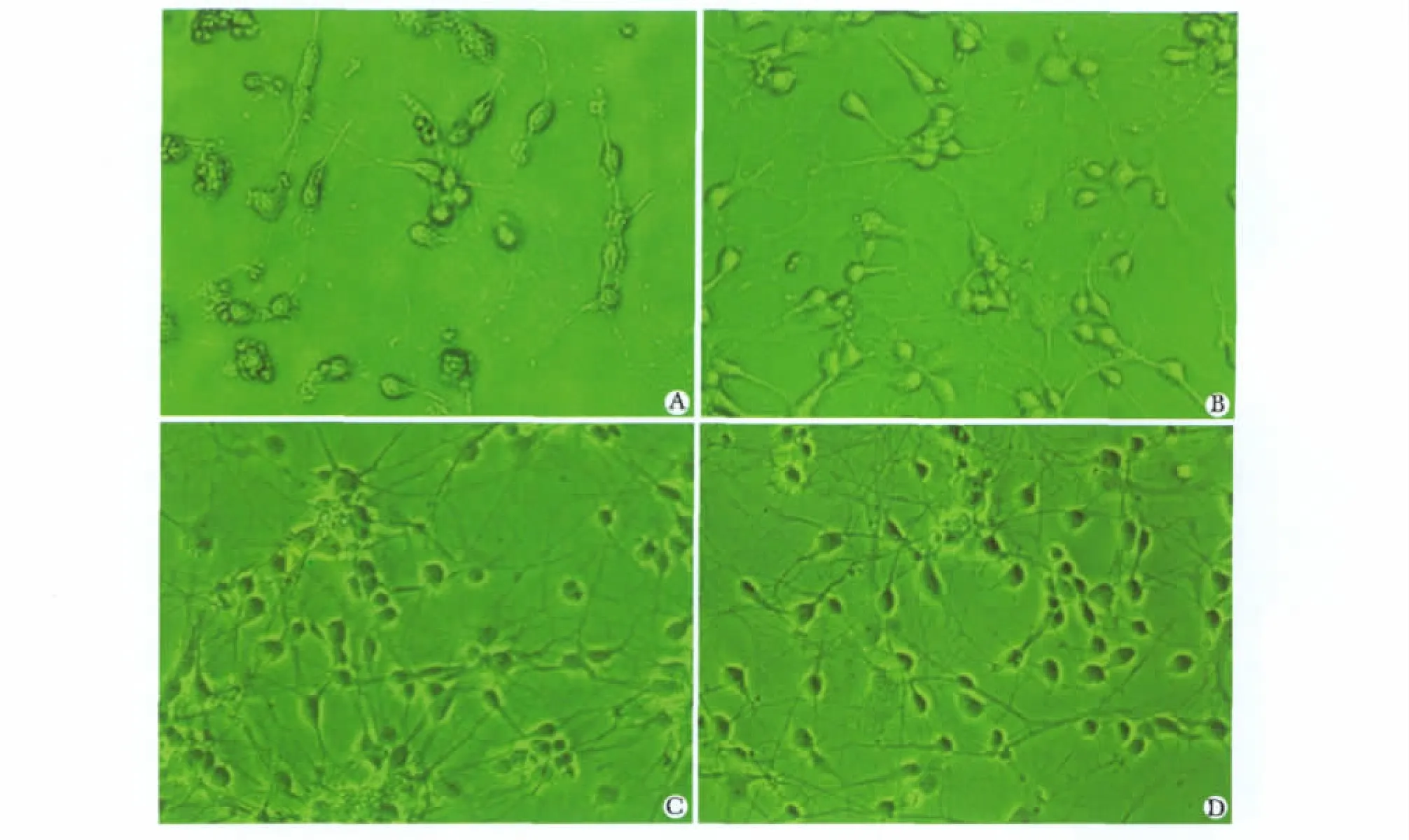
圖1 體外培養不同時間大鼠海馬神經元形態觀察Fig1 Hippocampal neurons derived from new-born rats cultured at different time(×200)
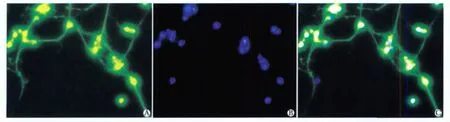
圖2 培養7 d的海馬神經細胞免疫熒光染色Fig 2 Immunofluorescence staining of hippocampal neurons on the 7th day
本實驗汲取過去部分研究者的經驗[3-5]并結合自身體會就海馬神經元原代培養過程中的經驗,現總結如下:1)實驗從取材到接種完畢的時間一定控制在2h內完成且取材過程在冰床上進行,以保持細胞的活力。2)在消化剪碎的組織時,存在較高濃度的胰蛋白酶對細胞表面損傷較大,消化時間不易掌握;而較低濃度的胰蛋白酶消化不徹底以致所得細胞數量少等問題,因此本實驗未使用傳統的胰蛋白酶而采用Accutase酶。Accutase酶具有膠原酶和蛋白酶活性,作用更溫和,消化時間要求相對寬松,對細胞表面損傷相對較小且消化較徹底,從而使細胞具有更高的活力。在人胚皮層神經干細胞培養中應用Accutase酶發現[6]比胰蛋白酶培養的同期細胞團直徑大,推測與Accutase酶作用溫和,對細胞特別是形成神經球必需的細胞黏附分子的損傷相對較小有關。3)在包被玻片時,未使用多聚賴氨酸,而使用Matrigel基膜,Matrigel是從小鼠肉瘤中抽提得到的可溶性的基底膜抽提物,此種肉瘤不僅富含細胞外基質蛋白,還含有TGF-β,FGF,tPA和其他生長因子。在室溫下,可聚合成一種具有生物活性的基質材料,其作用與哺乳動物細胞基底膜類似,有研究者成功地將Matrigel基膜用于人胚胎干細胞的培養[7],本研究嘗試性將Matrigel基膜取代傳統的多聚賴氨酸用于海馬神經元的原代培養,取得了良好的效果。4)在抑制膠質細胞過度增殖方面,本研究用差速貼壁和無血清培養相結合的方法,未使用阿糖胞苷,避免了因加入阿糖胞苷引起的神經元損傷。5)接種前充分混勻,接種時依靠表面張力將接種液在玻片上接種呈半圓形,此種方法即可以減少接種液用量又可使細胞至玻片的距離縮短,提高貼壁率。
用此方法培養可獲得高純度、高活力的海馬神經元,方法簡單無需特殊設備,在普通的細胞培養室即可完成。所培養的細胞能夠建立體外神經網絡,形成有效的突觸連接,為進一步研究奠定了基礎。
[1]Hsin S,Kim MG,Wang CF,et al.Proline-rich tyrosine kinase 2 regulates hippocampal long-term depression[J].J Neurosci,2010,30:11983 -11993.
[2]Lu H,Pang W,Hu YD,et al.Effects of intracellular zinc depletion on the expression of VDAC in cultured hippocampal neurons.[J].Nutr Neurosci,2011,14:80 -87.
[3]趙秀鶴,遲兆富,尚偉,等.新生人鼠海馬神經元的體外原代培養[J].基礎醫學與臨床,2007,27:329-332.
[4]周明,聶菁,呂誠,等.一種大鼠海馬神經元的原代培養方法[J].南昌大學學報:醫學版,2010,50:1-3.
[5]曾可斌,胡長林,陳陽美.大鼠海馬神經元培養與鑒定[J].基礎醫學與臨床,2004,24:514-577.
[6]任萍,關云謙,張愚.人胚皮層神經干細胞培養方法的探討[J].分子細胞生物學報,2007,40:79-83.
[7]李寧,朱寶長,朱宛宛,等.慢病毒介導綠色熒光蛋白轉染人胚胎干細胞及其培養[J].基礎醫學與臨床,2008,28:1083-1087.
Serum-free primary culture and identification of hippocampal neurons from newborn rats
HUANG Li-ning1,HAN Jian-min1,LIU Ya1,LIU Yue1,CAO Cui-li2*
(1.Dept.of Anaesthesiology,the Second Hospital;2.Dept.of Neurobiology,Hebei Medical University,Shijiazhuang 050017,China)
ObjectiveTo establish a simple and practical method of the serum-free primary culture of hippocampal neuronsin vitroto obtain highly purified and energetic neurons.MethodsHippocampi of newborn rats after birth in 24 hours were taken out and digested.Hippocampal neurons were planted on the glass slides covered with Matrigel basement membrane.Twenty-four hours after the cell being plated,the culture medium was removed and replaced by serum-free neurobasal one with N2 and B27 supplementations.The morphological changes of the neurons were observed under inverted phase-contrast microscope at different time.Immunofluorescence staining for β-tublinⅢ was performed to identify the purity of neurons.ResultsA large number of hippocampal neurons began to adhere to the glass slides and develop small neurites in 3~24 hours.Then,cells with typical neuron morphology appeared on the third day.Up to the 5th day,many neurites extended to form dense network.Soma of neurons became well developed on the 7th day.Fluorescence staining with β-tublinⅢ showed that the purity of neurons was 94.2% ±3.6%.ConclusionsThe present protocol is a simple and efficient method for culturing hippocampal neurons with high purity.
hippocampus;neurons;primary culture;newborn rats
R-331
A
1001-6325(2012)01-0083-04
2011-05-20
2011-07-18
河北省2011年醫學科學研究重點課題計劃(20110338)*< class="emphasis_bold">通信作者(corresponding author):
(corresponding author):caocuili615@163.com

