葡萄潰瘍病菌原生質體的制備與再生條件的優化
張 瑋, 燕繼曄, 郭 霞, 李興紅
(北京市農林科學院植物保護環境保護研究所,北京 100097)
葡萄潰瘍病菌原生質體的制備與再生條件的優化
張 瑋, 燕繼曄, 郭 霞, 李興紅*
(北京市農林科學院植物保護環境保護研究所,北京 100097)
對葡萄潰瘍病菌菌絲搖培時間、酶解時間、滲透壓穩定劑種類及再生培養基類型進行了探索和優化,建立了葡萄潰瘍病菌穩定、高效的原生質體制備體系。以SR培養基作為再生培養基時,原生質體再生率達到最高,為32.2%。該研究為建立葡萄潰瘍病菌高效、穩定的遺傳轉化體系,開展其致病機理的研究奠定了基礎。`
葡萄潰瘍病菌; 原生質體; 制備與再生條件
葡萄座腔菌科真菌葡萄潰瘍病菌(Botryosphaeriaspp.)可侵染葡萄果實、枝干等部位,其所引起的葡萄潰瘍病可造成葡萄果梗干枯、果實干縮或掉粒、枝干潰瘍、樹勢減弱等癥狀,嚴重時會導致植株整株死亡。截至目前,已發現葡萄座腔菌科的15種真菌能引起葡萄潰瘍病,在美國、墨西哥、法國、意大利、南非、智利等14個國家的葡萄產區均已發生,并造成了不同程度的損失。2009年,李興紅等在我國浙江省首次發現并報道了由病原菌Botryosphaeria dothidea引起的葡萄潰瘍病[1],同年,燕繼曄和李興紅在湖南、湖北和浙江田間發現并鑒定了引起該病害的另一新種B.rhodina[2]。隨后,李興紅課題組又于2010年在山東省和河北省等地分離了葡萄潰瘍病的另一種病原菌B.obtusa[3]。目前,該病害嚴重影響了葡萄的食用價值和經濟效益,成為阻礙葡萄產業健康、良性發展的重要威脅之一。
生產上對葡萄潰瘍病目前尚無有效的防治方法,對該病原菌的研究主要集中在生物學性狀方面,致病機理研究較少,因此,為了有效地防治該病害,需對其進行分子遺傳學和分子生物學方面的相關研究,鑒定一系列控制該病原菌致病性或致病力的基因,進一步鑒定、研究基因的功能,從而對該病原菌致病機理有較為深入的了解。建立絲狀真菌高效遺傳轉化體系的方法通常有兩種,一種是PEG(polyethylene glycol聚乙二醇)介導的原生質體轉化,另外一種是通過農桿菌介導的轉化(Agrobacteriumtumefaciens-mediated transformation,ATMT)[4-8]。PEG介導的原生質體轉化是最常用的絲狀真菌轉化方法,其關鍵技術就是制備大量的、可再生的原生質體[9]。目前,尚無關于葡萄潰瘍病菌(Botryosphaeriaspp.)原生質體制備和再生的相關報道。本研究首次優化了葡萄潰瘍病菌原生質體制備及再生條件,建立了適宜該病原菌的原生質體制備及再生體系,將為下一步建立該病原菌的高效遺傳轉化體系奠定基礎。
1 材料與方法
1.1 試驗材料
1.1.1 菌株
葡萄潰瘍病菌[Botryosphaeriarhodina(Berk.et Curt.)Arx]菌株JZB310113由本實驗室分離,純化并單孢分離保存于PDA斜面。
1.1.2 試劑
酸水解干酪素(casein acids hydrolysate)、酶水解干酪素(casein enzymatic hydrolysate)、崩潰酶(driselase)、蝸牛酶(snailase)購自美國Sigma公司;山梨醇(sorbitol)購自美國Amresco公司;酵母提取物(yeast extract)購自英國OXOID公司;瓊脂粉購自TaKaRa公司;NaCl、KCl、蔗糖等其他常規生化試劑均購自北京化學試劑公司。
1.1.3 培養基
PDA培養基:馬鈴薯200g煮沸20~30min后,4層紗布過濾;2%葡萄糖;1.8%瓊脂粉;加水定容至1 000mL。CM液體培養基:0.6%酵母粉;0.3%酸水解干酪素;0.3%酶水解干酪素;1%蔗糖。STC:1.2mol/L 山梨醇,10mmol/L Tris-Cl(pH 8.0),50mmol/L CaCl2。SR 固 體 再生 培 養基:0.1%酵母提取物;0.1%酶水解干酪素;1mol/L蔗糖;0.7%瓊脂粉。
1.2 試驗方法
1.2.1 原生質體的制備
原生質體產量計算方法:以1g菌絲裂解產生的原生質體個數定義為原生質體產量。用3層擦鏡紙過濾收集原生質體,4℃2 000g離心15min,棄上清,5mL STC溶液重懸沉淀,4℃2 000g離心15min,棄上清后將沉淀溶于1mL STC溶液中,利用血球計數板計算原生質體產量。
(1)菌絲搖培時間對原生質體產量的影響
將葡萄潰瘍病菌JZB310113菌株接種于PDA培養基上,28℃培養36h,在菌落表面滴加2~3mL的無菌水,用涂菌環將菌絲打斷,接種到裝有150mL液體CM培養基的500mL三角瓶中,28℃120r/min振蕩培養20~32h,每隔4h收集菌絲進行酶解,收集原生質體,鏡檢統計原生質體產量。
(2)酶解時間對原生質體產量的影響
用滅菌的3層擦鏡紙過濾收集菌絲,收集到的菌絲用滲透壓穩定劑沖洗后轉入50mL離心管中,按每克菌絲2mL酶液(崩潰酶和蝸牛酶的濃度均為20mg/mL)的比例加入細胞壁酶溶液,28℃120r/min恒溫振蕩2~6h,每小時鏡檢并計算原生質體產量。
(3)滲透壓穩定劑種類及濃度對原生質體產量的影響
在相同的酶解時間條件下,分別以0.7mol/L的KCl、NaCl、山梨醇、蔗糖4種溶液作為滲透壓穩定劑洗滌酶解產物,計算葡萄潰瘍病菌原生質體產量。確定適合的滲透壓穩定劑。
1.2.2 原生質體再生
(1)培養基種類對原生質體再生的影響
制備的原生質體用滲透壓穩定劑稀釋至1×104個/mL,各取0.1mL分別涂布在SR和PDA兩種再生培養基平板上,28℃培養1~3d至平板表面長出小菌落為止。同時,取0.1mL原生質體溶液,加入1mL無菌水,室溫靜置裂解30min后涂布到再生培養基平板作為對照,重復3次。計算原生質體在上述兩種培養基上的再生率。
原生質體再生率(%)=
[(原生質體再生的小菌落數量-對照小菌落數量)
/原生質體數量]×100;
(2)酶解時間對原生質體再生的影響
比較在不同酶解時間條件下,原生質體在SR固體再生培養基上的再生率,確定適合葡萄潰瘍病菌原生質體再生的最適酶解時間。
2 結果與分析
2.1 原生質體的制備
2.1.1 菌絲搖培時間對原生質體產量的影響
結果表明,搖培時間為24h時,原生質體的產量最大,達到6.217×108個/mL(如圖1所示)。搖培24h的JZB310113菌株,生長旺盛,菌絲量比較多,且容易酶解,適合原生質體的大量制備。搖培時間過短,產生的新菌絲量不足;搖培時間過長,菌絲體老化,細胞壁纖維素含量過高,不容易被崩潰酶崩潰,因此原生質體的產量有所下降。
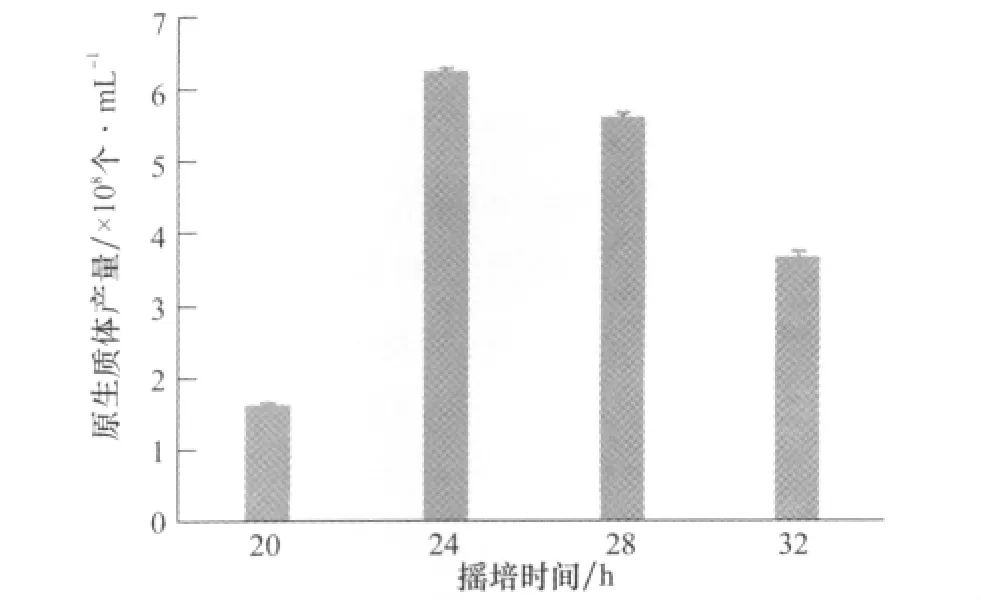
圖1 菌絲搖培時間對原生質體產量的影響
2.1.2 酶解時間對原生質體產量的影響
結果如圖2,酶解開始后隨著時間的積累,原生質體的產量增加,當酶解時間為4h時,原生質體產量達到最大,為5.008×108個/mL,隨著酶解時間的繼續延長,原生質體的產量有所下降,可能是由于酶解時間過長,細胞壁酶對細胞膜系統的破壞造成的[10-11]。
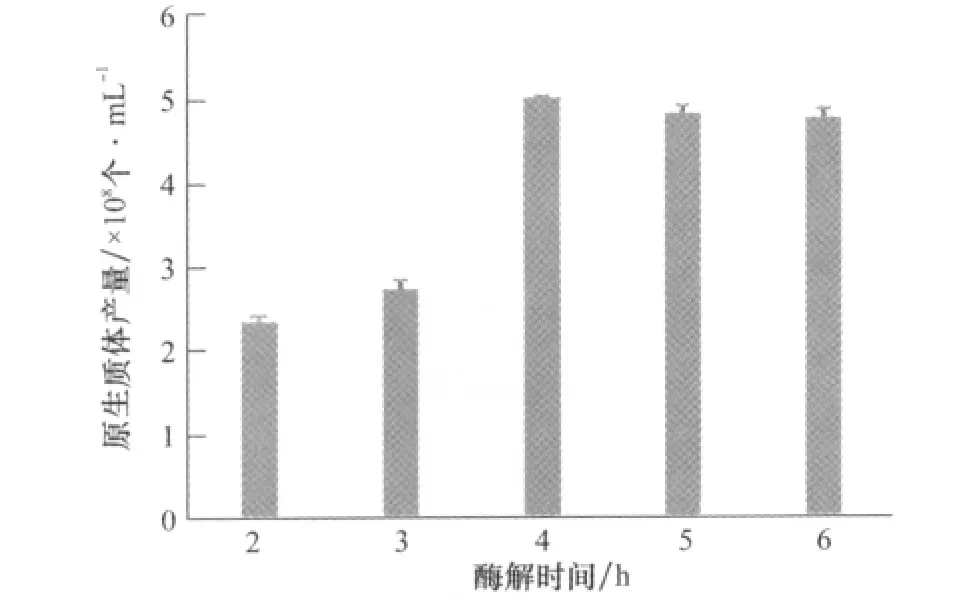
圖2 酶解時間對原生質體產量的影響
2.1.3 滲透壓穩定劑種類對原生質體產量的影響
滲透壓穩定劑是原生質體穩定形成的重要因素之一,能夠維持原生質體內外滲透壓平衡,防止原生質體破裂,從而影響原生質體產生的數量和質量[12]。本研究選用4種不同的滲透壓穩定劑進行原生質體制備試驗。結果表明,采用NaCl作為滲透壓穩定劑,得到的原生質體量最大,達到8.008×108個/mL(如圖3)。
2.1.4 滲透壓穩定劑濃度對原生質體產量的影響
滲透壓穩定劑的工作濃度是原生質體形成穩定的另一重要因素,影響原生質體產生的數量和質量。試驗比較了不同濃度NaCl對原生質體產量的影響。結果如圖4,以0.7mol/L NaCl作為滲透壓穩定劑,可以獲得大量的適于轉化的原生質體。這可能是因為0.7mol/L NaCl可以與葡萄潰瘍病菌細胞液形成等滲溶液,在內外壓力一致的情況下,菌絲保持其生理狀態的穩定,原生質體可以順利而完整地釋放出來[13-14]。
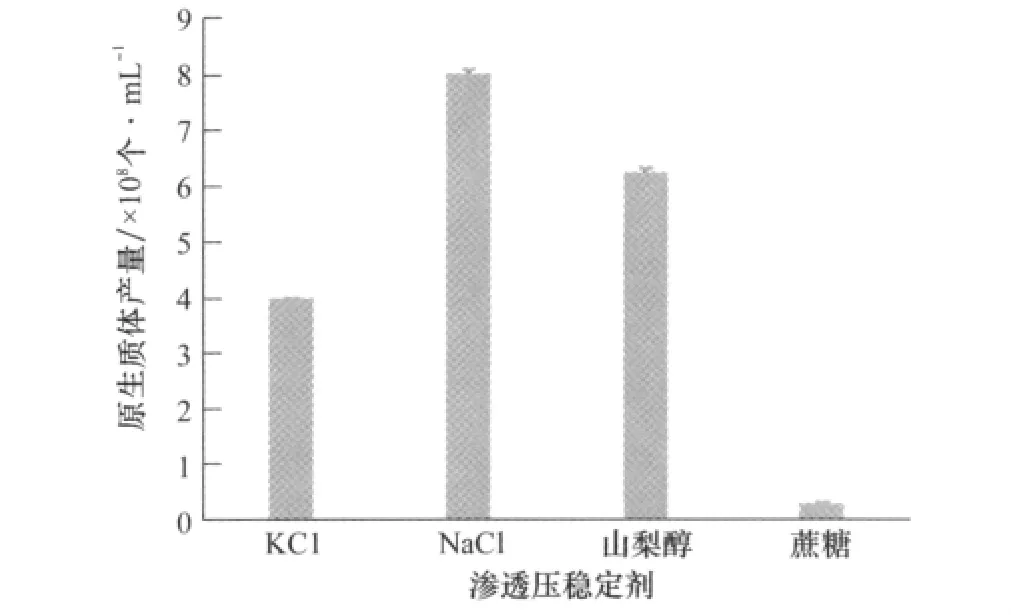
圖3 滲透壓穩定劑對原生質體產量的影響
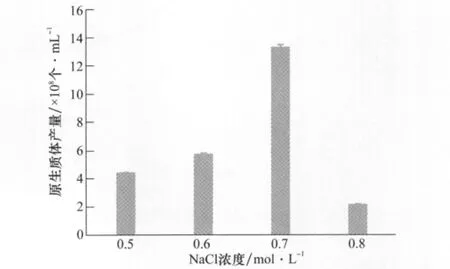
圖4 NaCl濃度對原生質體產量的影響
2.2 原生質體的再生
收集原生質體,用STC洗滌后,顯微鏡下觀察,可以看到呈圓球形的原生質體,大小不一,直徑為4.97~19.49μm,平均大小為13.25μm(圖5)。
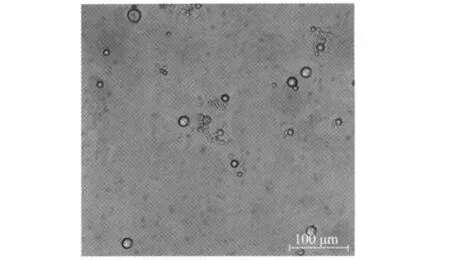
圖5 JZB310113原生質體的形態
2.2.1 培養基種類對原生質體再生的影響
葡萄潰瘍病菌原生質體在SR和PDA培養基上的再生率分別為32.2%和19.8%,由此可見原生質體在SR培養基上的再生率明顯高于在PDA培養基上的再生率,因此SR培養基為該菌適合的再生培養基。
2.2.2 酶解時間對原生質體再生的影響
裂解酶對質膜系統會有一定程度的破壞,因此酶解時間的長短也會嚴重影響原生質體的再生[13]。研究發現,在酶解時間2~4h時,原生質體在SR上的再生情況基本一致,5h時出現明顯下降(圖6)。酶解時間為2h或3h時,原生質體產量較4h時低,綜合考慮以4h作為JZB310113菌株的最佳酶解時間。
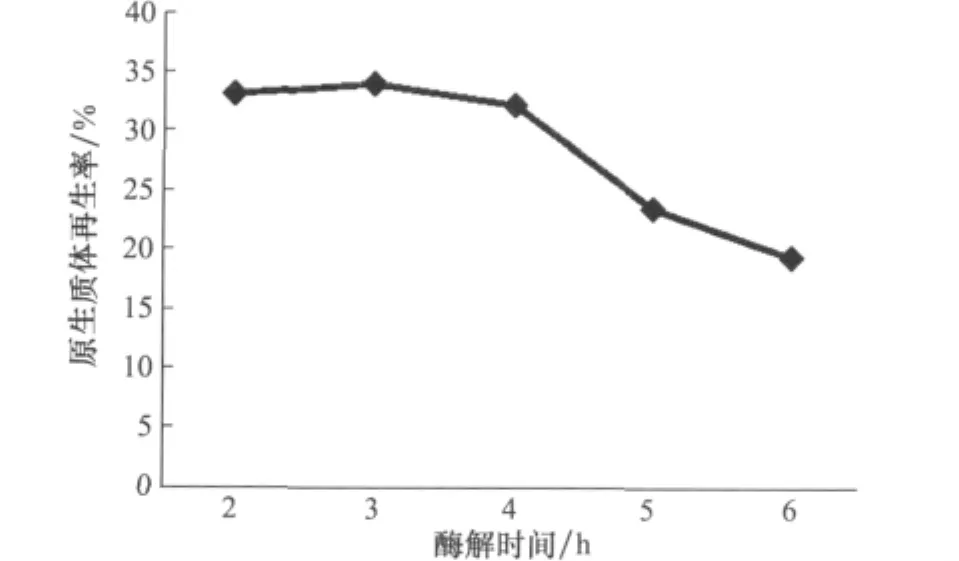
圖6 酶解時間對原生質體產量的影響
3 結論
通過對葡萄潰瘍病菌菌絲的搖培時間、細胞壁降解酶的工作濃度、酶解時間、滲透壓穩定劑種類和濃度及再生培養基等方面的研究,確定了葡萄潰瘍病菌原生質體形成及再生的最適宜條件:將PDA平板上培養36h的葡萄潰瘍病菌菌絲接種到裝有100mL CM液體培養基的500mL三角瓶中,28℃120r/min培養24h,3層濾紙過濾收集菌絲,經0.7mol/L的 NaCl充分滲透后,每克菌絲用2mL崩潰酶和蝸牛酶(濃度均為20mg/mL)的混合液酶解4h,酶解液在4℃條件下2 000r/min離心5min,調節至合適濃度后,涂布在再生培養基SR上。上述研究為葡萄潰瘍病菌穩定、高效遺傳轉化體系的建立及該病菌致病機理的研究奠定了基礎。
4 討論
適用于遺傳轉化的原生質體的制備,是建立植物病原真菌遺傳轉化體系的基礎。據報道,原生質體的形成與再生受多種因素的影響,包括菌株生長的培養基、菌齡、搖培時間、細胞壁降解酶的種類和濃度、酶解時間、滲透壓穩定劑及其濃度,還有菌株本身遺傳特性等多種因素的影響[15]。
由于絲狀真菌細胞壁的組成成分主要為幾丁質,不同微生物細胞壁幾丁質含量存在較大的差別,因此酶解不同微生物細胞壁所需要酶的種類也不同。為摸索葡萄潰瘍病破壁合適的酶,作者選用了崩潰酶、纖維素酶和蝸牛酶進行酶解效果研究,結果表明,崩潰酶加蝸牛酶的效果最好(數據尚未發表)這可能是因為混合酶相互配合使用增加了脫壁效果[16]。
再生培養基的成分對原生質體的再生影響顯著,特別是培養基中的碳源會影響微生物原生質體的再生率。培養基中添加適量的某些營養因子可有效提高再生率,常用的有酵母膏、蛋白質、氨基酸、水解酪蛋白、琥珀酸鈉等。這些物質可作為細胞壁合成的前體物質,也可通過生理代謝或轉化成細胞壁的前體物質或促進代謝、加速細胞壁合成[17],從而為細胞壁的再生提供材料保障。
[1]Li X H,Yan J Y,Kong F F,et al.Botryosphaeriadothideacausing canker of grapevine newly reported in China[J].Plant Pathology,2010,59(6):1170.
[2]Yan J Y,Li X H.Occurrence of grapevine trunk disease caused byBotryosphaeriarhodinain China[J].Plant Disease,2011,95(2):219.
[3]Yan J Y,Peng Y L,Xie Y,et al.First report of grapevine trunk disease caused byBotryosphaeriaobtusain China[J].Plant Disease,2011,95(5):616.
[4]De Groot M J A,Bundock P,Hooykaas P J J,et al.Agrobacteriumtumefaciens-mediated transformation of filamentous fungi[J].Nature Biotechnology,1998,16:839-842.
[5]Ruiz-Díez B.Strategies for the transformation of filamentous fungi[J].Journal of Applied Microbiology,2002,92(2):189-195.
[6]劉限,郭培磊,高增貴,等.木霉菌REMI轉化體對番茄灰霉病的防治及其機理的研究[J].植物保護,2008,34(5):80-85.
[7]李伶俐,嚴紅,李興紅,等.甘藍枯萎病菌原生質體的制備與再生條件的優化[J].中國農學通報,2011,27(10):203-207.
[8]莫靜燕,陳獻忠,王正祥.地衣芽孢桿菌原生質體的制備、再生及轉化研究[J].生物技術,2009,19(5):75-77.
[9]Riach M B R,Kinghorn J R.Genetic transformation and vector developments in filamentous fungi[M]∥Fungal Genetics:principles and practice(C.J.Bos,ed.)Marcel Dekker,New York,1996:209-233.
[10]Keller W A,Melchers G.The effect of high pH and calcium on tobacco leaf protoplast fusion[J].Zeitschrift für Naturforschung C,1973,28:737-741.
[11]Kwon Y C,Suh H S,Chung G S.Protoplast culture and fusion in cruciferae.3;Plant regeneration from protoplast fusion betweenBrassicanapusandBrassicacampestris[J].Research Reports of the Rural Development Administration Biotechnolo-gy,1989,31(4):6-10.
[12]張志光,李東屏,鄒壽長,等.絲狀真菌原生質體技術的研究(Ⅷ)——滲透壓穩定劑對原生質體的影響[J].湖南師范大學自然科學學報,1998,21(2):67-71.
[13]祝子坪,李娜,賀建東.滲透壓穩定劑對桑黃菌原生質體分離與再生的影響[J].食用菌,2009,31(5):25-26.
[14]孫劍秋,周東坡.微生物原生質體技術[J].微生物學通報,2002,37(7):9-11.
[15]陳宏偉,陳安徽,王陶蛹,等.蛹蟲草無性型原生質體制備條件的研究[J].徐州工程學院學報,2008,23(4):22-26.
[16]楊迎青,李明海,楊媚,等.水稻紋枯病菌原生質體制備與再生條件的優化[J].華中農業大學學報,2010,29(5):546-551.
[17]梁平彥.產黃青霉(Penicilliumchrysogenum)兩株營養缺陷型原生質體的形成和再生因素的研究[J].植物生理學報,1981,7(1):1-9.
Development of a method for protoplast preparation and regeneration ofBotryosphaeriarhodina
Zhang Wei, Yan Jiye, Guo Xia, Li Xinghong
(InstituteofPlantandEnvironmentProtection,BeijingAcademyofAgricultureand ForestrySciences,Beijing100097,China)
The culture time of mycelium,the enzymolysis time,the type of osmotic stabilizer and the regeneration medium were optimized in this study.An efficient method for protoplast preparation and regeneration ofBotryosphaeriarhodinawas obtained.While SR medium was chosen as the regeneration medium,the regeneration rate of protoplast reached the highest,up to the maximum of 32.2%.This study provided powerful support for genetic transformation and transformant pathogenicity analysis inBotryosphaeriaspp.
Botryosphaeriaspp.; protoplast; preparation and regeneration
S 436.631;Q 813.11
A
10.3969/j.issn.0529-1542.2012.05.005
2011-12-26
2012-02-18
國家葡萄產業技術體系(CARS-30)
* 通信作者010-51503434;E-mail:lxh1962@yahoo.com.cn

