秸稈纖維素降解真菌QSH3-3的篩選及其特性研究
劉爽,范丙全
(中國農業科學院農業資源與農業區劃研究所,北京100081)
農作物秸稈是我國農業上最豐富的有機質資源,同時也是我國年產量最多的農業副產品,據不完全統計,我國每年農作物秸稈產出量達到7~8億噸。農作物秸稈結構復雜,短期內不易自然腐解,利用效率低,尤其在種植業為主的地區,作物秸稈已經成為生產中的障礙。加快秸稈的腐熟,解決農業主產區的秸稈問題成為國內外科學家的研究熱點,而秸稈纖維素降解菌在加快秸稈腐解方面發揮著重要作用[1]。
自然界中能分解纖維素的有細菌、放線菌和真菌。文獻報道的細菌主要有纖維粘菌(Cytophaga)和纖維桿菌(Cellulomonas)等[2],細菌所產纖維素酶酶系單一,主要是內切酶,多為胞內酶,產量也不高,且多數結合在細胞膜上,菌體細胞需吸附在纖維素上才能起作用,使用很不方便,酶的分離提取也較困難[3]。具有降解纖維素能力的放線菌主要有纖維放線菌(Acidothermus cellulolyticus)、諾卡氏菌屬(Ncardia)和鏈霉菌屬(Streptomyces),但放線菌產量極低,所以研究很少[4-6]。真菌由于具有較高的胞外酶活性且其酶種類比較全面使其有很強的纖維素降解能力,因此對其的研究報道比較多。其中主要以 木 霉 屬 (Trichoderma)[7-9]、曲 霉 屬 (Aspergillus)[10-11]、青霉(Penicillium)[12-13]為主,木霉屬所產纖維素酶的組分比較齊全,但存在β-葡萄糖苷酶活性較低,產酶速度慢,作用pH范圍窄,耐低溫性差等問題[14];黑曲霉是優良的產β-葡萄糖苷酶菌株,但酶系組分較為單一[15];青霉屬(Penicillium)中的一些種類不僅能分泌組成齊全、酶活較高的纖維素降解酶系,而且具有易培養、生長快的優勢[16],但由于之前研究較少,對其所產纖維素酶系需要更全面、深入的認識。因而,目前研究的纖維素降解真菌菌株存在產酶組分系不全、活性不穩定、產酶速度較慢、作用pH范圍窄、特別是產酶溫度要求高等問題,限制了其在田間,特別是北方低溫地區對秸稈的促熟作用,獲取高效降解秸稈纖維素的微生物菌株是解決秸稈還田的關鍵因素。本文擬從低溫高腐殖質環境中篩選在常溫、低溫下具有產纖維素酶能力的青霉屬真菌菌株,并對其產酶特性和酶學性質進行研究,以期為常溫、低溫條件下農作物秸稈的還田利用提供菌種資源和理論依據。
1 材料和方法
1.1 實驗材料
1.1.1 土壤樣品的采集 土壤、腐殖質落葉層樣品取自小興安嶺原始林區及黑龍江農墾集團多年秸稈還田的土壤。
1.1.2 培養基[17](1)赫奇遜氏(Huchinson)無機鹽培養基:KH2PO41.0 g,NaCl 0.1 g,MgSO4·7H2O 0.3 g,NaNO32.5 g,FeCl30.01 g,CaCl20.1 g,水1000 mL,pH 7.2左右。(2)濾紙培養基:赫奇遜氏無機鹽培養基中添加圓形濾紙片。(3)羧甲基纖維素鈉(CMc-Na)平板培養基:CMc-Na 10.0 g,200 g去皮馬鈴薯汁1000 mL,瓊脂18 g,加蒸餾水至pH 7.2左右。(4)種子培養基:采用馬鈴薯–蔗糖瓊脂(PDA)培養基。(5)液體發酵培養基:KH2PO41.0 g,NaCl 0.1 g,MgSO4·7H2O 0.3 g,NaNO32.5 g,FeCl30.01 g,CaCl20.1 g,秸稈木質纖維素50 g或0.5% 的其他碳源,水1000 mL,pH為7.2~7.4。
上述培養基均在121℃,1.01 ×105Pa條件下滅菌30 min備用。
1.1.3 秸稈纖維素的制備 將玉米秸稈剪成2~3 cm小段,烘干后粉碎至0.25 mm,加入2 mol/L的氫氧化鈉溶液,在室溫浸泡12 h,水洗至pH為中性,烘干備用。
1.1.4 主要試劑及儀器 試劑:DNS試劑,檸檬酸緩沖液,燕麥木聚糖(Sigma公司),羧甲基纖維素鈉(國藥集團化學試劑有限公司);新華定性濾紙。儀器:分光光度計、分析天平、恒溫搖床、恒溫水浴箱、離心機。
1.2 測定項目與方法
1.2.1 秸稈降解菌的篩選 直接接種腐殖土粒及腐殖落葉于赫奇遜氏培養基上(培養基凝固后在瓊脂表面放一張滅菌無淀粉濾紙)[8]富集培養,15℃培養20 d后,挑取生長旺盛且使得濾紙變薄或透明的真菌菌落進行純化和保種。再將純化過的菌株分別點接到CMc-Na初篩培養基上培養3 d,采用剛果紅染色法染色,挑取有透明圈的菌株接入到液體濾紙培養基中進行復篩,選取24 h內可以將濾紙消解的菌株進行液態發酵產酶試驗,選取產酶量高的菌株。
1.2.2 秸稈降解菌的鑒定形態鑒定:將菌株接種到PDA固體培養基上,25℃培養7 d后,觀察菌落形態并鏡檢其產孢結構和菌絲形態,根據《真菌鑒定手冊》[18]和《中國真菌志》[19]進行鑒定。分子生物學鑒定:采用rDNA ITS基因序列分析[20]。取培養24 h 菌絲體,提取 DNA[21-22]后,擴增引物 ITS1(5’-GGAAGTAAAAGTCGTAACAAGG -3’)和 ITS4(5’-TCCTCCGCTTATTGATATGC -3’),進行 18S rDNA的擴增,PCR擴增產物經上海生工生物技術有限公司測序后,將獲得的序列與GenBank中已知真菌的18S rDNA序列進行比對。并利用MEGA4.1進行系統發育樹的構建。PCR反應體系為50 μL,反應條件為 94℃ 5 min,94℃ 30 s,57℃ 50 s,72℃50 s,循環30 次;72℃ 10 min。
1.2.3 秸稈降解菌產酶特性分析 將篩選到的菌種在PDA上進行純培養7 d,用無菌水將孢子洗下,制成孢子懸液(1×107/mL)。然后按1%的接種量將孢子懸液加入到100 mL(300 mL的三角瓶)pH為7的赫奇遜氏液體培養基中,碳源為0.5%堿處理的玉米秸稈粉,25℃、170 r/min培養,分別在第1、2、3、4、5、6、7 和 8 d 取樣測定粗酶液中的內切酶活力(CMCase)、濾紙酶活力(FPase)、和木聚糖酶活力(Xylanase)。根據菌株產酶時間變化趨勢,接種1%的孢子懸液到100 mL(300 mL的三角瓶)pH為7的赫奇遜氏液體培養基中,研究不同碳源對產酶的影響時,其中碳源為不同結構的纖維素[0.5%羧甲基纖維素(CMC)、微晶纖維素(MCC)、玉米秸稈粉(CS)以及堿處理的玉米秸稈粉(APCS)];研究不同氮源對產酶的影響時,以堿處理的玉米秸稈粉為碳源,以0.2% 蛋白胨,(NH4)2SO4,(NH2)2CO和NH4NO3替換NaNO3作為單一氮源;在最佳碳源、氮源條件下,研究不同起始 pH(3.0、4.0、5.0、6.0、7.0、8.0、9.0 和10.0)、接種量(1%、3%、5%、7%和9%)和溫度(10℃、15℃、20℃、25℃、30℃、35℃、40℃、45℃)對產酶的影響,每個處理設3個重復,25℃、170 r/min培養4 d,離心,取上清液測定內切酶、濾紙酶和木聚糖酶。
1.2.4 酶學穩定性分析 接種1%的孢子懸液到100 mL(300 mL的三角瓶)pH為7的赫奇遜氏液體培養基中,以堿處理的玉米秸稈粉為碳源,25℃、170 r/min培養4 d,離心,取上清獲得粗酶液。將0.5 mL 粗酶液加入到 pH 值為 3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0的1.5 mL緩沖液中,45℃保溫1 h,測定濾紙酶、內切酶和木聚糖酶。將0.5 mL粗酶液加入到pH值5.0的1.5 mL緩沖液中,在40℃、45℃、50℃、55℃、60℃、65℃ 各溫度下保溫 1 h后,測定內切酶、濾紙酶和木聚糖酶。
1.2.5 纖維素酶、木聚糖酶活力的測定 發酵液離心10 min(4000 r/min),取上清液作為粗酶液。用DNS法測定粗酶液中內切酶、濾紙酶和木聚糖酶活力[23-26]。內切酶和濾紙酶單位定義為每mL每min產生1 μg的葡萄糖所需要的酶量定義為一個酶活單位(U)[27],木聚糖酶單位定義為每mL每min產生1 μg的木糖所需要的酶量定義為一個酶活單位(U)[28]。
試驗數據采用Microsoft Excel(2003)和SPSS V17.0統計軟件進行統計分析,LSD法檢驗差異顯著性。
2 結果與分析
2.1 纖維素降解低溫菌的篩選
從東北地區的低溫土壤樣品中,經富集、初篩得到12株真菌,能夠在15℃條件下以濾紙為唯一碳源的培養基上生長良好,而且將濾紙完全降解。再將菌株接種到以CMC為唯一碳源加入剛果紅的無機鹽培養基上,以透明圈直徑大小為標準進行復篩,獲得效果最好菌株QSH3-3。
2.2 產纖維素酶菌株的鑒定
2.2.1 形態特征顯示 QSH3-3菌株所形成菌落在PDA平板上先以白色絮狀輪生,待長出青綠色孢子后,孢子會向四面散射,在平板上形成許多菌落。隨培養時間延長,孢子變成暗綠色。菌落平坦,質地絨狀。菌落背面呈黃綠色。挑取孢子與菌絲體在顯微鏡下觀察,分生孢子梗帚狀分支,最末級的瓶狀小枝上生出成串的分生孢子。孢子透明,呈卵圓形,光滑,約4 μm ×5 μm。
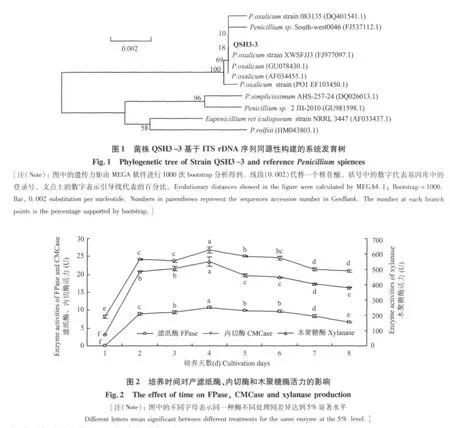
2.2.2 ITS序列分析 提取菌株QSH3-3 DNA后,利用ITS通用引物進行PCR擴增,將擴增并驗證得到的片段測序,然后經過DNASTAR軟件校正拼接,獲得572 bp的核苷酸序列。將獲得的序列在Gen-Bank上進行同源性比較,發現該序列與青霉菌的序列同源性>98%,利用MEGA4.1的Neighbor-Joining進行系統發育樹的構建,結果如圖1,遺傳距離顯示菌株QSH3-3與青霉遺傳距離最近。結合形態觀察,初步確定菌株QSH3-3屬于青霉屬中的草酸青霉(Penicillium oxalicum)。
2.3 不同條件對菌株QSH3-3產酶效果的影響
2.3.1 培養時間對產酶的影響 將菌株QSH3-3按1%接種量接入到液體培養基中發酵培養(170 r/min,25℃),每隔1 d取樣測定濾紙酶、內切酶、木聚糖酶。結果顯示,濾紙酶、內切酶、木聚糖酶在培養2 d時酶活力分別達到9 U,24 U,487 U,到4 d時均達到最高,分別為11 U,27 U,550 U,之后酶活緩慢下降。菌株在培養2~6 d,殘余酶活力達80%以上(圖2)。在之后考察各種因子對產酶影響效果時,均測定發酵培養4 d后粗酶液的酶活力。
2.3.2 不同碳源對產酶的影響 以不同結構的纖維素[0.5% 羧甲基纖維素(CMC)、微晶纖維素(MCC)、玉米秸稈粉(CS)以及堿處理的玉米秸稈粉(APCS)]為底物,研究碳源對菌株QSH3-3產酶的影響(表1)。堿處理玉米秸稈粉處理的產酶效果最佳,濾紙酶、內切酶、木聚糖酶分別達到11 U、27 U、550 U,其次為天然的玉米秸稈粉,羧甲基纖維素和微晶纖維素產酶效果較差。以堿處理的玉米秸稈粉比玉米秸稈粉為底物的濾紙酶、內切酶和木聚糖酶分別提高57.1%、28.6%和62.7%;比以MCC為底物的分別提高36.3%、46.1%和136.1%;比以CMC為底物的分別提高了22.2%、92.9%和957.7%。
2.3.3 不同氮源對產酶的影響 發酵液體培養基中分別添加0.2%的蛋白胨,硫酸銨,脲,硝酸銨作為單一氮源,碳源均為堿處理的玉米秸稈粉,接種量為1%,發酵培養(170 r/min,25℃),4 d后測定濾紙酶、內切酶、木聚糖酶。結果顯示,蛋白胨為氮源時,濾紙酶、內切酶、木聚糖酶酶活力最大,分別達到11.2 U、26.6 U和582.8 U(表2);硫酸銨作為氮源時,濾紙酶、內切酶、木聚糖酶三種酶活性與蛋白胨作為氮源的處理沒有明顯差異,但與脲作氮源相比,濾紙酶、內切酶、木聚糖酶分別高了 28.6%、62.3%、178.7%,差異顯著;與硝酸鈉作氮源相比分別高了約3.8%、1.2%和4.1%。考慮成本因素,本研究選擇硫酸銨為草酸青霉QSH3-3產酶培養的氮源。

表1 同碳源對產濾紙酶、內切酶和木聚糖酶活力的影響(U)Table 1 The effect of carbon sources on FPase,CMCase and xylanase production

表2 不同氮源對產濾紙酶、內切酶和木聚糖酶活力的影響(U)Table 2 The effect of nitrogen sources on FPase,CMCase and xylanase production
2.3.4 不同起始pH對產酶的影響 將菌株QSH3-3按1% 接種量接入到4~9的不同起始pH的液體培養基中發酵培養(170 r/min,25℃),結果表明,初始pH值在4~9的液態發酵條件下,菌株都能很好的生長,而且濾紙酶、內切酶和木聚糖酶三種酶活力表現相同規律,隨著起始pH值升高酶活力升高,到pH值為7.0時,達到最大,其后逐漸下降(圖3)。在初始pH值為7的條件下,濾紙酶、內切酶、木聚糖酶分別約為11 U、28 U、576 U,比初始pH值為4時分別高約30.2%、24.0%、22.8%;比初始pH值為9時分別高約19.0%、18.1%、18.2%。初始pH值在4~9范圍內,三種酶活力均可達到最適起始pH值為7時酶活力的70%以上。

圖3 起始pH對產濾紙酶、內切酶和木聚糖酶活力的影響Fig.3 The effect of initial pH on FPase,CMCase and xylanase production
2.3.5 不同接種量對產酶的影響 將菌株按1%、3%、5%、7%和9% 的接種量(107/mL菌懸液)分別接入到液體培養基中發酵培養(pH 7,170 r/min,25℃)。結果顯示,濾紙酶、內切酶、木聚糖酶在接種量分別為5%、5% ~7%和5%時,酶活達到最大(表 3),分別達到11.8U、28.2U、593.0 U,與接種量為1%時相比,濾紙酶、內切酶、木聚糖酶分別高出9.3%、8.0%和4.3%,比接種量為9%時分別高出37.2%、16.1%和4.9%。接種量小于5%或者大于5%,菌株所產三種酶的酶活均不能達到最高值。只有接種量在一定范圍內才能保證菌株的最大產酶量。本試驗以5%接種量最佳,在此條件下,濾紙酶、內切酶、木聚糖酶酶活力達到最大。
2.3.6 不同培養溫度對產酶的影響 溫度是影響產纖維素酶菌株活力的重要因素之一,培養溫度對產酶有較大的影響。將菌株QSH3-3按5%接種量接入到液體培養基中,于 10℃、15℃、20℃、25℃、30℃、35℃、40℃、45℃搖瓶發酵培養,4 d后測定濾紙酶、內切酶、木聚糖酶。結果表明,產酶溫度在10℃~30℃范圍內,酶活力隨溫度升高酶活逐漸增大,產酶溫度在30℃ ~45℃范圍內,酶活力隨溫度升高迅速下降,當產酶溫度為30℃時對菌株產酶最為有利,濾紙酶、內切酶、木聚糖酶分別達到12 U、30 U、605 U,且該菌株最大優勢是在15℃條件下濾紙酶、內切酶、木聚糖酶即可達到最大酶活力的73.9%、78.9%和80.6%(圖4)。該研究結果顯示了該菌株在低溫條件下對秸稈纖維素類物質的降解潛力。

表3 接種量對濾紙酶、內切酶和木聚糖酶產酶活力的影響(U)Table 3 The effect of inoculation volume on FPase,CMCase and xylanase production
2.4 酶學穩定性
2.4.1 酶的pH穩定性 將菌株QSH3-3在最佳產酶條件下的粗酶液分別置于pH值在3~10范圍內的緩沖液中,室溫保持1 h后,測定內切酶、濾紙酶和木聚糖酶。結果顯示,在pH 4~9范圍內,酶活力保持穩定,內切酶殘余酶活力達到70%以上;濾紙酶和木聚糖酶殘余酶活力達到85%以上(圖5)。該菌株所產的內切酶、濾紙酶和木聚糖酶具有較強的pH穩定性。

2.4.2 酶的熱穩定性將菌株QSH3-3在最佳產酶條件下的粗酶液分別在 40℃、45℃、50℃、55℃、60℃、65℃的不同溫度下保溫1 h后,測定內切酶、濾紙酶和木聚糖酶。由圖6可以看出,三種酶的酶活力規律一致,隨著溫度的升高其活性逐漸降低。內切酶、濾紙酶和木聚糖酶在65℃時,分別只有45℃條件下的40%、53%和13%(圖6)。內切酶和濾紙酶在40~50℃之間酶活保持穩定,在50℃以上,酶活力迅速下降,木聚糖酶在40~45℃之間酶活保持穩定,45℃以上,酶活力迅速下降。該菌株所產內切酶、濾紙酶和木聚糖酶的耐熱性較差。

圖6 不同溫度條件下濾紙酶、內切酶和木聚糖酶活力的穩定性Fig.6 Thermal stability of FPase,CMCase and xylanase activities
3 討論
秸稈成分復雜,在高溫堆腐條件下,較易腐解,而秸稈的應用難題在于農田大規模秸稈的降解,其腐解溫度低,需要篩選常溫或低溫條件下能夠產生高活性的纖維素、半纖維素酶菌株加快秸稈腐熟,已報道的產纖維素酶菌株對其產酶適宜溫度的研究大多都在25℃以上,且具有較高產酶能力的溫度范圍一般都在 25 ~35℃范圍內[29-30],低溫條件下產酶能力相當較弱,不利于在田間溫度較低條件下發揮作用。王希國等[29]研究了不同培養溫度對梅林青霉下的產纖維素酶的影響,在24℃時,殘余纖維素酶活力約為40% ~60%,而本實驗篩得的菌株QSH3-3在15℃時即可產生的酶活力較高,殘余酶活力可以達到70%以上,這對在地溫較低的田間秸稈原位還田具有重要意義。另外,田間環境中酸堿差異較大,南方土壤一般呈偏酸性,北方土壤一般呈偏堿性,菌株不能保持在中性環境下進行生長,而目前篩得的菌株產酶的最適pH條件一般均為偏酸性,王儀明等[30]研究表明綠色木霉產纖維素酶的適宜pH在5~6.5范圍內,培養基起始pH 7.5時纖維素酶的產量大大下降。史玉英等[31]分離的纖維素分解菌群,對濾紙、膨化稻草等自然纖維素表現出較強的分解能力,但培養4 d后由于pH失調而反應終止。菌株產酶的pH范圍窄限制了其在田間的推廣應用。所篩菌株QSH3-3在pH 4~9范圍內,均可保持較強的產纖維素酶的能力,且該菌株所產纖維素酶、木聚糖酶均具有較強的pH耐受力。因而菌株QSH3-3該菌株在田間溫差大、土壤偏堿性等復雜條件下對秸稈纖維素類物質的降解具有較高的應用潛力。
4 結論
本研究在15℃下篩選到1株產纖維素酶真菌QSH3-3,經鑒定為草酸青霉Penicillium oxalicum。該菌株以堿處理過的玉米秸稈粉為碳源,硫酸銨為氮源,起始pH為7,接種量5%,30℃下培養4 d,濾紙酶、內切酶、木聚糖酶分別達到約12 U、30 U、605 U,其中木聚糖酶是已報道的最大酶活為216 U的長梗木霉E3菌株[32]的2.8倍,最大酶活387 U赭綠青霉Sp1[33]的1.56倍,最大酶活136.9 U的粗糙脈孢菌[34]的4.4倍,濾紙酶、內切酶與目前報道的酶活力一致。
[1]趙明文,史玉英,李玉祥,婁無忌.纖維分解菌群對水稻秸稈田間腐熟效果的研究[J].江蘇農業科學,2000,1:51-53.
Zhao M W,Shi Y Y,Li Y X,Lou W J.Effect of cellulose de-composing bacteria population on ecomposition of rice straw in fields[J].Jiangsu Agric.Sci.,2000,1:51 -53.
[2]劉娣.秸稈纖維素高效降解真菌的篩選、鑒定及其纖維素酶基因克隆[D].北京:中國農業科學院碩士學位論文,2008.
Liu D.Screening,identification and cellulase gene cloning of high effective straw cellulose-degrading fungus strains[D].Beijing:MS thesis,Chinese Academy of Agricultural Sciences,2008.
[3]陳紅歌,張東升,劉亮偉.纖維素酶菌種選育研究進展[J].河南農業科學,2008(8):5-7.
Chen H G,Zhang D S,Liu L W.Recent advances of breeding strains of cellulose[J].J.Henan Agric.Sci.,2008(8):5 -7.
[4]Sakon J,Adney W S,Himmel M Eet al.Crystal structure of thermostable family 5 endocellulase E1 fromAcidothermus cellulolyticusin complex with cellotetraose[J].Biochem.J.,1996,35(33):10648-10660.
[5]劉東波,高培基.纖維素諾卡氏菌的一個新菌株[J].微生物學報,1990,30(1):70-72.
Liu D B,Gao P J.A new stain ofNcardia.Cellulolyticus[J].Acta Microbiol.Sin.,1990,30(1):70 -72.
[6]Li X.Streptomyces cellulolyticus sp.nov.,a new cellulolytic member of the genus Streptomyces[J].Int.J.Syst.Bacteriol.,1997,47(2):443-445.
[7]李振紅,陸貽通.高效纖維素降解菌的篩選[J].環境污染與防治,2003,25(3):133-136.
Li Z H,Lu Y T.Screening on the cellulose-decomposing microorganisms[J].Environ.Pull.Control,2003,25(3):133 -136.
[8]張毅民,呂學斌,萬先凱,等.一株纖維素分解菌的分離及其粗酶性質研究[J].華南農業大學學報,2005,26(2):69-72.
Zhang Y M,Lü X B,Wang X Ket al.Isolation of a cellulose-decomposing microorganisms and investigation of its crude enzyme properties[J].J.South China Agric.Univ.,2005,26(2):69-72.
[9]孟會生,劉衛星,洪堅平.纖維素分解菌群的篩選組建與羧甲基纖維素酶活初探[J].山西農業大學學報,2006,26(1):27-31.
Meng H S,Liu W X,Hong J P.Research on screening of cellulose-decomposing strains and activity of CMCase [J].J.Shanxi Agric.Univ.,2006,26(1):27 -31.
[10]徐昶,龍敏南,鄔小兵,等.高產纖維素酶菌株的篩選及產酶條件研究[J].廈門大學學報,2005,44(1):107-110.
Xu C,Long M N,Wu X Bet al.Screening and characterization of a high cellulase producing[J].J.Xiamen Univ.,2005,44(1):107-110.
[11]蔡鳳.黑曲霉纖維素酶的純化及酶學性質研究[D].南京:南京理工大學碩士學位論文,2006.
Cai F.Purification and properties of cellulase from Aspergillus[D].Nanjing:MS thesis,Nanjing University of Science and Technology,2006.
[12]王洪媛,范丙全.三株高效秸稈纖維素降解真菌的篩選及其降解效果研究[J].微生物學報,2010,50(7):870-875.
Wang H Y,Fang B Q.Screening of three straw-cellulose degrading microorganism[J].Acta Microbiol.Sin.,2010,50(7):870-875.
[13]殷中偉,范丙全,任萍.纖維素降解真菌Y5的篩選及其對小麥秸稈降解效果[J].環境科學,2011,32(1):247-252.
Yin Z W,Fan B Q,Ren P.Isolation and identification of a cellulose degrading fungus Y5 and its capability of degradating wheat straw[J].Environ Sci.,2011,32(1):247 -252.
[14]孫憲昀,陳家楠.纖維素化學的現狀與發展趨勢[J].纖維素科學與技術,1995,3(1):1-10.
Sun X Y,Chen J N.The situation and development trend of Cellulose chemistry[J].J.Cell.Sci.Technol.,1995,3(1):1 -10.
[15]Rashid M H,Rajoka M I,Siddiqui K Set al.Kinetic properties of chemically modified β-glucosidase from Aspergillus niger280[J].Pakistan J.Zool.,1997,29:354 -363.
[16]曲音波,劉自勇.青霉木質纖維素降解酶系研究進展[J].應用與環境生物學報,2007,13(5):736-740.
Qu Y B,Liu Z Y.Progress in research of lignocellulose-degrading enzymes from penicillium [J].Chin.J .Appl.Environ.Biol.,2007,13(5):736 -740.
[17]中國科學院南京土壤研究所微生物室.土壤微生物研究法[M].北京:科學出版社,1985.
Academy of Science Nanjing Institute Microorganism Room.Methodology of research soil microorganism Chinese[M].Beijing:Science Press,1985.
[18]魏景超.真菌鑒定手冊(第一版)[M].上海:上海科學技術出版社,1979.501-512.
Wei J C.Fungal identification manual.First section[M].Shanghai:Shanghai Scientific and Technical Publishers,1979.501-512.
[19]孔華忠.中國真菌志(第三十五卷)—青霉屬及其相關有性型屬(第一版)[M].北京:科學出版社,2007.197-199.
Kong H Z.Flora fungorum sinicorum(vol.35)– penicillium et teleomorphicognati.First section[M].Beijing:Science Press,2007.197-199.
[20]White T J,Bruns T,Lee Set al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics:A guide to methods and application[M].San Diego:Academic Press,1990.315 -322.
[21]Raeder U,Broda P.Rapid preparation of DNA from filamentous fungi[J].Lett.Appl.Microbiol.,1985,1:17 -20.
[22]吳志紅,汪天虹,黃衛.簡便易行的絲狀真菌染色體DNA提取法[J].菌物系統,2001,20(4):575-577.
Wu Z H,Wang T H,Huang W.A simplified method for chromosome DNA preparation from filamentous fungi[J].Mycosystema,2001,20(4):575-577.
[23]Ghose T K.Measurement of cellulose activities[J].Pure Appl.Chem.,1987,59:257-268.
[24]Wyk V,Mohulatsi M.Biodegradation of wastepaper by cellulase fromTrichooderma viride[J].Biores.Technol.,2003,86(1):21-23.
[25]Bailey M J,Biel Y P,Poutanen K J.Znterlatoratoratory Testing of methods for assay of xylamase [J].J.Biotechnol.,1992,23:257-270.
[26]Laura P,Wendicuti Castro.Themostable xylanases produced at 37℃ and 45℃ by a themotolerantAspergillusstrains[J].FFMS Microbiol.Lett.,1997,146:97 -102.
[27]劉世利,汪天虹,秦楠,等.產適冷木聚糖酶的海洋產青霉的篩選和誘變[J].菌物系統,2003,22(2),272-276.
Liu S L,Wang T H,Qin Net al.Isolation and mutagenesis of cold-adaptive xylanase-producing penicillium strain[J].Mycosystema,2003,22(2):272-276,
[28]侯運華.適冷海洋青霉纖維素酶和半纖維素酶的分子生物學研究[D].濟南:山東大學博士學位論文,2006.
Hou Y H.Molecular research on the cellulase and hemicellulase of a novel cold-adaptive marine Pencillium FS010[D].Jinan:PhD dissertation,Shandong University,2006.
[29]王希國,楊謙,燕紅,張魯進.梅林青霉液態發酵生產纖維素酶條件的研究[J].農業環境科學學報,2007,26:97-100.
Wang X G,Yang Q,Yan H,Zhang L J.Cellulase production byPenicillium meliniiinliquid state fermentation [J].J.Agro-Environ.Sci.,2007,26:97 -100.
[30]王儀明,張宗舟,藺海明,等.綠色木霉固態發酵產纖維素酶活力的研究[J].草業科學,2009,26(5):123-127.
Wang Y M,Zhang Z Z,Lin H Met al.Study on cellulase activity produced by solid-state fermentation ofTrichoderma viride[J].Pratac.Sci.,2009,26(5):123 -127.
[31]史玉英,沈其榮,婁無忌,等.纖維素分解菌群的分離和篩選[J],南京農業大學學報,1996,19(3):59-62.
Shi Y Y,Shen Q R,Lou W Jet al.Isolation and screening of cellulose decomposing mixing strains [J].J.Nanjing Agric.Univ.,1996,19(3):59-62.
[32]申軻.木聚糖酶產生菌的篩選及產酶條件的研究[D].廣西:廣西大學碩士學位論文,2010.
Shen K.Screening of xylanase producing strain and study on its producing condition[D].Guangxi:MS thesis,Guangxi University,2010.
[33]馮蕾,宋彥波,徐曉立,等.赭綠青霉Sp1菌株木聚糖酶最佳產酶條件及部分酶學特性研究[J].新疆農業科學,2010,47(8):1606-1614.
Feng L,Song Y B,Xun X Let al.Fermentation and characteristics of a xylanase producing strainPenicillium ochrochloronSp1[J].Xinjiang Agric.Sci.,2010,47(8):1606 -1614.
[34]趙峰,聶小琦,余麗娟,等.木聚糖酶高產菌株的篩選及其產酶營養條件研究[J].釀酒科技,2008,9:36-38.
Zhao F,Nie X S,Yu L Jet al.Screening of fungal strain with high yield of xylanase and study of its nutritional condition for enzyme production[J].Liquor-Mak.Sci.Technol.,2008,9:36-38.

