感染性結石大鼠模型的尿路組織病理學改變
呂建林,徐彥
(1.南京醫科大學附屬江寧醫院泌尿外科,江蘇南京 211100;2.江蘇省中醫院泌尿外科,江蘇 南京 210029)
感染性結石形成的先決條件是解脲酶微生物引起的持續性尿路感染,必要條件是解脲酶微生物產生的脲酶對尿中尿素的分解[1-2]。與感染性結石最相關的致病性解脲酶微生物是奇異變形桿菌。奇異變形桿菌及其產生的脲酶對尿路上皮細胞損傷后所導致的一系列病理生理改變以及細胞的適應性反應在感染性結石的形成中起著重要的作用。尿路的病理性損害又成為引發感染性結石形成的因素,并進一步加重尿路感染。本研究目的在于觀察實驗性大鼠尿路感染性結石形成所導致的尿路組織病理學的改變,以及尿路組織病理學改變對感染性結石成因的影響。
1 材料與方法
1.1 實驗材料
雄性SD純種大鼠,體重(180±10)g,由南京青龍山動物飼養廠提供(許可證號:SCXK-2009-0007)。大鼠均在南京大學醫學院動物中心清潔級飼養室中飼養,可以自由獲取食物及飲水,室溫(20±2)℃,濕度50% ~60%。
奇異變形桿菌由南京大學醫學院附屬軍區總醫院檢驗科微生物室提供。
HM 325無水乙醇、甲醛、二甲苯、多聚賴氨酸(南京化學試劑有限公司),PBS緩沖液和枸櫞酸緩沖液(南京生興生物技術有限公司);蘇木素、伊紅(美國Sigma公司),抗兔二抗試劑盒(武漢博士德生物工程有限公司),兔抗THP(Tamm-Horsfall蛋白)抗體(美國Santa Cruz公司)。
1.2 實驗方法
1.2.1 菌液及異物制備 在血瓊脂平板上孵育奇異變形桿菌24 h后,從血瓊脂平板上挑出單個菌落,用5 ml鹽水制成懸液。在充足光線下,背對著有白色背景與黑色對比線條的卡片,將接種管與0.5號麥氏標準管進行目測比較,將菌懸液調至0.5麥氏濁度。此時菌懸液內培養物大約含1~2×108CFU·ml-1。再將菌懸液用鹽水1∶10稀釋,獲得107CFU·ml-1的菌液。另取聚乙烯管(長4 mm,直徑為0.5 mm),浸泡于107CFU ml-1的細菌菌懸液中,置于恒溫箱中共同培養8 h以上。
1.2.2 模型分組 為排除非健康實驗動物對實驗結果的影響,大鼠適應性飼養5 d后分組造模。SD雄性大鼠24只,分為3組。空白對照組(n=4):每天普通飼料喂養(10 g·只-1),膀胱內不置入任何異物。假手術組(n=10):以 25%烏爾坦(1.0 g·kg-1)腹腔注射麻醉,腹部皮膚去毛后以1.5%碘伏消毒,鋪無菌手術巾。麻醉滿意后取恥骨弓上方下腹部正中切口,切開腹腔,提起膀胱,使用無菌G18穿刺針,于膀胱頂部穿刺入膀胱后直接退出,膀胱內不置異物,關閉腹腔,術后6 h后恢復進食、進水。實驗組(n=10):以25%烏爾坦(1.0 g·kg-1)腹腔注射麻醉,腹部皮膚去毛后以1.5%碘伏消毒,鋪無菌手術巾。麻醉滿意后取恥骨弓上方下腹部正中切口,切開腹腔,提起膀胱,以無菌G18穿刺針于膀胱頂部穿刺入膀胱,經穿刺針內腔,使用推桿將聚乙烯管[此前浸泡于107CFU·ml-1的細菌菌懸液中,置于恒溫箱(37℃)中共同培養8 h以上]推入膀胱,退出穿刺針后關閉腹腔,術后6 h后恢復進食、進水。以上各組動物白天均投以充足的普通飼料,自由飲水。
1.2.3 標本獲取及組織切片HE染色和免疫組化染色 手術后第21天以過量麻醉方法處死全部大鼠。取下腹部正中切口(長約4 cm)進入腹腔,將大鼠腎臟、輸尿管和膀胱分離,提起膀胱底部,分離至尿道近端剪斷,取出腎、輸尿管、膀胱后,觀察臟器大小、表面色澤及結石形成的情況。獲取的尿路組織標本立即置于4%多聚甲醛固定24 h,常規石蠟包埋組織標本,4 pm厚切片。(1)HE染色。切片常規用二甲苯脫蠟,經各級乙醇醇化后水洗。蘇木素染色5 min,自來水沖洗。鹽酸、乙醇分化(提插數下),自來水浸泡15 min或溫水(約50℃)浸泡5 min,伊紅染色2 min。常規脫水,透明封片,中性樹脂封固。(2)免疫組化染色。組織標本脫蠟:60℃烤箱預熱30 min后,二甲苯脫蠟15 min,兩次。水化:依次置于 100%、100%、95%、85%、75%乙醇,蒸餾水中水化處理10 min。3%H2O2室溫孵育15 min后,1×PBS沖洗3次后,置于0.01 mmol·L-1枸櫞酸緩沖液(pH 6.0)中煮沸15 min,蒸餾水浸泡30 min,1×PBS沖洗3次。滴加兔抗THP(H135)抗體(濃度1∶120),37℃溫箱孵育60 min。滴加羊抗兔二抗,37℃孵育30 min,1×PBS沖洗3次。DAB顯色,自來水反復沖洗。蘇木素復染,封片。根據Tamm-Horsfall蛋白在髓攀升支粗段和遠曲小管近段上皮細胞免疫組化著色度表達進行評分(按照色度學準則,分析免疫組化彩色圖像):著色度0~33%評1分,34% ~66%評2分,67% ~100%評3分。
2 結 果
造模術后第2天,實驗組大鼠死亡2只,其他各組大鼠無死亡。解剖發現死亡原因為大鼠腹腔重癥感染合并尿潴留。術后第21天,以過量麻醉方法處死全部大鼠。肉眼觀察,空白對照組與假手術組的腎臟、輸尿管無明顯變化,膀胱內無結石生成(圖1、2)。假手術組膀胱組織在穿刺點局部稍有增厚。實驗組大鼠的雙側腎臟明顯增大、質暗腫脹,腎表面可見數量不等的微小膿腫,個別腎臟可見較大膿腫突出腎臟表面。腎切面腎盂擴大,黏膜充血、腫脹,腎盂內可見膿性分泌物。輸尿管腫脹,內見炎癥分泌物。膀胱表面的黏液層被破壞,膀胱壁明顯增厚,膀胱表面粗糙糜爛,散在潰瘍,局部可見到粟粒樣膿腫。膀胱內見結石樣物質(圖3)。實驗組大鼠的組織病理學變化為腎小管細胞發生混濁腫脹,管腔中有紅細胞及白細胞管型,腎間質有水腫,部分纖維化(圖4)。輸尿管上皮中度增生,管腔中見大量中性粒細胞,周圍間質中見中性粒細胞以及成纖維細胞(圖5)。膀胱組織血管廣泛性擴張充血,大量炎細胞浸潤,并有組織細胞壞死,膀胱移行上皮呈廣泛性增生(圖3)。實驗組腎臟Tamm-Horsfall蛋白在髓攀升支粗段和遠曲小管近段的上皮細胞表達增高(圖6)。
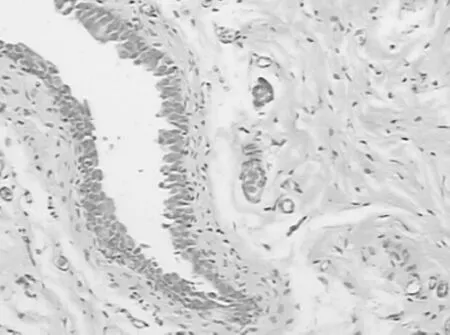
圖1 空白對照組膀胱 HE×200Fig 1 The control group(bladder)HE×200
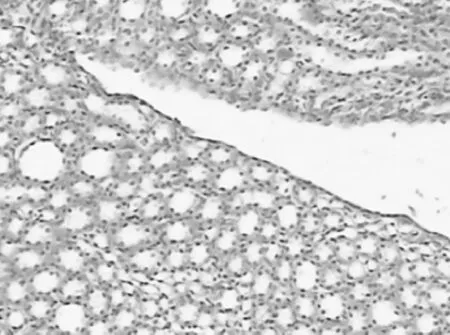
圖2 空白對照組腎臟 HE×200Fig 2 The control group(kidney)HE×200

圖3 實驗組膀胱圖片 HE×200Fig 3 Experimental group(bladder)HE×200
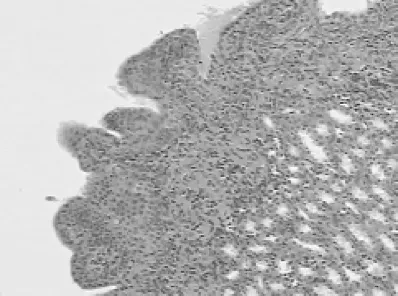
圖4 實驗組腎盂圖片 HE×200Fig 4 Experimental group(kidney)HE×200

圖5 實驗組輸尿管圖片 HE×200Fig 5 Experimental group(ureteral)HE×200
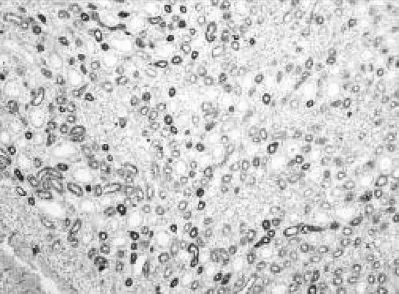
圖6 實驗組大鼠Tamm-Horsfall免疫組化染色 ×200Fig 6 Immunohistochemistry staining of Tamm-Horsfall protein pression in kidney of rat ×200
3 討 論
泌尿系結石形成的病因主要分為兩類,即代謝性和感染性結石,其中,感染性結石占5% ~15%[1]。感染性結石形成的先決條件是解脲酶微生物引起的持續性尿路感染[2-4]。成功地構建感染性結石的動物模型可以進一步研究解脲酶微生物,及其脲酶對尿路上皮細胞造成損傷后所產生的一系列病理改變,以及尿路上皮細胞的適應性反應。細菌在尿路上皮的拓殖是尿路感染的基礎[5]。細菌的拓殖主要依靠其自身的黏附性,這種黏附性與細菌表面的纖毛有密切關系[5-6]。在無尿液膀胱輸尿管返流的情況下,奇異變形桿菌通過其表面的纖毛黏附于尿路上皮細胞的甘露糖,并通過趨化作用上行至腎臟,引起腎臟感染[7-9]。
目前,有關解脲酶陽性菌引起的尿路上皮細胞損傷在感染性結石形成過程中的作用,及結石形成后所起的組織細胞變化的機制并不清楚。我們對感染性結石的動物模型觀察發現,奇異變形桿菌引起的尿路組織病理學的損害主要表現為腎盂腎炎和膀胱炎。組織形態學變化為腎盂擴大,黏膜充血、腫脹,部分腎實質可見微小膿腫或錐形炎癥灶;輸尿管腫脹,其內見炎癥分泌物;膀胱表面的黏液層被破壞,膀胱表面粗糙糜爛,膀胱壁明顯增厚,局部可見到粟粒樣膿腫,部分融合成片,膀胱內有大量成形結石形成。腎臟病理學變化為腎小管細胞發生混濁腫脹,管腔中有紅細胞及白細胞管型,腎間質有水腫,部分纖維化。膀胱組織血管廣泛性擴張充血,大量炎細胞浸潤,并有組織細胞壞死。膀胱移行上皮呈廣泛性增生。
奇異變形桿菌及其解脲酶產物對尿路的病理損害可能既是尿路感染所造成的結果,又參與了此后的結石的生成。細菌入侵腎臟后,可直接破壞腎盂黏膜及腎小管上皮,受損的上皮細胞壞死脫落后將使腎小管基底膜暴露,為細菌進一步拓殖或尿液中結晶的附著提供了部位。死菌及其碎片可沉積在腎小管上皮表面而加重腎小管的損傷,脫落的上皮細胞可降解為膜碎片與活性下降或死亡的奇異變形桿菌在具有黏性糖蛋白聚集下可成為感染性結石形成的核心[6-8]。此外,受損的腎小管上皮細胞將發生結構和病理變化,其表達的一些大分子物質和蛋白質可發生質和量的改變,從而影響感染性結晶的成核、聚集和滯留。已知的這些大分子物質和蛋白質有Tamm-Horsfall蛋白、尿凝血酶片段-1、CD44、骨橋蛋白、透明質酸、磷脂酞絲氨酸、硫酸乙酞肝素、唾液酸、纖維連接蛋白、白細胞介素-6以及其他一些生化物質,其中比較重要的是Tamm-Horsfall蛋白。
Tamm-Horsfall蛋白只在腎臟小管的亨利袢上升段和遠曲小管近段的上皮細胞產生,與糖脂磷脂酰肌醇結合于腎小管管腔周圍[10],并在一種蛋白酶分解后釋放于尿中,是尿液中最豐富的蛋白。許多炎癥性腎病與Tamm-Horsfall蛋白有關[11]。感染性結石引起的腎臟組織損傷可以導致Tamm-Horsfall蛋白表達增高。我們觀察到,大鼠感染性結石模型中腎小管上皮細胞Tamm-Horsfall蛋白表達明顯增高。在尿路炎癥的條件下,Tamm-Horsfall蛋白可能在對固有免疫細胞的激活的過程中扮演內源性啟動子的作用[12]。長期以來,人們意識到Tamm-Horsfall蛋白可能在尿石的形成中起作用,但對其具有促進晶體聚合還是抑制晶體聚合的作用存在爭議。其實,Tamm-Horsfall蛋白在尿中是一把雙刃劍,在敲除大鼠Tamm-Horsfall蛋白表達基因后,腎臟內有草酸鈣結石的形成,此研究[10]結果表明,Tamm-Horsfall蛋白對草酸鈣結石的形成具有明顯的抑制作用。尿中尿素的濃度對Tamm-Horsfall有影響,其濃度增高可使Tamm-Horsfall蛋白黏性降低,溶解性增加;相反若尿素濃度降低,Tamm-Horsfall蛋白發生聚集,黏性增加且易形成凝膠,有利于成為結石形成的核心。
奇異變形桿菌及其解脲酶對尿路上皮細胞可以造成損傷,損傷后所產生的一系列病理生理改變以及細胞的適應性反應在感染性結石的形成中起了重要的作用。奇異變形桿菌、解脲酶及磷酸胺鎂結晶與尿路上皮細胞的相互作用是一個復雜過程。
[1]HEALY K A,OGAN K.Pathphysiology and management of infectious staghorn calculi[J].Urol Clin North Am,2007,34:363-474.
[2]MLIIER N L,EVAN A P,LINGEMAN J E.Pathogenesis of renal calculi[J].Urol Clin North Am,2007,34:295-313.
[3]LETICIA REYES,MARY REINHARD.Rat strains differ in susceptibility to ureaplasma parvum-induced urinary tract infection and struvite stone formation[J].Infection and immunity,2006,25:6656-6664.
[4]THOMAS B,TOLLEY D.Concurrent urinary tract infection and stone disease:pathogenesis,diagnosis and management[J].Nat Clin Pract Urol,2008,5:668-675.
[5]AHUJA S,KAACK B,ROBERTS J.Loss of fimbrial adhesion with the addition of vaccinum macrocarpon to the growth medium of beta-fimbriatedEscherichia coli[J].Journal of Urology,1998,159:559-562.
[6]ALLISON C,EMODY L,COLEMAN N,et al.The role of swarm cell differentiation and multicellular migration in the uropathogenicity of Proteus mirabilis[J].Infect Dis,1994,169:1155-1158.
[7]BURALL L S,HARRO J M,et al.Proteus mirabilis genes that contribute to pathogenesis of urinary tract infection:identification of 25 signature-tagged mutants attenuated at least 100-fold[J].Infect Immun,2004,72,2922-2938.
[8]STURGILL G,RATHER P N.Evidence that putrescine acts as an extracellular signal required for swarming in Proteus mirabilis[J].Mol Microbiol,2004,51,437-446.
[9]LIAW S J,LAI H C.WANG,W B.Modulation of swarming and virulence by fatty acids through the RsbA protein in Proteus mirabilis[J].Infect Immun,2004,72,6836-6845.
[10]WORCESTER E M,NAKAGAWA Y,WABNER,C L,et al.Crystal adsorption and growth slowing by nephrocalcin,albumin,and Tamm-Horsfall protein[J].Am J Physiol,1988,255:1197.
[11]朱新俠,姚婷,王穎明,等.腎病患者尿Tamm-Horsfall蛋白含量變化及其臨床意義[J].臨床檢驗雜志,1997,2:101.
[12]張曉滌,孫波,黃敏,等.β2-m及THP在腎臟病中的變化[J].中華腎臟病雜志,1993,9:54.

