ScYLV和SrMV的PCR引物優化設計
王洪星 ,張雨良 ,羅志文 ,楊文君 ,劉志昕
(1.中國熱帶農業科學院熱帶生物技術研究所/農業部熱帶作物生物技術重點開放實驗室,海口 571101;2.海南大學環境與植物保護學院,儋州571737)
聚合酶鏈式反應(PCR)是體外擴增DNA的一種技術,其能夠在短時間內根據極微量的模板序列擴增出大量特異性DNA片斷,擴增過程類似于核裂變。Mullis博士在1983年發明了該技術,PCR技術是現代分子生物學中最有價值的技術之一(David Clark,2005),隨著科學技術的發展其又衍生出多種類型的相關技術,包括差異顯示PCR、實時定量PCR、巢式PCR、多重PCR和不對稱PCR等(薩姆布魯克,2002)。
PCR方法的廣泛應用及其相關技術的順利進行均離不開PCR引物的合理設計。可以說,PCR引物的合理設計是任何PCR反應能否進行及其產物的特異性、產率高低的關鍵。目前許多計算機軟件如Primer Premier 3.0,Primer Premier 5.0,Oligo 6.0等均可用于引物的設計。但由于軟件自身存在的局限性,其設計的引物并無法滿足實驗者不同需要。目前最常用的是計算機輔助設計,即實驗者根據PCR引物設計的原則并結合自己的經驗人工設計引物,然后選擇合適的軟件分析引物的合理性。
1 材料和方法
1.1 實驗材料及軟件
實驗用甘蔗樣品采自海南兩院甘蔗種植基地。 Trizol(Invitrongen),SYBR Green supermix(TaKaRa)、RTPCR試劑盒PrimeScript TM One-Step Ver.2.0購自寶生物工程(大連)有限公司,PCR產物回收試劑盒(上海生物工程有限公司),反轉錄酶、Taq酶及其它生物試劑均購自北京全式金生物科技有限公司,其它藥品為國產分析純。Primer Premier 5.0、Oligo6.0、DNAMAN等軟件于http://www.bio-soft.net下載。
1.2 甘蔗總RNA提取和RT-PCR
從待檢測甘蔗植株上取幼嫩組織,以TRIzol法(余愛麗,2004)得到較理想的RNA樣品。提取的總RNA溶解于100μL dd H2O中,取4μL RNA溶液稀釋200倍,采用UV-760紫外分光光度計測量260nm、280nm的OD值,計算OD260/280的比值并用1.2%的普通瓊脂糖凝膠電泳在約5V/cm的電壓下,快速電泳檢測并照相。
以所提取的總RNA為模板,利用寶生物工程 (大連)有限公司SuperScript III反轉錄體系進行,PCR反應按全式金公司TaqDNA聚合酶操作說明進行,并優化反應程序。
1.3 PCR引物的設計與目的序列測序
1.3.1 普通PCR引物設計與目的序列測序 根據甘蔗黃葉病毒 (ScYLV)genebank相關基因系列 (登錄號AF369923.1;AF369924.1;AF369925.1;AF369926.1;AF369927.1;AF369928.1;AF369929.1;AF141385.1;AF141385.1)、 高粱花葉病毒 (SrMV) 相關基因序列 (登錄 號:NC_004035.1;DQ530434.1;U57358.2;AY648298.1)通過DNAMAN軟件比對,找出保守序列,綜合考慮引物設計的各項原則,運用DNAMAN、Primer Premier 5.0和Oligo6.0進行基因同源性分析和引物設計,使引物序列G+C含量介于45%~60%,引物長度介于18~25bp,目的片段介于400~1000 bp(見表1)。
對PCR的各引物濃度及反應的退火溫度進行優化,篩選出不同病毒PCR反應體系的最佳反應模式。PCR產物經1.0%瓊脂糖凝膠電泳;切膠后用回收目的片段,克隆于pMD18-T載體,送上海生物工程公司測序。
1.3.2 多重PCR引物設計擴增 利用上述結果,結合考慮多重PCR引物設計的各項原則,運用Primer Premier 5.0和Oligo6.0進行引物驗證,以挑選出一對特異引物(表1)。
1.3.3 實時定量PCR引物設計 綜合考慮多重PCR引物設計的各項原則, 運用 Primer Premier 5.0、Oligo6.0和DNAMAN進行基因同源性分析和引物設計。對PCR的各引物濃度及反應的退火溫度進行優化,篩選出PCR反應體系的最佳反應模式(表2)。切膠回收,測序;連接pMD18-T載體、轉化、提取質粒,稀釋10倍,利用SYBR Green I熒光染料法做標準曲線。

表2 用于實時定量PCR擴增的引物特征
1.4 帶有酶切位點的引物設計與目的序列測序
根據ScYLV相關基因 (登錄號AY23679.1、GU190159.1、HM640267、AF157029.1、AF369927.1、GU190159.1、AF157029.1、AM072750.1、AY236971.1、GU570006.1),綜合考慮酶切位點引物設計的各項原則,運用Primer Premier 5.0、Oligo6.0和DNAMAN進行基因同源性分析和引物設計,設計出克隆Coat Protein(CP)基因和P0蛋白基因的引物(表3)。
對PCR的各引物濃度及反應的退火溫度進行優化,篩選出不同基因片段PCR反應體系的最佳反應模式。切膠回收、雙酶切,連接pMD18-T載體、轉化、提取質粒,雙酶切質粒,凝膠電泳,回收目的片段,再送檢測序。

表3 用于擴增ScYLV相關序列的帶酶切位點的引物特征
2 結果與分析
2.1 樣本總RNA電泳結果
用TRIzol法分別從感病植株葉片中提取RNA,瓊脂糖凝膠電泳顯示各條帶清晰,無明顯的拖尾現象,RNA具有較好的完整性(圖1)。
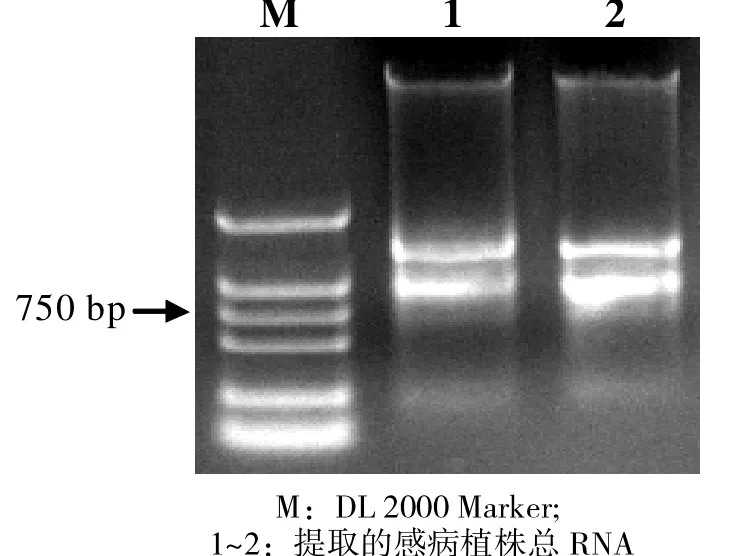
圖1 Trizol法提取甘蔗病葉總RNA 1%瓊脂糖凝膠電泳
2.2 PCR引物效果檢測
2.2.1 普通PCR引物效果檢測 所設計PCR引物擴增效率高、特異性好、電泳結果呈單一亮帶,且各引物無特異性條帶,引物設計成功。ScYLV和SrMV均見特異性反應條帶,經測序,1~5的條帶大小依次為:833、470、591、400、346 bp,與預期產物大小相同(圖 2)。

圖2 引物特異性試驗
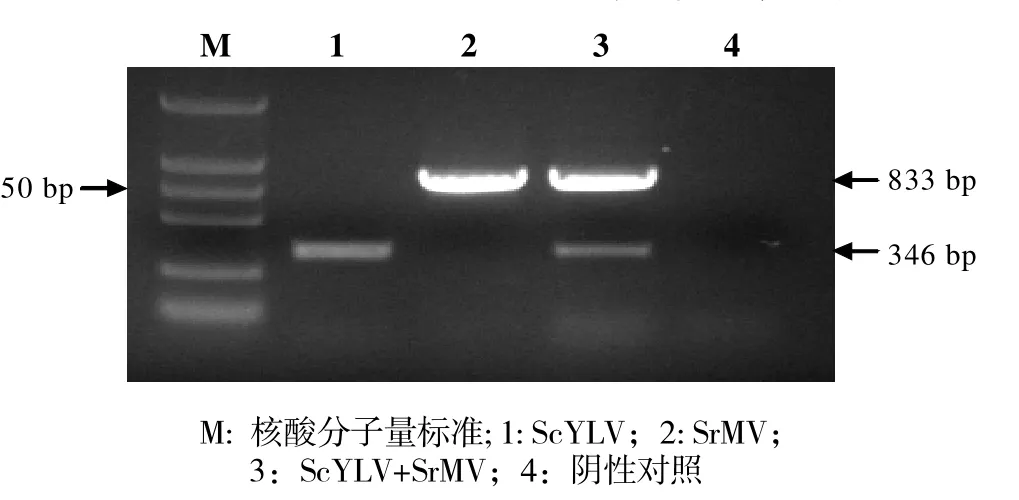
圖3 多重RT-PCR特異性試驗
2.2.2 多重PCR引物設計效果檢測 特異性試驗ScYLV和SrMV均見特異性反應條帶,而且引物之間與模板之間也未產生明顯的相互干擾,引物設計成功。經測序,序列大小分別為346和833bp,與預計產物大小相同(圖3)。
2.2.3 實時定量PCR引物設計效果檢測 試驗以制備的ScYLV標準品 (濃度分別為 108、107、106、105、104、103、102、101)采用10倍濃度的梯度稀釋。通過梯度稀釋樣本的設置,用擴增曲線達到域值時的反應循環數(Ct值)做回歸曲線,結果如圖4:可以得到較理想的標準曲線,線性關系良好 (R2=0.988),擴增效率為99.8%,引物設計成功,可以定量檢測ScYLV。

圖4 ScYLV熒光定量標準曲線

圖5 PMD-19重組質粒的酶切圖譜
2.3 帶有酶切位點的引物設計效果檢測
PCR產物經雙酶切后的電泳結果 (圖5)表明,所設計引物擴增效率高、特異性好,可用于后續試驗。ScYLV CP、P0可以順利克隆表達,經測序,條帶大小分別為591 bp和771 bp,與預期產物大小相同,均成功連有酶切位點,經蛋白分析后,CP基因在表達載體中表達出來的融合蛋白大約43kD;P0基因在表達載體中表達出來的融合蛋白大約51 kD。
3 討論
PCR引物設計的目的是為了找到一對合適的寡核苷酸片段,使其能有效地擴增模板DNA序列。因此,引物的優劣直接關系到PCR的特異性成功與否。設計PCR引物,首先要解決引物評估問題,即回答什么是合適的引物,以及這些引物的相互干擾是否在可接受的范圍內。PCR引物設計問題中要考慮的生物參數分為兩部分:首先是先確定單個引物的約束參數,據此可以區分引物的優劣;其次是根據不同PCR的要求確定引物間的約束參數,據此來評價引物之間的干擾是否在可接受的范圍內。
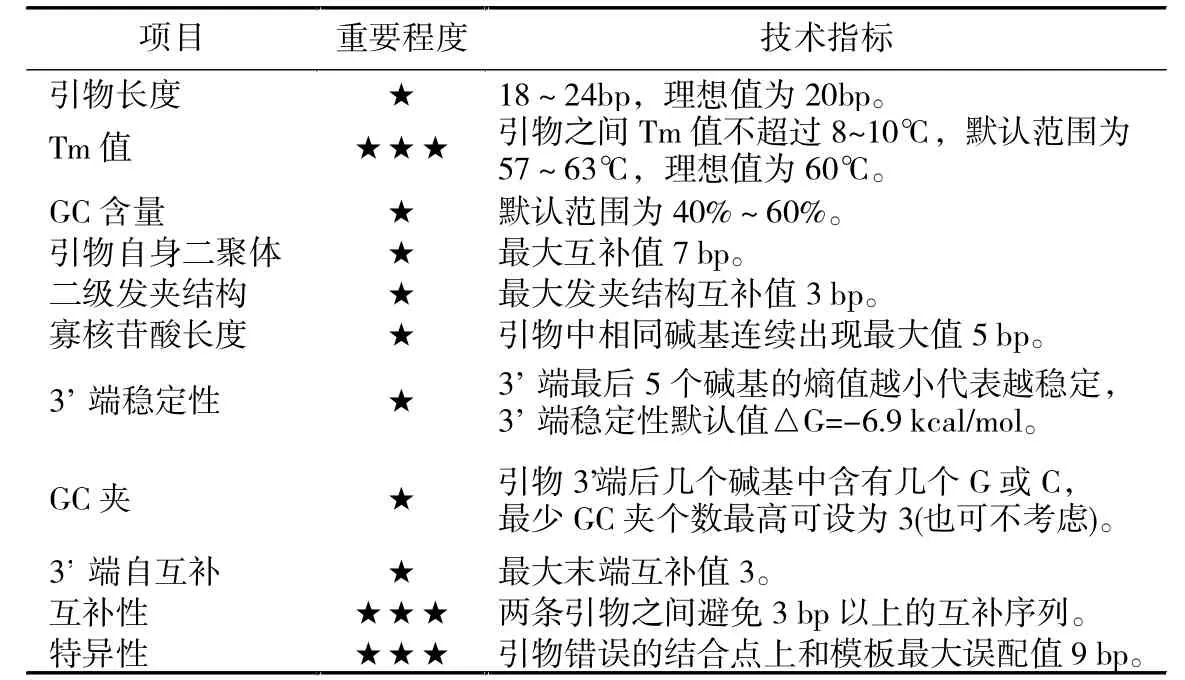
表4 單條引物約束參數
3.1 普通PCR引物的約束參數
根據對文獻的總結,對單個引物考慮了如下 11個約束條件 (表 4): 引物長度(Abdelsalam.K.,2003 )、Tm 值(SantaLucia.J.Jr.,1998)、引物 GC 含量(Dieffenbach.C.W.等,1993)、引物自身二聚體、二級發夾結構、寡核苷酸長度、3'端穩定性(Steven.Rozen,2007)、GC 夾(F.John.Burpo,2001)、3'端自互補、互補性、特異性(Lin.W.M.,1993)。
3.2 多重PCR的引物約束參數
在多重PCR反應中,引物的設計至關重要,是影響多重PCR反應成敗的關鍵。在多重PCR反應中,單條引物的長度最好介于18~24 bp,引物太長,容易導致引物之間相互纏繞,嚴重影響多重PCR反應結果。同時,為了避免引物的非特異性擴增,引物必須高度特異。此外,要充分考慮到不同引物對之間互補的堿基序列,特別是引物間引物二聚體的形成,這將嚴重影響到引物的有效性。所有的引物對最好有相近的退火溫度,引物的堿基構成最好是4種堿基的比例相當,G+C的含量最好介于40%~60%。如果可能的話,引物的序列以1~2個GC開頭或結尾,避免3'端以A結尾。將引物設計好后,設計的引物序列應該與數據庫中的核苷酸序列進行比對。如果擴增位點非常相似,存在著交叉反應,那么在引物的3'末端至少有1~2個特異性的堿基用于目的基因的特異性擴增。在多重PCR反應中,引物的濃度影響著多重PCR反應的結果。試驗結果證明,太高的引物濃度或者太低的引物濃度在多重PCR的反應中都應該避免(Henegariu.O.,1997)。太高的引物濃度或許抑制了多重的反應結果,同時太低的引物濃度很可能是無效的。
根據(Peter.M.V,2004)對多個引物之間,以及引物對,考慮了如下7個約束條件(表5):引物長度差、退火溫度差、引物間3'端互補、產物長度、產物間長度差、引物間互補、特異性。

表5 用于多重PCR引物約束參數
3.3 實時定量PCR引物約束參數
對于實時定量PCR有兩種類型:(1)染料法。一般用SYBRGreenⅠ染料較為常見,其引物設計參數根據(Moravec.T,2003),引物設計的基本原則是提高擴增的效率和檢測特異性。一般遵循以下原則(表6)。(2)熒光探針檢測法。要同時考慮引物和探針的質量。通常先滿足普通PCR引物的設計要求,然后尋找合適的探針位置,再進行探針的設計,然后再將引物和探針之間進行比對分析(Kalender,2008)。用于實時定量PCR探針技術指標如表6。
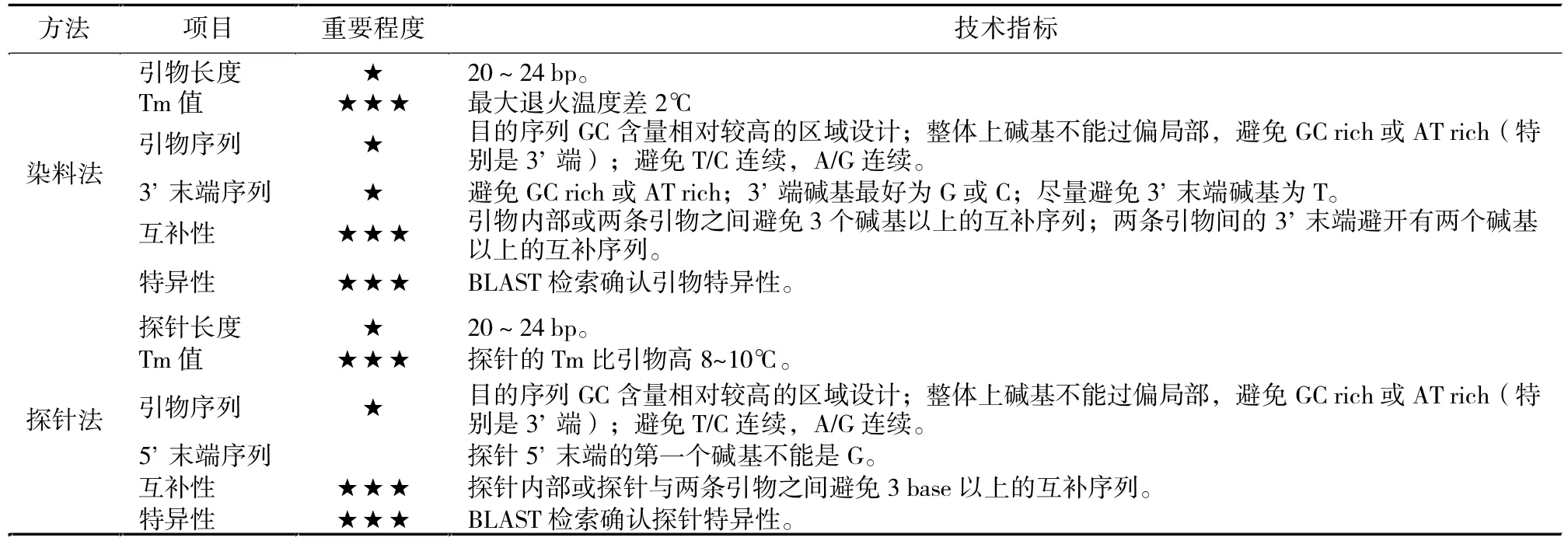
表6 用于SYBR GreenⅠ染料法和探針法實時定量PCR引物約束參數

表7 帶有酶切位點的引物約束參數
3.4 帶有酶切位點的引物約束參數
對于帶有酶切位點的引物設計,考慮了6個約束條件(表7):酶切位點、目的序列、酶切位點的位置、酶切效率、引物長度、特異性。一般都是做基因克隆表達,除基本滿足一般的引物要求外還有更高的要求。根據實驗需要,確定需要擴增的DNA序列,并知道其CDS區序列(編碼結構基因區,即從起始密碼子區至終止密碼子區)可登陸NCBI網站(http://www.ncbi.nlm.nih.gov/)查詢。
3.5 影響引物設計成功率的因素
引物設計的優劣,是影響實驗結果的重要因素。有些引物反應性能差,可以通過反應條件優化得到改善,但大多數情況改善的效果并不明顯,因此,預先設計反應性能好的引物非常重要。針對引發PCR實驗失敗的三大主要因素(Andreson.R.,2008):(1)引物和模板結合位點數目;(2)引物 GC 含量;(3)預期 PCR 擴增產物。引物設計的關鍵點主要有三:(1)特異性高:DNA模板上不存在與引物的錯配部位或錯配效率較低;(2)對引物解鏈溫度Tm值的精確估算是確定PCR反應退火溫度的前提條件,決定著實驗的效率和精確性(Chavali.S,2005)。因此Tm值和GC含量在適當范圍;引物利用效率高:引物內部和上、下游引物之間無互補序列;(3)引物的長度、擴增片段長度等參數也要加以考慮。
引物設計主要借助于生物軟件,如:Primer3(Rozen.S.,2000),Primerpremier (Singh.V.K,1998),0ligo(Rychlik.W,2007)等,但其重點在單引物的設計優化上,當中也有個別引物設計軟件考慮到了引物之間設計優化,基于不同實驗要求,引物設計中,由于實驗的復雜性,幾乎沒有某一個引物設計軟件能完美地完全滿足要求。因此利用引物設計軟件中不同技術指標參數。再加上人為的分析和選擇因素不但可以大大提高引物設計的成功率,而且可以不必花費太多時間和精力。經實驗總結可以歸納一下,主要有以下三點:第一,模板的因素。盡量避免選擇一些困難模板,其中有一些模板本身的GC含量偏高或偏低,導致引物的GC含量不能控制在合適的范圍。另外還有一些模板基因家族很大或者與其DNA序列相近的基因很多,導致引物的PCR擴增不特異。這些最終都造成PCR擴增的失敗;第二,引物的篩選,運用Primer Premier 5.0設計了一組引物后,經過初次篩選得到幾對適合要求的引物,還要在初次篩選的基礎上進一步用Oligo6.0驗證,然后篩選出能夠進行特異高效PCR擴增的引物。
選出理論上較合適的引物以后,可以有以下兩個步驟,保證引物設計的成功率:一是要將得到的一系列引物分別在Genebank中進行回檢。也就是把每條引物在比對工具http://www.ncbi.nlm.nih.gov/blast/的blast中進行同源性檢索,棄掉與基因組其它部分同源性比較高的引物,也就是有可能形成錯配的引物。一般連續10bp以上的同源有可能形成比較穩定的錯配,特別是引物的3'端應避免連續5~6bp的同源。二是如果以mRNA為模板設計引物時還應注意:首先利用生物信息學的知識大致判斷外顯子與內含子的剪接位點 (例如http://CCR-081.mit.edu/GENESCAN.html的GENES-CAN工具或者GeneParser軟件),然后棄掉正好位于剪接位點的引物,實驗證明,按照上述原則設計合成的引物和探針,得到了高擴增效率和穩定的檢測結果。
引物設計只是為PCR反應提供一種可能性,實驗中由于影響PCR實驗的因素較多,有時需要不斷摸索條件,引物設計軟件只是一種工具,只能為PCR實驗設計提供比較可靠的引物,加速最佳條件的摸索,最終達到成功實現PCR實驗的目的。
[1]Andreson.R.,Mols.T.,Remm.M.Predicting failure rate of PCR in large genomes[J].Nucleic Acids Res,2008,36(11):66-67.
[2]Abdelsalam.K.Bioinformatic tools and guideline for PCR primer design[J].African Journal of Biotechnology, 2003,2(5):91-95.
[3]Chavali.S.,Mahajan.A.,Tabassum.R.,Bharadwaj.D., Oligonucleotide properties determination and primer designing:a critical examination of predictions.[J].Bioinformatics,2005,21(20):3918-3925.
[4]Dieffenbach.C.W.,Lowe.T.M.,Dveksler.G..S.General concepts for PCR primer design[J].PCR Methods and Appl.,1993,3(3):30-37.
[5]David Clark.Molecular Biology:Understanding the Genetic Revolution[M].U.S.A:ELSEVIER Inc.,2005:52-73,634-661.
[6]F.John.Burpo.A critical review of PCR primer design algorithm and cross-hybridization case study[Z].USA:Stanford University,2001:1-11.
[7]Henegariu.O.,Heerema.N.A.,Dlouhy.S.R.,et al.Multiplex PCR:critical Parameters and Step-by-Step Protocol[J].Biotechniques,1997,23(3):504-511.
[8]薩姆布魯克J,拉塞爾D W(黃培堂等譯).分子克隆實驗指南(第3版)[M].北京:科學出版社,2002:597-701.
[9]Kalendar R.L.D.,Schulman A.H.FastPCR Software for PCR Primer and Probe Design and Repeat Search[J].Genes,Genomes and Genomics,2009,3(1):1-14.
[10]林萬明.PCR技術操作與應用指南[M].北京:人民軍醫出版社,1993:25-40.
[11]Moravec.T.,Cerovska.N.,Boonham.N.The detection of recombinant,tuber necrosing isolates of Potato virus Y(PVY(NTN))using a three-primer PCR based in the coat protein gene[J].J.Virol.Methods,2003,109(1):63-68.
[12]Peter.M..V.,John.M.Butler.AutoDimer:a screening tool for primer-dimer and hairpin structures[J].BioTechniques,2004,37(2):226-231.
[13]Rozen.S.,Skaletsky.H.Primer3ontheWWWforgeneralusersandforbiologistprogrammers[J].MethodsMol.Biol.,2000,132:365-386.
[14]Rychlik.W.OLIGO7 primer analysis software[J].Methods Mol.Bio.,2007,402:35-60.
[15]SantaLucia.J.,Jr.A unified view of polymer,dumbbell,and oligonucleotide DNA nearest-neighbor thermodynamics[J].Proc Natl Acad Sci USA,1998,95(4):1460-1465.
[16]Steven.Rozen.,Helen.Skaletsk.Primer3 Input Help[Z].USA:Whitehead Institute for Biomedical Research,MIT,2007.
[17]Singh.V.K.,Mangalam A.K.,Dwivedi.S.,Naik.S.Primer premier program for design of degenerate primers from a protein sequence[J].Biotechniques,1998,24(2):318-319.
[18]余愛麗.斑茅抗逆性評價及其BADH基因的克隆表達[D].福建農林大學,2004:27-28.

