小肽轉運載體1的生物學特性及其功能
朱宇旌 王秉玉 張 勇 李欣蔚 邵彩梅
(1.沈陽農業(yè)大學畜牧獸醫(yī)學院,沈陽 110866;2.遼寧禾豐牧業(yè)有限公司,沈陽 110164)
小腸是動物吸收營養(yǎng)物質的主要場所,食物進入小腸后被蛋白水解酶分解成肽的混合物或游離氨基酸[1]。小肽轉運載體(peptide transporter,PepT)主要參與腸道內二肽和三肽的跨膜轉運[2],這種跨膜轉運是動物體內營養(yǎng)物質運輸的重要途徑。目前已知的小肽轉運家族包括PepT1、PepT2、肽/組氨酸轉運子1(peptide/histidine transporter 1,PHT1)和 PHT2[3-4],其中研究比較深入的是前兩者。許多試驗動物的PepT1和PepT2基因都已被克隆[5]。PepT1在小肽轉運過程中由質子原動力提供能量,使之成為區(qū)別于其他物質轉運的一種獨特轉運機制,對于小肽的吸收利用具有重要作用。本文旨在就PepT1的分類、生物學特征及功能進行簡要綜述。
1 PepT1的生物學特征
1.1 PepT1的基因組成及分類
PepT1是由載體 SLC15A1構成的,屬于SLC15 家族(solute carrier family 15)[4],位于小腸上皮細胞內的刷狀緣膜上,但其三維結構目前尚不清楚。SLC15家族成員是通過質子動力將各種短鏈肽和肽的類似物轉運到細胞內的。這個家族最初的轉運子PepT1(其編碼基因為SLC15A1)和PepT2(其編碼基因為SLC15A2)的主要功能是調節(jié)腸及腎小管上皮細胞中肽的吸收。但到目前為止,在哺乳動物中已經確定出另外2種肽的轉運子PHT1(其編碼基因為SLC15A4)和PHT2(其編碼基因為SLC15A3)。它們與PepT系列整體氨基酸的序列相似之處達到20%~25%。PHT1和PHT2主要運輸組氨酸和某些二、三肽[6]。Daniel[7]總結了肽轉運家族成員,詳見表1。
1.2 PepT1的蛋白質分子結構
PepT1是完整的膜蛋白,Terova等[8]在歐洲鱸魚中分離出一個完整的PepT1 cDNA,一共有3 014個區(qū)域,其中包括5'-非編碼區(qū)(101 bp)、開放編碼區(qū)(2 184 bp)和3'-非編碼區(qū)(729 bp),并預測出12個跨膜結構域的蛋白質(728個氨基酸)(圖1)。其中氨基端和羧基端都位于細胞質內側。在第9跨膜區(qū)和第10跨膜區(qū)之間存在一個較大的親水環(huán),位于細胞膜外側,親水環(huán)上面有許多糖基化位點。分別在細胞內環(huán)第6、7跨膜區(qū)之間和第8、9跨膜區(qū)之間有1個蛋白激酶C(PKC)和1個蛋白激酶A(PKA)的磷酸化位點[9]。不同種類的動物小腸中PepT1 mRNA長度不同,所編碼成蛋白質的氨基酸組成數目也不同,但其分子質量相同,都為79 ku。其中豬小腸內PepT1 mRNA是由708個氨基酸編碼的,與綿羊和牛相似[10]。

表1 質子寡肽轉運家族Table 1 The proton oligopeptide cotransporter family[7]

圖1 PepT1的跨膜模型Fig.1 Membrane-spanning model of PepT1
1.3 PepT1的克隆
PepT1在多種脊椎動物物種中進行了克隆,包括兔、大鼠、小鼠、羊、雞、火雞、狗、人、豬、牛、猴、大西洋鱈魚和斑馬魚(表2)。PepT1的氨基酸組成范圍為707~729。PepT1在細菌、酵母、植物和無脊椎動物中也被發(fā)現(xiàn)。目前有研究表明,依靠PepT1轉運的原核H+和YdgR(Escherichia coli tppB),特點和功能與哺乳動物的PepT1非常相似[11]。
2 PepT1的功能
2.1 PepT1在組織和細胞中的表達和調控
PepT1在組織和細胞中的分布具有一定的研究意義。PepT1 mRNA最初在小腸和腎小管上皮細胞內表達[6]。PepT2基因主要在腎臟腎小管內表達,在肺、乳腺、脈絡叢和神經系統(tǒng)神經膠質細胞內也有少量的表達,但是不存在于腸道內[7]。PepT1基因在小腸內是通過腸道上皮特異性基因Cdx2進行具體地表達的[12]。轉錄因子在腸上皮細胞增殖、分化和成熟中起重要的作用,組織和細胞中的調控最有可能是通過刺激蛋白1(SP1)轉錄因子的相互作用發(fā)生在其中有識別位點的PepT1基因上,從而控制基底活動[13]。在大西洋鱈魚的十二指腸、空腸、回腸和雞、豬、反芻動物體內分別檢測出大量PepT1 mRNA[14]。PepT1基因在雞的盲腸中有表達,而在小腸和腎臟中沒有[15]。Amberg等[16]在鱈魚仔魚的體內整個消化系統(tǒng)(除食道和肛門括約肌)中發(fā)現(xiàn)PepT1基因的表達。Howard等[17]發(fā)現(xiàn)PepT1 mRNA在鼠的整個小腸內都有表達。Hussain等[18]觀察到在胎兒18 d時和嬰兒出生當天,其體內的PepT1蛋白存在于十二指腸內,出生后PepT1延伸到細胞質下部和細胞膜內。斷奶和成年以后,PepT1基因僅在刷狀緣膜表達。

表2 不同動物腸內克隆PepT1的對比Table 2 Comparison of cloned intestinal PepT1 across several species[11]
2.2 PepT1的轉運機制
PepT1在腸道內通過跨膜轉運肽類物質,對腸道吸收營養(yǎng)物質有重要作用。PepT1轉運小肽的調控機制是:H+和二、三肽分子穿過小腸上皮細胞膜后,被PepT1轉運到細胞漿內,通過結合小腸上皮細胞膜的Na+/H+交換系統(tǒng)再將H+轉運出細胞外,將Na+置換到細胞內,從而維持細胞膜的質子驅動力,同時也結合細胞膜的Na+/K+-ATP酶交換系統(tǒng),將Na+轉運出細胞外,以維持細胞外到細胞內的Na+梯度(圖2)。
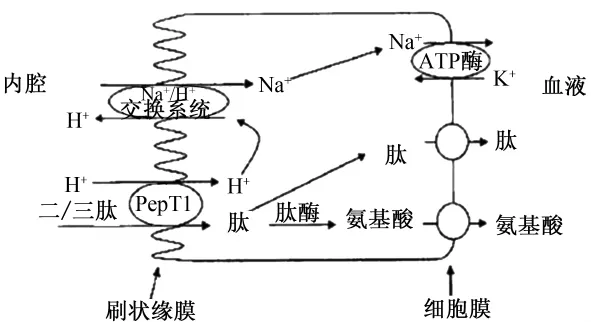
圖2 腸上皮細胞轉運小肽的細胞過程Fig.2 Cellular processes involved in transport of small peptides by the intestinal epithelial cells[14]
2.3 PepT1跨膜轉運途徑
在小腸上皮細胞內,PepT1轉運肽類物質可能會因為小肽吸收途徑的轉變而改變。其途徑主要包括PepT1的主動轉運、細胞穿透肽(CPP)攜帶肽類物質的運輸轉運及旁細胞途徑(圖3)[11]。
3 PepT1活性調控
PepT1的活性調控受許多因素所影響,其中包括生物學因素、營養(yǎng)因素、底物因素以及生理因素等。這些因素對PepT1的活性調控具有上調或下調的作用。
3.1 生物學因素
在哺乳動物中,PepT1的活性調控受到可調節(jié)激素,如胰島素、表皮生長因子、瘦素和甲狀腺素等影響,這些因素能顯著提高細胞對肽類物質的攝入量,同時可以增加細胞膜上PepT1的含量[19]。Sun等[20]研究表明,向嚴重燒傷的大鼠體內注射重組人生長激素能夠顯著提高燒傷大鼠小腸上皮細胞對二肽的攝入量。
3.2 營養(yǎng)因素
飼糧蛋白質水平可能是影響PepT1活性調控的重要因素,起著上調作用。從飼料科學的角度看,飼糧蛋白質是最重要的營養(yǎng),提高飼糧蛋白質利用的同時也有助于減少氮的排放量。
腸道營養(yǎng)物質的轉運受飼糧和腸腔內底物濃度的影響。Ostaszewska等[19]分別飼喂鱈魚二肽、游離氨基酸和完整蛋白,結果顯示飼喂二肽及游離氨基酸的鱈魚體內PepT1 mRNA表達顯著增加,體重比飼喂完整蛋白的鱈魚增加8倍。Hindlet等[21]給大鼠飼喂含有甘氨酰肌氨酸(Gly-Sar)的飼料,發(fā)現(xiàn)大鼠體內PepT1 mRNA表達增加6倍。有關研究表明使鱸魚禁食35 d,發(fā)現(xiàn)其體內PepT1 mRNA表達減少,恢復進食后PepT1 mRNA的表達顯著增加,說明PepT1 mRNA影響鱸魚的飲食調節(jié)[8,22]。PepT1活性調控與飼糧蛋白質水平關系密切。試驗表明:給肉雞飼喂低質量的飼糧(玉米蛋白粉)顯示,第3天至第7天肉雞體內PepT1 mRNA的表達相對減少,到第14天表達顯著增加;給雛雞飼喂等量的高質量飼糧(大豆蛋白粉)顯示,肉雞體內PepT1 mRNA的表達從第3天到第14天持續(xù)不斷地增加,同時雛雞體重也顯著增加[23]。
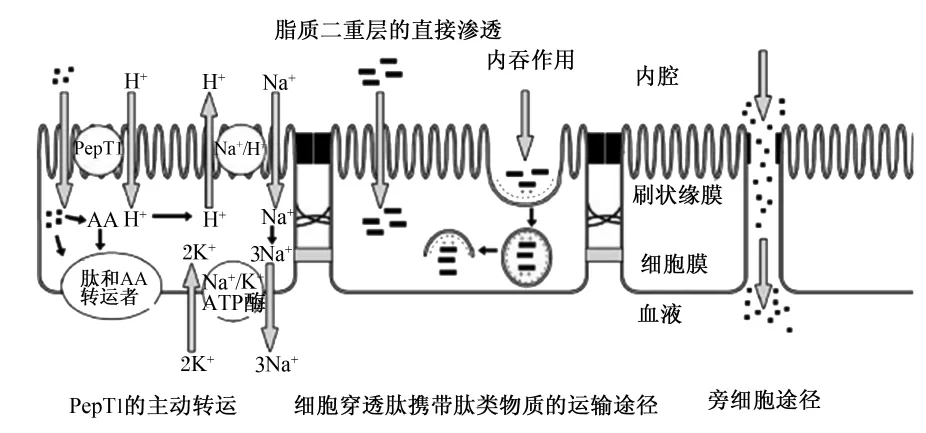
圖3 腸肽吸收的潛在途徑Fig.3 Potential routes of peptide uptake in enterocytes[11]
Bucking等[22]研究證明:對動物進行短期禁食會導致其體內PepT1 mRNA表達水平上調,但長期禁食會導致其下調。在飼養(yǎng)水平恢復后,動物體內PepT1 mRNA水平會逐漸增加到禁食之前。Ma等[24]對野生小鼠進行限飼,發(fā)現(xiàn)其小腸內PepT1 mRNA的表達水平提高2倍。Madsen等[25]通過限飼方法觀察肉雞體內PepT1與過氧化物酶體增殖劑活化受體α(peroxisome proliferatoractivated receptor α,PPARα)表達的關系發(fā)現(xiàn),在肉雞空腹狀態(tài)下,PepT1受到PPARα的監(jiān)管,同時,肉雞采食量的減少會促進其體內PepT1 mRNA的表達。
3.3 底物因素
PepT1的底物對PepT1具有調控作用,且不同底物對PepT1的活性不同。PepT1底物在營養(yǎng)的補充,尤其是游離氨基酸吸收方面起著重要作用,同時PepT1可加速氨基酸的吸收率[19]。有關試驗顯示,對大鼠的十二指腸灌注大豆蛋白水解物和蛋清蛋白水解物后,觀察到這2種物質中的氨基酸被吸收到門靜脈血液的速度比那些氨基酸混合物或具有相同氨基酸組成的完整蛋白質快[26]。Liu 等[27]用 JBP485(cyclo-trans-4-L-h(huán)ydroxyprolyl-L-serine)來處理人的大腸癌細胞(Caco-2)時發(fā)現(xiàn),PepT1 mRNA表達增加了1.5倍,從而確認JBP485是PepT1的底物,影響PepT1吸收調節(jié)機制。由于PepT1具有廣泛的底物特異性,它能夠轉運大約400種二肽和8 000種三肽及一些肽類化合物。底物對PepT1的調節(jié)是通過增加細胞膜上肽轉運蛋白的豐度來實現(xiàn)的。調節(jié)PepT1 mRNA的表達可能有2個途徑:一是增加mRNA編碼基因的穩(wěn)定性;二是增加PepT1 mRNA的轉錄[11]。
3.4 生理因素
動物在生長發(fā)育階段,腸道消化系統(tǒng)需要經歷結構和功能上的改變:出生或孵化階段、哺乳動物斷奶階段。腸道內PepT1的活性為適應這一轉變也會發(fā)生相應的變化。Chen等[28]研究發(fā)現(xiàn),雞從孵化16 d到出殼,其體內PepT1活性快速增加,PepT1 mRNA表達水平提高了14倍,認為在生長發(fā)育過程中,動物為適應采食所做出的反應導致了PepT1的活性調控與PepT1 mRNA的表達發(fā)生變化,但具體的作用機制尚不清楚。
PepT1的活性調控可能與晝夜節(jié)律也有關。Pan等[29]在研究中發(fā)現(xiàn),夜間小鼠體內 PepT1的活性水平會顯著提高,但當小鼠處于空腹或取消白天按時飼喂這一模式后,其體內的PepT1迅速改變,以適應腸道對營養(yǎng)的需求,因此認為PepT1的活性調控具有可塑性,當環(huán)境發(fā)生變化時,PepT1能夠快速適應其變化。
4 小結
PepT1廣泛存在于動物腸道內,是轉運小肽以及肽類化合物的重要因子,具有高特異、高容量等轉運特性,可以最大限度地促進小肽吸收轉運,促進動物生長。目前PepT1的基因已被克隆,大量研究表明可以通過對PepT1的活性進行合理的調控,從而有效調節(jié)小肽吸收轉運,但對PepT1分子水平上的調控依然不很清楚。因此,深入開展PepT1的基因表達調控方面的研究對深入了解動物小肽吸收轉運的機理有重要意義。
[1]HINDLET P,BUYSE M.Regulation of PepT1 by leptin and physiological implications[J].Genes & Nutrition,2010,5(1):15 -17.
[2]INGERSOLL S A,AYYADURAI S,CHARANIA M A,et al.The role and pathophsiological relevance of membrane transporter PepT1 in intestinal inflammation and inflammatory bowel disease[J].American Journal of Physiology,Gastrointestial and Liver Physiology,2012,302(5):G484 -G492.
[3]AGU R,COWLEY E,SHAO D,et al.Proton-coupled oligopeptide transporter(POT)family expression in human nasal epithelium and their drug transport potential[J].Molecular Pharmaceutics,2011,8(3):664 -672.
[4]ZUCCHELLI M,TORKVIST L,BRESSO F,et al.PepT1 oligopeptide transporter(SLC15A1)gene polymorphism in inflammatory bowel disease[J].Inflammatory Bowel Diseases,2009,15(10):1562 -1569.
[5]GUO X J,MENG Q,LIU Q,et al.Construction,identification and application of HeLa cells stably transfected with human PepT1 and PepT2[J].Peptides,2012,34(2):395 -403.
[6]DANIEL H,KOTTRA G.The proton oligopeptide cotransporter family SLC15 in physiology and pharmacology[J].Biomedical and Life Sciences,2004,447(5):610-618.
[7]DANIEL H.Molecular and integrative physiology of intestinal peptide transport[J].Annual Review of Physiology,2004,66:361 -384.
[8]TEROVA G,CORA S,VERRI T,et al.Impact of feed availability on PepT1 mRNA expression levels in sea bass(Dicentrarchus labrax)[J].Aquaculture 2009,294:288-299.
[9]VAN L,PAN Y X,BLOOMQUIST J R,et al.Developmental regulation of a turkeyintestinal peptide transporter(PepT1) [J].Poultry Science,2005,84:75-82.
[10]WANG W,SHI C,ZHANG J,et al.Molecular coling,distribution and ontogenetic expression of the oligopeptide transporter PepT1 mRNA in Tibetan sucking piglets[J].Amino Acids,2009,37(4):593 - 601.
[11]GILBERT E R,WONG E A,WEBB K E.Peptide absorption and utilization:implication for animal nutrition and health[J].Journal of Animal Science,2008,86:2135-2155.
[12]SHIMAKURA J,TERADA T,SHIMADA Y,et al.The transcription factor Cdx2 regulates the intestine specific expression of human peptide transporter 1 through functional interaction with Sp1[J].Biochemical Pharmacology,2006,71:1581 -1588.
[13]SHIMAKURA J,TERADA T,KATSURA T,et al.Characterization ofthe human peptidetransporter PepT1 promoter:Sp1 functions as a basal transcriptional regulator of human PepT1[J].American Journal of Physiology,Gastrointestial and Liver Physiology,2005,289:471 -477.
[14]BAKKE S,JORDAL A E,GOMEZ-REQUENI P,et al.Dietary protein hydrolysates and ferr amino acids affect the spatial expression of peptide transporter PepT1 in the digestive tract of Atlantic cod(Gadus morhua)[J].Comparative Biochemistry and Physiology,2010,156:48 -55.
[15]CHEN H,PAN Y X,WONG E A,et al.Molecular cloning and functional characterization of a chicken intestinal peptide transporter(cPepT1)in Xenopus oocytes and Chinese hamster ovary cells[J].The Journal of Nutrition,2002,132:387 -393.
[16]AMBERG J J,MYR C,KAMISAKA Y,et al.Expression of the oligopeptide transporter,PepT1,in larval Atlantic cod(Gadus morhua)[J].Comparative Biochemistry and Physiology,2008,150:177 -182.
[17]HOWARD A,GOODLAD R,WALTERS J,et al.Increased expression of specific intestinal amino acid and peptide transporter mRNA in rats fed by TPN is reversed by GLP-2[J].The Journal of Nutrition,2004,134:2957 -2964.
[18]HUSSAIN I,KELLETT G,AFFLECK J,et al.Expression and cellular distribution during development of the peptide transporter(PepT1)in the small intestinal epithelium of the rat[J].Cell Tissue Resarch,2002,307:139 -142.
[19]OSTASZEWSKA T,KAMASZWSKIM,GROCHOWSKI P,et al.The effect of peptide absorption on PepT1 gene expression and digestive system hormones in rainbow trout(Oncorhynchus mykiss)[J].Comparative Biochemistry and Physiology,2010,155:107-114.
[20]SUN B W,ZHAO X C,WANG G L,et al.Changes of biological functions of dipeptide transporter(PepT1)and hormonal regulation in severe scald rats[J].World Journal Gastroenterol,2003,9(12):2782-2785.
[21]HINDLET P,BADO A,F(xiàn)ARINOTTI R,et al.Longterm effect of leptin on H+-coupled peptide cotransporter 1 activity and expression in vivo:evidence in leptin-deficient mice[J].The Journal of Pharmacology and Experimental Therapeutics,2007,323:192 -201.
[22]BUCKING C,SCHULTE P M.Environmental and nutritional regulation of expression and function of two peptide transporter(PepT1)isoforms in a euryhaline teleost[J].Comparative Biochemistry and Physiology,2012(161):379 -387.
[23]GILBERT E R,LI H,EMMERSON D A,et al.Dietary protein quality and feed restriction influence abundance of nutrient transporter messenger RNA in the small intestine of broiler chicks[J].The Journal of Nutrition,2008,138:262 -271.
[24]MA K,HU Y,SMITH D E,et al.Influence of fed-fasted state on intestinal PepT1 expression and in vivo pharmacokinetics of glycylsarcosine in wild-type and PepT1 knockout mice[J].Pharmaceutical Research,2012,29(2):535 -545.
[25]MADSEN S L,WONG E A.Expression of the chicken peptide transporter 1 and the peroxisome proliferator-activated receptor α following feed restriction and subsequent refeeding[J].Poultry Science,2011,90(10):2295-300.
[26]KODERA T,HARA H,NISHIMORI Y,et al.Amino acid absorption in portal blood after duodenal infusions of a soy protein hydrolysate prepared by a novel soybean protease D3[J].Journal of Food Science,2006,71:517-525.
[27]LIU Z H,WANG C Y,LIU Q,et al.Uptake,transport and regulation of JBP485 by PEPT1 in vitro and in vivo[J].Peptides,2011,32:747 - 754.
[28]CHEN H,PAN Y X,ERIC A W,et al.Dietary protein level and stage of development affect expression of an intestinal peptide transporter(ePepT1)in chickens[J].The Journal of Nutrition,2005,135(2):193 -198.
[29]PAN X,TERADA T,OKUDA M,et al.The diurnal rhythm ofthe intestinaltransportersSGLT1 and PEPT1 is regulated by the feeding conditions in the rat[J].The Journal of Nutrition,2004,134:2211 -2215.

