反相高效液相色譜法測定蘋果酸發酵液中的有機酸
黃慧敏,張偉國
(江南大學工業生物技術教育部重點實驗室,江蘇無錫,214122)
反相高效液相色譜法測定蘋果酸發酵液中的有機酸
黃慧敏,張偉國
(江南大學工業生物技術教育部重點實驗室,江蘇無錫,214122)
采用反相高效液相色譜法分析測定蘋果酸發酵液中的有機酸,最終確定了適用于發酵液中各種有機酸含量測定的色譜條件,色譜柱:COSMOSIL 5C18-PAQ(4.6 mm I.D.×250 mm);紫外檢測波長:210 nm;流動相:1%乙腈-20 mmol/L KH2PO4溶液(pH 2.8);流速:0.5 mL/min;柱溫:23℃。結果表明,在該條件下蘋果酸發酵液中的7種有機酸都得到了較好分離,方法的回收率為94.2%~102.7%,表明具有較好的準確度和精密度。
反相高效液相色譜法,蘋果酸發酵液,有機酸
L-蘋果酸是一種重要的天然有機酸,其口感接近天然蘋果的酸味,在國外是用量很大的一種酸味劑。在食品、醫藥、印染及化工等方面都有廣泛的用途,已成為繼檸檬酸、乳酸之后用量排第3位的食品酸味劑,是一種很有發展前途的有機酸新產品[1]。
直接發酵法是生產蘋果酸的較有競爭力的方法[12-21],如何快速準確地測定發酵液中的 L-蘋果酸則是發酵過程中首先需要解決的問題。有機酸的定量測定方法有許多種[6-11],而定量分析發酵液中蘋果酸的方法[2]主要有2,7-萘二酚法和反相高效液相色譜法[3-5,8-9]。由于蘋果酸發酵液成分復雜,包括殘糖、菌體、蛋白和各種有機酸等物質,在采用2,7-萘二酚法測定蘋果酸含量時需要使用濃硫酸,而濃硫酸具有強氧化性,可將許多物質氧化包括發酵液中的物質和試管中的殘留雜質,從而對測定結果的準確性產生強烈的干擾;而反相高效液相色譜法操作簡便,準確度高,重現性好,可同時定量多種有機酸,因此已獲得廣泛的應用[11,22-25]。本研究選用日本的 COSMOSIL 5C18-PAQ色譜柱,在磷酸鹽緩沖液中添加適量的乙腈,利用反相高效液相色譜法對蘋果酸發酵液中有機酸進行定量分析。
1 實驗部分
1.1 儀器與試劑
儀器:DIONEX高效液相色譜儀(DIONEX P-680泵、ASI-100自動進樣器、TCC-100柱溫箱)(美國DIONEX公司)。
試劑:草酸、蘋果酸、α-酮戊二酸、檸檬酸、琥珀酸、KH2PO4、H3PO4等均為分析純,購自國藥集團化學試劑有限公司;水為超純水;乙腈為色譜純,購自江蘇漢邦科技有限公司;流動相、對照品和樣品溶液使用前均經0.45 μm的濾膜過濾。
1.2 色譜條件
色譜柱:COSMOSIL 5C18-PAQ(4.6 mm I.D.×250 mm)(日本半井公司);流動相:1%乙腈-20 mmol/L KH2PO4溶液(pH 2.8);流速:0.5 mL/min;進樣量:10 μL;柱溫:23℃;紫外檢測波長:210 nm。
1.3 標準溶液的配制
1.3.1 混合標準溶液的配制
準確稱取草酸16.5 mg、蘋果酸48.3 mg、檸檬酸65.3 mg、丁二酸 91.6 mg、富馬酸 2.4 mg、α-酮戊二酸20.3 mg、丙酮酸25.7 mg,用超純水溶解并定容至100 mL配制成有機酸標準混合溶液。
1.3.2 有機酸系列標準品溶液的配制
分別稱取檸檬酸500 mg、草酸50 mg、丁二酸500 mg、蘋果酸50 mg、富馬酸50 mg、丙酮酸100 mg、α-酮戊二酸100 mg,用超純水溶解并定容至100 mL,各有機酸的濃度分別為:檸檬酸5.0 g/L、草酸0.5 g/L、丁二酸5.0 g/L、蘋果酸0.5 g/L、富馬酸0.5 g/L、丙酮酸1.0 g/L、α-酮戊二酸1.0 g/L。分別取上述各標準溶液 10、20、30、40、50 mL 于 50 mL 的容量瓶中用超純水稀釋至刻度,即得各種有機酸的標準品溶液。即檸檬酸的濃度分別為:1.0、2.0、3.0、4.0、5.0 g/L;草酸的濃度分別為:0.1、0.2、0.3、0.4、0.5 g/L;丁二酸的濃度分別為:1.0、2.0、3.0、4.0、5.0 g/L;蘋果酸的濃度分別為:0.1、0.2、0.3、0.4、0.5 g/L;富馬酸的濃度分別為:0.1、0.2、0.3、0.4、0.5 g/L;丙酮酸的濃度分別為:0.2、0.4、0.6、0.8、1.0 g/L;α-酮戊二酸的濃度分別為:0.2、0.4、0.6、0.8、1.0 g/L。
1.4 樣品液的處理
取不同發酵周期的蘋果酸發酵液,離心(8000 r/min,10 min)去除菌體和CaCO3,然后取上清液加入稀H2SO4酸解充分后,使有機酸游離出來,再離心去除CaSO4,進樣前分別使用0.45 μm濾膜過濾處理即得待測液。
2 結果與討論
2.1 檢測波長的確定
在200~400 nm的波長范圍內對草酸、蘋果酸、丙酮酸、酮戊二酸、檸檬酸、丁二酸、富馬酸進行紫外波長掃描,結果(圖1)表明,7種有機酸在210 nm附近均有較強吸收,所以選擇在210 nm處檢測有機酸。
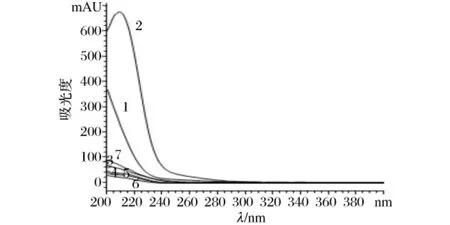
圖1 7種有機酸的紫外掃描圖
2.2 混合流動相組成的確定
若流動相只是磷酸鹽溶液,發酵液中的有機酸分離效果較差,且分析時間長達30 min。在流動相中加入少量乙腈能夠明顯縮短各種有機酸的保留時間且改善峰形。所以本實驗考察了在流動相中添加不同濃度的乙腈對有機酸分離度的影響,實驗結果表明,適當增加乙腈的濃度有利于有機酸的分離,當乙腈在流動相中的濃度增加時,各種有機酸的保留時間降低,峰形漸好,但是乙腈的濃度較大,會導致蘋果酸與α-酮戊二酸分離效果較差。經多次試驗,發現當乙腈在流動相中的濃度為1%時,各種有機酸的分離效果、峰形較好且保留時間較短。
2.3 流動相pH值的確定
將流動相的pH值用磷酸分別調至2.0、2.2、2.4、2.6、2.8、3.0,分析不同的 pH 值對各種有機酸的分離效果的影響。結果表明,流動相pH的變化對有機酸的分離效果影響很大。當pH值為2.0時,檸檬酸與丁二酸分離效果較差,隨著pH值的升高,檸檬酸與丁二酸逐漸分開,到pH值為2.6時二者完全分開,之后二者的分離度增大;當pH值為2.8時,各種有機酸能夠得到較好的分離;當pH值為3.0時蘋果酸與丙酮酸的分離度減少。所以選定流動相的最佳pH值為2.8。
2.4 流動相磷酸鹽濃度的選擇
將流動相中的磷酸二氫鉀-磷酸溶液(pH 2.8)的濃度分別配制成 0、10、20、50、80 mmol/L,考察對各種有機酸的分離效果的影響。結果表明,在不同的KH2PO4濃度下各有機酸的出峰時間及出峰順序均無較大差異,但當流動相中不含有磷酸鹽時,各有機酸分離效果不好;逐漸增加流動相中磷酸鹽的濃度,各種有機酸均能得到有效分離,且不影響分離效果。但是由于較高濃度的鹽會對柱子和泵的使用壽命產生影響,所以本實驗選用20 mmol/L的KH2PO4溶液作為流動相。
2.5 柱溫、流動相流速的選擇
在色譜柱溫度分別為 28、25、23、20℃時,考察各種有機酸的分離效果。由結果可知,溫度越高,傳質過程越快,有機酸保留時間越小,分離度降低,且丙酮酸與蘋果酸不能有效地分離;當溫度逐漸降低,丙酮酸與蘋果酸逐漸開始分離;當溫度為20℃時,有機酸的保留時間較長;當溫度為23℃時各種有機酸的分離效果較好,所以選擇柱溫為23℃。經過考察不同流動相流速對有機酸分離效果的影響可知:流動相流速太快,各種有機酸的峰分離效果不好,流速太慢,峰的保留時間太長,并且影響峰的形態。當流動相流速為0.5 mL/min時可達到快速分離而不影響柱效,所以確定流速為0.5mL/min。
2.6 標準曲線及檢出限
將7種有機酸的標準品溶液在2.2的色譜條件下進行HPLC分析,平行測定6次,得到各種有機酸的線性回歸曲線方程、相關系數,以3倍信噪比(S/N)計算最小檢出限量,結果見表1。
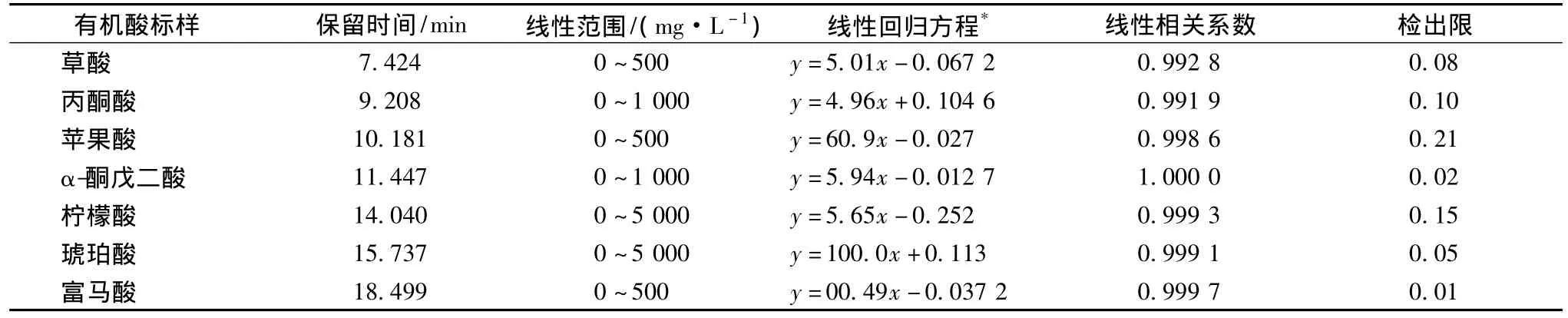
表1 七種有機酸標樣的線性回歸方程及檢出限
2.7 液相色譜圖
以最優色譜分離條件對有機酸標準混合樣品和蘋果酸發酵液進行HPLC分析,圖2、圖3分別為有機酸標樣和蘋果酸發酵液樣品的色譜圖。
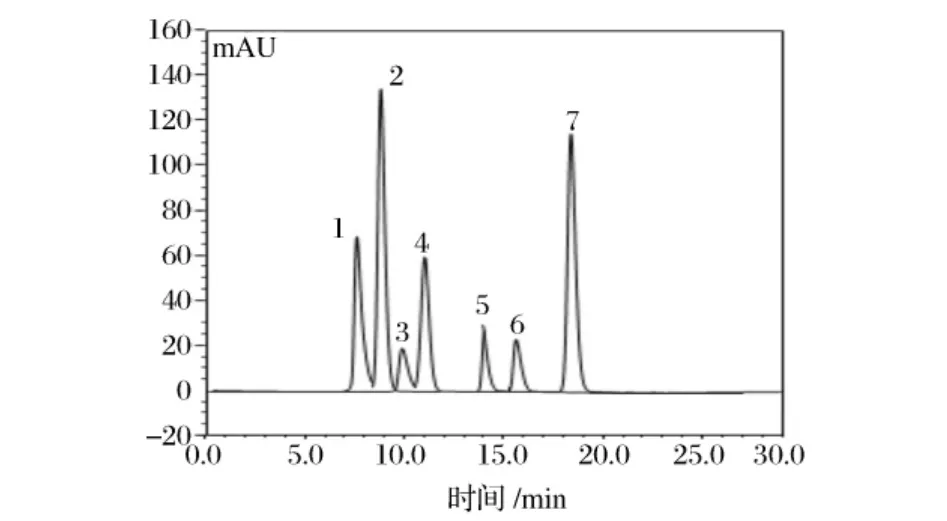
圖2 有機酸標準混合溶液的色譜圖
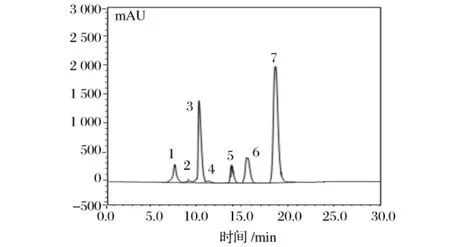
圖3 蘋果酸發酵液的色譜圖
2.8 發酵液中有機酸的成分分析
在1.2所述的色譜條件下對不同時期的蘋果酸發酵液進行HPLC分析,進樣量為10μL,確定發酵液中除了蘋果酸外,還有草酸等副產物,檢測結果經過表1所示的線性回歸方程分析,得出各有機酸的含量變化如表2所示。
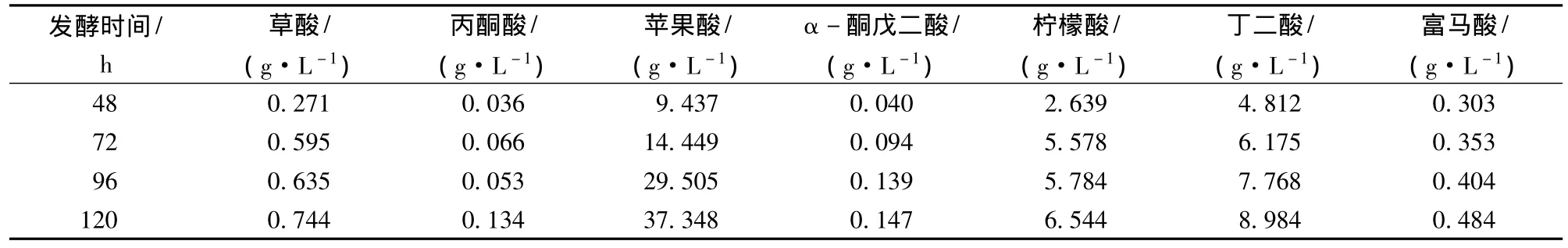
表2 不同發酵時間蘋果酸發酵液中有機酸含量測定結果
2.9 回收率實驗
取蘋果酸的發酵液3份,分別加入一定量的有機酸標準混合溶液,平行測定3次,經0.45 μm濾膜過濾后,按1.2的色譜方法測定樣品的回收率,結果見表3,從分析結果可知7種有機酸的加標回收率為94.2%~102.7%。表明該方法的準確性好。
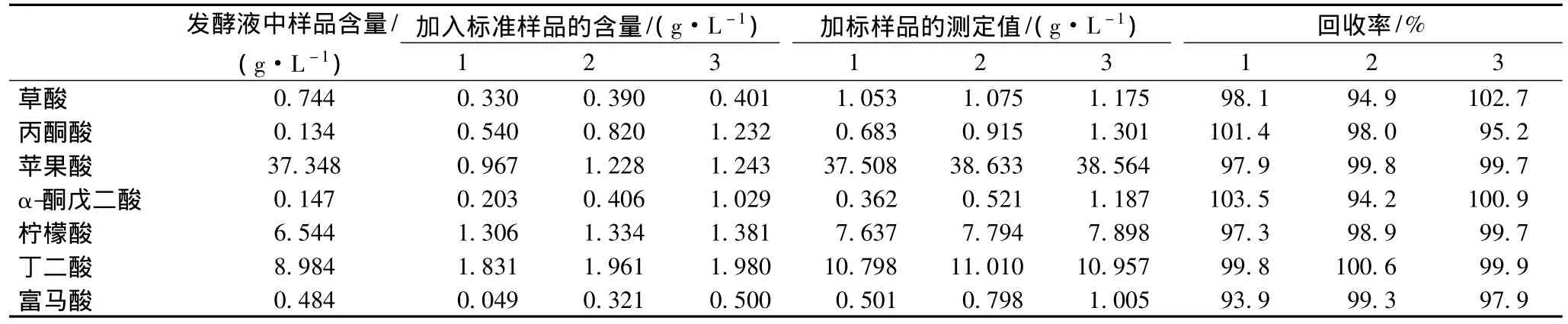
表3 發酵液中各種有機酸的回收率實驗結果
2.10 精密度實驗
取處理好的蘋果酸發酵液樣品在1.2的條件下進行6次平行測定,考察方法的精密度。結果如表4所示,由于精密度RSD<5%,表明該方法有較好的重現性。
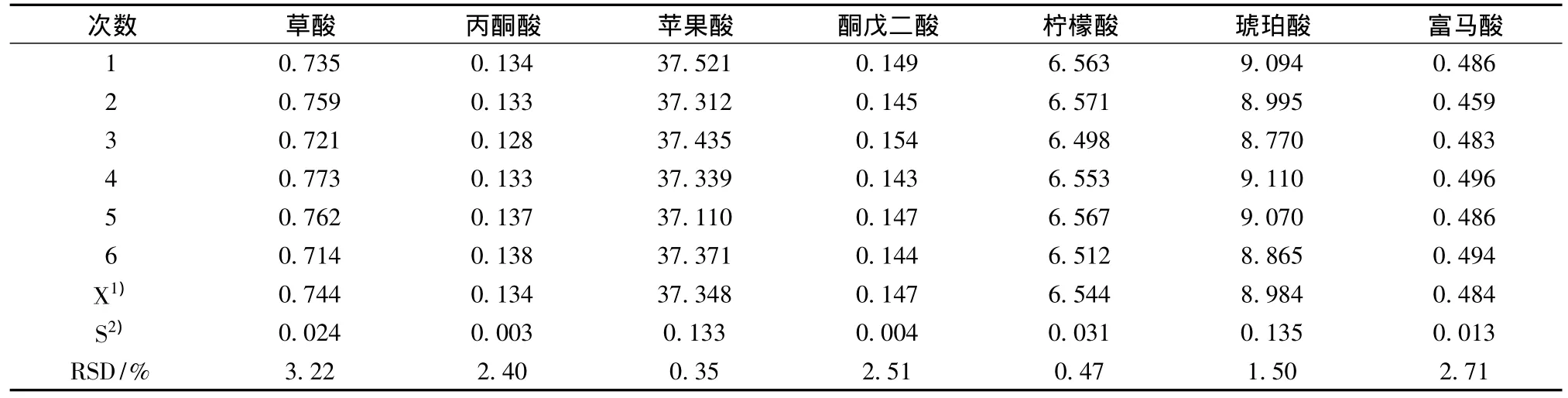
表4 發酵液中各種有機酸的精密度實驗結果 g/L
2.11 穩定性試驗
在室溫和-4℃冰箱中放置一定的時間,分別取樣測得發酵液中各種有機酸的含量,發現各有機酸的濃度在24 h內基本不變,結果表明蘋果酸發酵液在24 h內是穩定的。
3 結論
適用于發酵液中各種有機酸含量測定的檢測條件為:使用 COSMOSIL 5C18-PAQ(4.6 mm I.D.×250 mm)色譜柱;紫外檢測波長為210 nm;采用1%乙腈-20 mmol/L磷酸二氫鉀緩沖液(pH 2.8)作為流動相;流速:0.5 mL/min;進樣量:10 μL;柱溫:23℃。在該條件下蘋果酸發酵液中的7種有機酸都得到了較好的分離且回收率高,重現性較好。
[1]劉建軍,姜魯燕,趙祥穎,等.蘋果酸的應用及研究進展[J].中國食品添加劑,2003(3):53-56.
[2]尹志梅,楊清,吳秀敏,等.L-蘋果酸定量檢測方法[J].中國釀造,1999(4):33-34.
[3]黃桂穎,白衛東,楊幼慧,等.反相高效液相色譜法測定荔枝肉中 10種有機酸[J].現代食品科技,2009,25(5):568-570.
[4]高海燕,廖小軍,王善廣,等.反相高效液相色譜法測定果汁中11種有機酸條件的優化[J].分析化學,2004,32(12):1645-1648.
[5]林維宜,房學軍,楊紅,等.高效液相色譜法測定山楂中有機酸研究[J].大連輕工業學院學報,1992,11(3/4):21-24.
[6]崔雨林,戴蘊青,韓雅珊.高效液相色譜法測定水果及果汁中的有機酸[J].北京農業大學學報,1995,21(1):39-43.
[7]丁明玉,陳培榕,羅國安.食品中有機酸的高效液相色譜分析法[J].色譜,1997,15(3):212-215.
[8]高海燕,王善廣,胡小松,等.利用反相高效液相色譜法測定梨汁中有機酸的種類和含量[J].食品與發酵工業,2004,30(8):96-100.
[9]宋永康,韓嘉,潘葳,等.影響測定反相高效液相色譜流動相pH值的因素[J].現代科學儀器,2005(1):95-97.
[10]文姝,劉欣,袁杰利,等乳桿菌、雙歧桿菌代謝產物的氣相色譜分析[J].中國微生態學雜志,2004(16):221-222.
[11]李友元,陳長華,陶萍.高效液相色譜法測定螺旋霉素發酵液中的有機酸[J].色譜,2002,20(1):46-48.
[12]Hong SH,Lee SY.Metabolic flux analysis for Succinic acid production by recombinant Escherichia coli with amplified malic enzyme acitivity[J].Biotechnology and Bioengineering,2001,74(2):89-95.
[13]Soo Yun Moon,Soon Ho Hong,et al.Metabolic engineering of Escherichia coli for the production of malic acid[J].Biochemical Engineering Journal,2008,40(2):312-320.
[14]胡純鏗.L-蘋果酸產生菌黃曲霉H298發酵特性的研究[J].食品與發酵工業,1999,25(2):19-22.
[15] 金其榮,張繼民,徐勤.有機酸發酵工藝學[M].北京:中國輕工業出版社,1989:339-406.
[16]周小燕,吳清平,蔡芷荷,等.曲霉N1-14'胞質酶活性與產L-蘋果酸能力的關系[J].微生物學報,2000,40(5):500-505.
[17]Ok Taing,Kazuya.Taing.Production of malic and succinic acids by sugar-tolerant yeast Zygosaccharomyces rouxii[J].Eur Food Res Technol,2007,224(3):343-347.
[18]Roa Engel C A,Straathof A J,Zijlmans T W,et al.Fumar-ic Acid Production by Fermentation[J].Appl Microbiol Biotechnol,2008,78(3):379-389.
[19]Battat E,Peleg Y,Bercovitz A,et al.Optimization of L-malic acid production by Aspergillus flavus in a stirred fermentor[J].Biotechnology and Bioengineering,1991,37(11):1108-1116.
[20]吳清平,周小燕,鐘瑜,等.L-蘋果酸產生菌的篩選及高產突變株誘變選育[J].真菌學報,1993,12(4):304-312.
[21]劉寧,李霜,何皓,等.少根根霉利用木糖和葡萄糖分步發酵制備富馬酸[J].過程工程學報,2008,8(4):716-719.
[22]Omole O O,Brocks D R,Nappert G,et al.High-performance liquid chromatographic assay of L-lactic acid and its enantiomers in calf serum[J].Journal of Chromatograph B,1999,727(1):23-29.
[23]白冬梅,杜國民,趙學明,等.反相高效液相色譜法測定產琥珀酸放線桿菌發酵液中的有機酸[J].分析化學,2003,3l(12):1496-1499.
[24]錢兵,章燕,李莎,等.反相高效液相色譜法測定丙酸發酵液中的有機酸[J].分析化學,2007,35(11):1651-1653.
[25]史春云,田晶,馬延和,等.反相高效液相色譜法測定嗜堿微生物發酵液中有機酸[J].食品與發酵工業,2007,33(4):116-118.
ABSTRACTReversed phase HPLC method was applied to determine organic acid in malic acid fermentation liquor in this paper.The chromatographic conditions are finally conformed to apply to all kinds of organic acid content determination in the fermentation.The conditions are as follows:COSMOSIL 5C18-PAQ column(4.6 mm I.D.×250 mm)was used at 23℃.UV detection wavelength was 210 nm.Solution containing 1%acetonitrile and 20mmol/L KH2PO4at pH 2.8 was used as mobile phase with flow rate of 0.5 mL/min.The seven organic acids in malic acid fermentation liquor were preferably separated under these conditions.The recovery ratio was 94.2%~102.7%and the method had good accuracy and precision.
Key wordsreversed phase HPLC,malic acid fermentation liquor,organic acids
Determination of Organic Acids in Malic Acid Fermentation Liquor by Reversed Phase HPLC Method
Huang Hui-min,Zhang Wei-guo
(Key Laboratory of Industrial Biotechnology of Ministry of Education,Jiangnan University,Wuxi 214122,China)
碩士研究生。
2012-01-17,改回日期:2012-04-09

