番茄早疫病拮抗放線菌的篩選
袁 鶴,沈志紅,楊麗麗,李 凱
(山西舜天農業微生物科學技術研究院,山西陽泉045000)
番茄早疫病又稱輪紋病,是由茄鏈格孢菌(Alternaria solani)所導致的一種番茄重要病害之一,也是一種世界性病害。其在美國、澳大利亞、印度、希臘等地發病率都很高,嚴重時可使產量損失35%~78%[1]。番茄早疫病在我國河北、山西、黑龍江、湖北、江蘇、浙江等大部分地區也普遍發生,為害日趨嚴重。目前,全國各地均有發生,已經成為露地、保護地番茄生產中的主要病害,對番茄產量影響很大,一般減產30%左右,嚴重時可達50%以上[2]。
目前,生產上通常使用百菌清、敵克松、多菌靈等化學藥劑對番茄早疫病進行防治。化學防治是控制早疫病的有效方法,具有見效快、殺菌譜廣、成本低、使用簡便等優點[3],但化學殺菌劑的長期反復大量使用會引起其自身在土壤和作物上的殘留,對土壤、地下水、大氣造成污染,破壞生態平衡,尤其給子孫后代的生存、健康帶來威脅。隨著近年來人們對環境問題的日益關注和對綠色食品的需求,生物防治以其高效且無毒、無害、無污染、不產生抗藥性的特點越來越受到研究者的重視。
放線菌是產生農用抗生素的重要生物資源,其在植物病害生物防治中具有很好的應用前景[4]。尋找和篩選拮抗番茄早疫病的生防菌是早疫病防治的重要工作。
本研究以番茄早疫病菌為靶標病原菌,從不同感病番茄的田間土壤中篩選拮抗作用強的放線菌,以期為番茄早疫病的生物防治提供具有生防效果的菌株。
1 材料和方法
1.1 材料
供試放線菌分離自番茄栽培地土壤(陽泉市平定縣南坪村)。供試的番茄早疫病菌由河北省科學院提供。放線菌的分離和保存采用高氏一號培養基,拮抗放線菌株的篩選及病原菌株的培養均采用馬鈴薯培養基(PDA)。
1.2 方法
1.2.1 土壤中放線菌的分離與純化 將采自番茄栽培地的土樣自然風干,過0.25 mm篩[5],稱取5 g烘干的土壤樣品,置于盛有45 mL無菌水的三角瓶中,充分振蕩,靜置10 min,采用平板梯度稀釋法分離放線菌。于高氏一號培養基上28℃培養5~7 d,根據菌落形態、色澤、氣生菌絲的有無、產色素情況等特點,初步鑒定為放線菌[6-8],并對分離到的放線菌菌落進行編號。經純化后的菌株于高氏一號斜面培養基上培養7~14 d后于4℃保存。
1.2.2 拮抗放線菌的初篩 從斜面刮取放線菌孢子配成濃度為106個/mL的孢子懸浮液,吸取10 mL接入裝有100 mL發酵培養基的250 mL搖瓶中,于28℃,150 r/min培養4 d。從斜面刮取番茄早疫病菌接種于PDA平板,于26℃培養,待菌落長滿平板備用。
篩選拮抗放線菌時,用直徑7 mm的打孔器在長滿番茄早疫病菌的PDA平板上打孔,將打下的菌餅接入待測的PDA平板中央;將放線菌發酵液過濾獲得無菌濾液,用滅菌的濾紙片(直徑7 mm)均勻地吸足發酵液后,以對角線的方式對稱地放在菌餅四周[8],26℃培養7 d后觀察抑菌效果,重復3次。以接種番茄早疫病菌但不放置放線菌發酵液紙片的平板為對照。
1.2.3 拮抗放線菌的復篩 將初篩得到的具有拮抗效果的放線菌,采用紙片擴散法進行復篩。在PDA平板中央接入番茄早疫病病菌菌餅,用滅菌的濾紙片(直徑7 mm)均勻地吸足發酵液后,以對角線的方式對稱地放在菌餅四周[9],放置時以3張濾紙片層疊,以保證吸有足夠的放線菌發酵液來抑制病原菌,26℃培養7 d后觀察抑菌效果,重復3次。以接種番茄早疫病菌但不放置放線菌發酵液紙片的平板為對照。
1.2.4 拮抗放線菌的形態觀察 采用插片法[10]培養待鑒定的拮抗菌株,在顯微鏡下觀察菌絲和孢子絲的形態。
2 結果與分析
2.1 放線菌的分離與純化
從感染番茄早疫病的土壤樣品中經過梯度稀釋分離后,根據菌落形態、大小、色澤等對具有不同生長特征的菌落進行編號,從平板上挑取菌落,分離純化后共得到放線菌32株。
2.2 拮抗放線菌的初篩和復篩
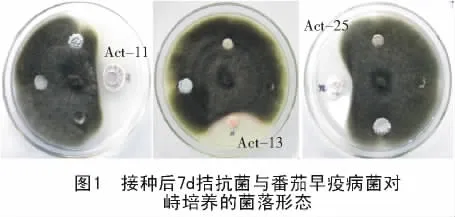
將番茄早疫病菌菌餅接入PDA平板中央,在其對角線等距離分別放入吸足32株放線菌發酵液的濾紙片。培養7 d后,初步篩出對番茄早疫病菌生長有拮抗效果的放線菌8株。將這8株放線菌,采用紙片擴散法進行復篩,最終篩選出對番茄早疫病菌具有明顯拮抗效果的放線菌3株,編號分別為 Act-11,Act-13,Act-25。
從圖1可以看出,將番茄早疫病菌與拮抗菌在PDA平板上對峙培養7 d后,拮抗菌對病原菌菌落生長產生明顯的抑菌帶,靠近拮抗菌邊緣處的病原菌不能正常向外擴展,并且邊緣菌絲變得彎曲。另外,對番茄早疫病菌沒有拮抗效果的放線菌不影響病原菌菌絲的正常生長,菌絲可繞過濾紙片向外擴展生長。
2.3 拮抗放線菌的形態觀察
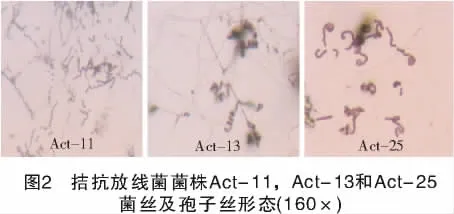
在高氏一號培養基上,菌株Act-11氣生菌絲為淺粉紅色,基內菌絲淺黃色,無可溶性色素產生;菌絲易斷裂,孢子絲螺旋。菌株Act-13氣生菌絲灰至灰褐色,基內菌絲褐灰色至褐色,無可溶性色素產生;菌絲生長良好,不斷裂,孢子絲螺旋。菌株Act-25氣生菌絲淡綠灰黃色至灰色,基內菌絲黃褐色,無可溶性色素產生;孢子絲直或波曲(圖2)。
3 結論與討論
本研究通過對感病番茄土壤中的放線菌進行分離篩選,獲得3株對番茄早疫病菌具有較好抑制作用的拮抗放線菌,且3株放線菌都是通過發酵產物抑制病原菌的生長。
我國是一個農業大國,每年的病蟲害發生面積達2.0億~2.6億hm2,農藥的用量達數10萬t,且我國的農藥結構極不合理,基本上以化學農藥占主導,其中,高毒、高殘留、對環境影響大的農藥用量占1/2以上[11],因此,開發新型生物農藥是減少化學農藥用量的有效途徑之一,也符合發展綠色生態農業的要求。
我國已經開展關于番茄早疫病生物防治研究,但國內用以防治番茄早疫病菌的生防菌或生防制劑均還處于實驗室研究階段或小試階段[12]。高芬等[13]從漚肥浸漬液中分離菌株來篩選對番茄早疫病菌有抑菌效果的拮抗菌,通過平皿對峙拮抗和液體培養篩選,結果篩選出6株抑菌效果較好的菌株。楊冬靜等[14]采用杯碟法測定表明,枯草芽孢桿菌NJ-18菌株對番茄早疫病菌的菌絲生長有強烈拮抗作用;利用利福平抗性標記證明NJ-18能夠在番茄根、莖、葉內定殖;NJ-18發酵液噴施處理盆栽番茄苗后接種,14 d后對番茄早疫病的防治效果達72.9%,顯著高于50%異菌脲2 000倍液45.7%的防治效果。
本研究篩選出Act-11,Act-13和Act-25共3株放線菌對番茄早疫病有很強的抑菌活性,是較好的防治早疫病的有益微生物,從中開發出新型、高效、無毒的天然農用殺菌劑的潛力十分巨大,為番茄病害的生物防治提供可能,對實現番茄早疫病的安全、有效防治具有十分重要的意義。3株拮抗菌的獲得不僅為開發出廉價、高效的生物農藥奠定了菌種基礎,而且為進一步研究番茄早疫病高效拮抗菌的拮抗機制提供了試驗基礎。
[1] Vloutoglou SN,Kalogerakis.Effect of inoculums concentration,wetness duration and plant age on development of early blight(Alternaria solani)and on sheddingof leaves in tomatoplant[J].Plant Pathology,2001,49(3):314-315.
[2]趙士敏,劉亦學,劉煥祿.保護地番茄早疫病研究初探[J].天津農業科學,1996,2(4):13-15.
[3]趙亞蘭,朱圣杰,任素櫻.番茄早疫病的綜合防治[J].河套大學學報,2010,7(4):23-25,26.
[4]阮云飛,穆瑞霞,王吉慶,等.放線菌F24發酵液對灰霉菌拮抗作用初探[J].河南農業科學,2008(11):84-86,106.
[5]秦涵淳,楊臘英,李松偉,等.香蕉鐮刀菌枯萎病拮抗放線菌的分離篩選及其抑制效果的初步評價 [J].中國生物防治,2010,26(2):174-180.
[6]中國科學院微生物研究所放線菌分類組.鏈霉菌鑒定手冊[M].北京:科學出版社,1975:11-14.
[7]王蘭英.生防放線菌的分離篩選及鑒定[D].呼和浩特:內蒙古農業大學,2006.
[8]鄭雅楠,楊宇,呂國忠,等.土壤放線菌分離方法研究[J].安徽農業科學,2006,34(6):1167-1168,1170.
[9]李新,紀明山.土壤中拮抗放線菌的分離和篩選[J].河南農業科學,2008(1):58-60.
[10]周德慶.微生物學實驗教程 [M].北京:高等教育出版社,2006:56-58.
[11]趙麗明,丁延芹,路曉萌,等.西瓜根際枯萎病拮抗放線菌的篩選及鑒定[J].生物技術通訊,2010(5):107-110.
[12]何建清,張格杰,岳海梅,等.番茄早疫病菌拮抗放線菌10-4的鑒定[J].植物保護學報,2010,37(4):308-312.
[13]高芬,馬利平,喬雄梧.對番茄早疫病拮抗菌的篩選[J].山西農業科學,2001,29(3):64-66.
[14]楊冬靜,王建新,周明國.Bacillus subtilis NJ-18菌株對番茄早疫病菌的頡頏作用研究 [J].微生物學通報,2009,36(8):1166-1169.

