新型鹽酸米諾環(huán)素緩釋凝膠對牙周致病菌的緩釋抑菌作用
支 敏,靳趁心,劉俊義,梁曉飛,常 津,王永蘭
(天津:1.天津醫(yī)科大學(xué)口腔醫(yī)院牙周科,300070;2.天津大學(xué)材料學(xué)院納米生物技術(shù)研究所,300072)
牙周病是以厭氧菌感染為主的慢性感染性疾病,牙周致病菌的破壞作用和宿主對抗病原菌的免疫反應(yīng)是造成牙周組織破壞和骨吸收的主要原因。臨床治療牙周病的關(guān)鍵是菌斑控制,常規(guī)治療方法有潔、刮治術(shù),但對于牙周組織破壞嚴重、牙周袋較深且結(jié)構(gòu)復(fù)雜的牙周炎以及伴有糖尿病等全身性疾病的患者則需輔以全身和局部用藥。牙周袋局部用藥能夠提高牙周袋內(nèi)藥物濃度,減少用藥總量,較全身用藥具有更多的優(yōu)勢,特別是近年發(fā)展起來的緩控釋給藥系統(tǒng),可進一步延長藥物作用時間,具有重要的臨床意義。
鹽酸米諾環(huán)素是半合成四環(huán)素類抗生素,有較強的殺菌、抑菌活性及調(diào)節(jié)宿主反應(yīng)的作用:可抑制膠原酶活性,阻止牙槽骨吸收,有利于破壞的牙周組織獲得再附著。將其制成緩釋凝膠局部使用可避免全身用藥的副作用,同時延長制劑的停留時間,并能以最小的劑量達到最大的療效,從而減少用藥總量。
本實驗以羧甲基殼聚糖十八烷基季銨鹽(OQCMC)作為乳化劑與PLGA和羥乙基纖維素復(fù)合構(gòu)建一種多功能的緩釋微球體系,并選擇卡波姆將其制備成凝膠制劑;通過濾紙片擴散法觀察其對牙周可疑致病菌(Pg、Fn、Av、Pi)的緩釋抑菌作用,為臨床應(yīng)用提供實驗室依據(jù)。
1 材料和方法
1.1 主要材料和儀器
牙齦卟啉單胞菌(Porphyromanus gingivalis,Pg)ATCC33277、中間普氏菌(Prevotella intermedia,Pi)ATCC25611、粘性放線菌(Actinomyces Viscosus,Av)ATCC19246、具核梭形桿菌(Fusobacterium nucleatum,F(xiàn)n)ATCC10953(首都醫(yī)科大學(xué)口腔醫(yī)學(xué)研究所);鹽酸米諾環(huán)素(MINO,華北制藥廠);聚乙二醇-羧甲基殼聚糖十八烷基季銨鹽(PEG-OQCMC)(天津大學(xué)材料學(xué)院納米生物技術(shù)研究所提供);CDC厭氧血瓊脂培養(yǎng)基、胰蛋白胨大豆肉湯瓊脂培養(yǎng)基(天津市金章科技發(fā)展有限公司);電子天平(賽多利斯天平儀器廠),超聲波細胞粉碎機(上海新芝生物技術(shù)研究所)旋轉(zhuǎn)蒸發(fā)器(上海振捷實驗設(shè)備有限公司),厭氧缸及厭氧產(chǎn)氣袋(Oxoid公司,英國),細菌電子比濁儀(法國生物梅里埃公司),游標(biāo)卡尺(廣州廣精精密儀器有限公司)。
1.2 方法
1.2.1 鹽酸米諾環(huán)素緩釋凝膠和非緩釋凝膠的制備
1.2.1.1 鹽酸米諾環(huán)素緩釋凝膠的制備
分別稱取適量鹽酸米諾環(huán)素、乳化劑OQCMC、膽固醇(Chol)和PEG-OQCMC溶于0.5 mL去離子水中,作為內(nèi)水相;將一定分子量的乳酸-羥基乙酸共聚物(PLGA)溶于1.5 mL二氯甲烷中,作為油相;稱取一定量的羥乙基纖維素(HEC)溶于10 mL水中,作為外水相。然后在超聲條件下,先將內(nèi)水相加入到油相中,待形成穩(wěn)定初乳后,再將外水相加入到初乳液中使之形成復(fù)乳,并通過攪拌使溶劑完全揮發(fā),水洗3次,干燥得固化的復(fù)合載藥緩釋微球(整個過程中避光),最后分級離心、洗滌、凍干,低溫避光保存?zhèn)溆谩?/p>
用電子天平分別準確稱取一定質(zhì)量的PEG-OQCMC/OQCMC/Chol復(fù)合載藥緩釋微球和卡波姆(CP)一并置于容器中,加入一定質(zhì)量的水在磁性攪拌器上邊溶解邊攪拌,使兩者混合均勻并充分溶解后,滴加一定質(zhì)量的甘油隔夜處理以使CP充分的溶脹,然后再在攪拌的條件下,滴加0.1 mol/L的氫氧化鈉液至混合物變?yōu)橹行裕罱K得到淡黃色凝膠體,冰箱冷藏備用。
1.2.1.2 鹽酸米諾環(huán)素非緩釋凝膠的制備
用電子天平分別準確稱取一定質(zhì)量的卡波姆和鹽酸米諾環(huán)素,加入一定質(zhì)量的水在磁性攪拌器上邊溶解邊攪拌,使兩者混合均勻并充分溶解后,加入一定質(zhì)量的甘油隔夜處理以使卡波姆充分的溶脹,然后再在攪拌的條件下,滴加0.1 mol/L的氫氧化鈉液至混合物變?yōu)橹行裕罱K得到淡黃色凝膠體,冰箱冷藏備用。
1.2.2 鹽酸米諾環(huán)素緩釋凝膠和非緩釋凝膠的體外釋放
用電子天平分別稱取一定質(zhì)量的鹽酸米諾環(huán)素緩釋凝膠和非緩釋凝膠,分別放入盛有3 mL PBS(pH=7.9)的透析袋(MW=12 000)中,再將透析袋放入含有12 mL PBS的離心管中一并置于恒溫水浴搖床上,在避光條件下以恒定的速度進行釋放實驗。分別于實驗后 1、3、5 h 和 1、3、5、7 d 每個時間點從離心管中各取出2.5 mL PBS用于后述實驗。每次取樣后均再向離心管中補入相同體積的PBS。
1.2.3 鹽酸米諾環(huán)素緩釋凝膠和非緩釋凝膠的緩釋抑菌實驗
1.2.3.1 藥敏紙片的制備
以打孔器將Wattman3號濾紙制成直徑6 mm的圓形濾紙片置于玻璃器中,高壓滅菌后分別于每個濾紙片上滴加一種不同凝膠不同時間點的PBS緩釋液各10 μL(含藥量30 μg),待藥物均勻分配在濾紙片上,35℃干燥,-20℃冰箱保存?zhèn)溆谩?/p>
1.2.3.2 細菌復(fù)蘇
分別取牙齦卟啉單胞菌(Pg)、具核梭桿菌(Fn)、中間普氏菌(Pi)、粘性放線菌(Av)標(biāo)準菌株用0.2 mL無菌生理鹽水溶解后,接種于厭氧環(huán)境下預(yù)還原的CDC厭氧血瓊脂平皿上,放入加有厭氧產(chǎn)氣袋的厭氧罐中,37℃,厭氧條件(800 mL/L N2、100 mL/L CO2、100 mL/L H2)下培養(yǎng) 48 h。
1.2.3.3 體外藥敏實驗
用無菌接種環(huán)挑取生長在平板上的各被檢菌落,以無菌生理鹽水溶解制成菌懸液,并用細菌電子比濁儀調(diào)細菌液濃度為0.5麥氏單位(1.5×108/mL)。然后用滅菌棉拭子蘸取各菌液(先在管壁上旋轉(zhuǎn)擠壓1~2次,去掉過多的菌液),在CDC厭氧血瓊脂平皿表面劃動3次,每次劃動時平板轉(zhuǎn)動60°使菌懸液均勻涂布,最后沿平皿周邊繞兩周,保證均勻涂布整個培養(yǎng)皿表面。待平板上的水分被瓊脂完全吸收后,將藥敏紙片均勻貼在瓊脂表面,并做好標(biāo)記,置于厭氧罐(800 mL/L N2、100 mL/L CO2、100 mL/L H2)中,37 ℃培養(yǎng)。48 h后分別用卡尺測量各含藥濾紙片周圍圓形無細菌生長區(qū)的大小,即抑菌環(huán)直徑(mm),以肉眼未見細菌明顯生長的區(qū)域為抑菌環(huán)邊緣,抑菌環(huán)內(nèi)有很難辨認的少數(shù)細小菌落不計在內(nèi)。實驗重復(fù)5次,取均值。
1.3 統(tǒng)計學(xué)分析
2 結(jié)果
2.1 載藥微球及緩釋凝膠的理化性
本實驗所制的載藥緩釋凝膠為淡黃色凝膠體,其粒徑比較均一,大約在100 nm左右,形貌基本為球形;且可看出有明顯的核殼結(jié)構(gòu)(圖1~2)。

圖1 載藥緩釋凝膠

圖2 載藥微球的透射電鏡照片
2.2 緩釋及非緩釋凝膠的抑菌作用比較
緩釋凝膠組的緩釋液對Pg、Fn、Av、Pi的抑菌作用均可持續(xù)到7 d,而非緩釋組的抑菌作用除對Pi可持續(xù)5 d外,對其他3種菌株只能持續(xù)3 d(圖3~4)。2種凝膠不同時間釋放液對各菌株的抑菌直徑相比,1 h時非緩釋組對各菌株的抑菌直徑均大于緩釋組,除 Av外,差異均有統(tǒng)計學(xué)意義(P<0.05);此后,緩釋組各時間點對各菌株的抑菌直徑均大于非緩釋組,其中Fn在1 h和1、3、5、7 d時,Pg 和Pi在1、3、5、7 d 時,Av在3、5、7 d 時兩組的差異均有統(tǒng)計學(xué)意義,(P<0.05)(表1)。表明本實驗制備的載藥緩釋凝膠具有較好的緩釋抑菌效果。
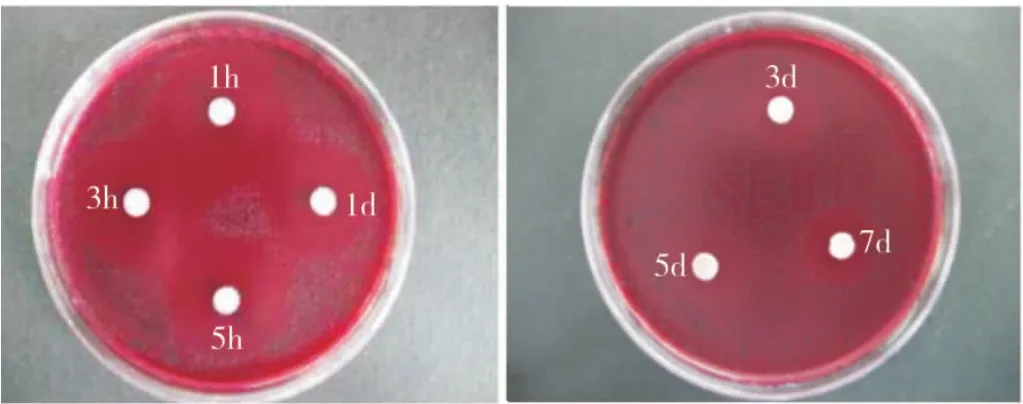
圖3 緩釋凝膠不同時間釋放液對Pi的抑菌環(huán)
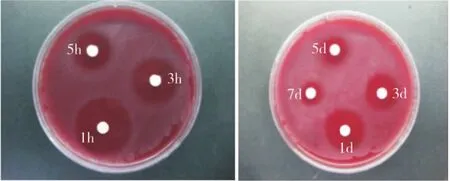
圖4 非緩釋凝膠不同時間釋放液對Pi的抑菌環(huán)
表12 種凝膠各時間釋放液對各菌株的抑菌直徑比較(mms)
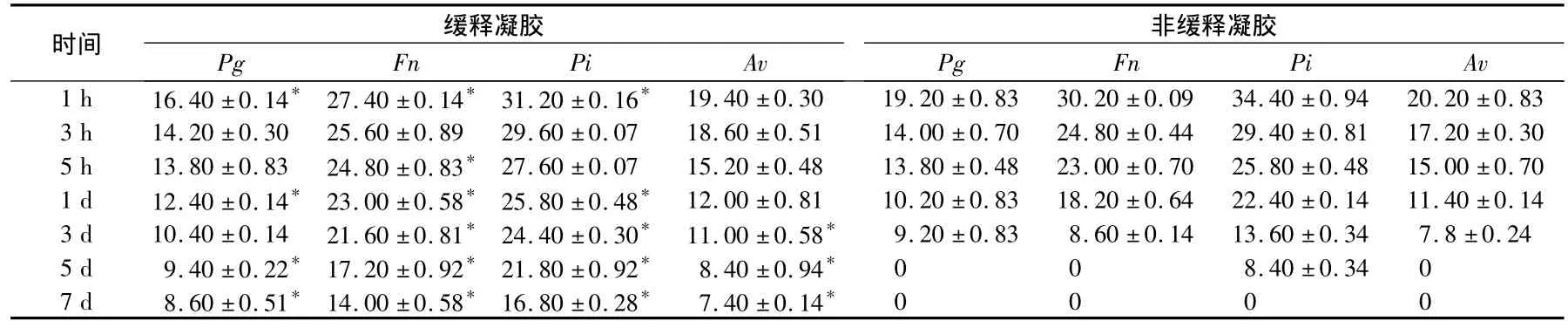
表12 種凝膠各時間釋放液對各菌株的抑菌直徑比較(mms)
*與非凝膠組相比P<0.05
時間 緩釋凝膠非緩釋凝膠Pg Fn Pi Av 1 h 16.40 ±0.14* 27.40 ±0.14* 31.20 ±0.16* 19.40 ±0.30 19.20 ±0.83 30.20 ±0.09 34.40 ±0.9 Pg Fn Pi Av 4 20.20 ±0.83 3 h 14.20 ±0.30 25.60 ±0.89 29.60 ±0.07 18.60 ±0.51 14.00 ±0.70 24.80 ±0.44 29.40 ±0.81 17.20 ±0.30 5 h 13.80 ±0.83 24.80 ±0.83* 27.60 ±0.07 15.20 ±0.48 13.80 ±0.48 23.00 ±0.70 25.80 ±0.48 15.00 ±0.70 1 d 12.40 ±0.14* 23.00 ±0.58* 25.80 ±0.48* 12.00 ±0.81 10.20 ±0.83 18.20 ±0.64 22.40 ±0.14 11.40 ±0.14 3 d 10.40 ±0.14 21.60 ±0.81* 24.40 ±0.30* 11.00 ±0.58* 9.20 ±0.83 8.60 ±0.14 13.60 ±0.34 7.8 ±0.24 5 d 9.40 ±0.22* 17.20 ±0.92* 21.80 ±0.92* 8.40 ±0.94* 0 0 8.40 ±0.34 0 7 d 8.60 ±0.51* 14.00 ±0.58* 16.80 ±0.28* 7.40 ±0.14*0000
3 討論
牙周炎是以厭氧菌感染為主的慢性感染性疾病,但細菌對牙周組織的直接破壞作用是有限的,而由細菌激發(fā)的宿主免疫反應(yīng)才是造成牙周組織破壞的主要原因。研究[1]表明,牙周病并非由單一細菌導(dǎo)致,而至少是多種微生物或整個菌斑生態(tài)系共同作用的結(jié)果。近年來,隨著厭氧培養(yǎng)技術(shù)不斷改進,對厭氧菌的檢出率大大提高[2],大量的研究證實Pg、Fn、Pi、Av等厭氧菌是牙周病的優(yōu)勢病原菌,其中Pg在成人牙周炎的齦下菌斑中檢出率最高[3],尤其是成人慢性牙周炎病變或活動部位最主要的優(yōu)勢菌,隨著高分子材料學(xué)和藥劑學(xué)的發(fā)展,局部應(yīng)用緩控釋制劑在牙周病治療中顯示出較好的優(yōu)勢,成為牙周病藥物治療的主要用藥方式。由于其具有給藥次數(shù)少,減少全身用藥的不良反應(yīng),局部藥物濃度高,持續(xù)時間長,胃腸道刺激輕,安全等優(yōu)點越來越受到臨床的重視。從19世紀70年代起各種抗生素藥物以沖洗液、含漱液、膜劑、棒劑、凝膠等不同給藥方式廣泛地應(yīng)用于牙周炎的治療,均取得了較好療效[4]。
藥物載體是藥物釋放體系的重要組成部分,可以直接影響藥物的各種釋放行為。殼聚糖及其衍生物具有保護或穩(wěn)定藥物中成分、幫助藥物送達靶器官、延緩或控制藥物釋放、促進藥物吸收等多種優(yōu)勢,是一種良好的藥物控釋載體[5-7]。其中,殼聚糖季銨鹽因其具有良好的水溶性、絮凝性、生物相溶性、吸濕保濕性和抗菌性以及優(yōu)良的黏膜滲透性和高的Zeta電位并可作為基因載體而備受研究者的青睞。羧甲基殼聚糖是一種水溶性的殼聚糖衍生物,其分子中含有帶負電荷的羧基和帶正電荷的氨基,是一種兩性聚合物。在羧甲基殼聚糖上引入長鏈烷基季銨鹽制備OQCMC可使水溶性殼聚糖具有更好的親脂性,從而擴大羧甲基殼聚糖的使用范圍。OQCMC有乳化、分散的作用,由于其在水、油介質(zhì)中的良好溶解性,可使微球體系同時適用于對水溶性藥物的包載,可明顯地提高微球體系對鹽酸米諾環(huán)素的載藥率[8-10];OQCMC表面帶正電,為做基因載體提供了可能,通常不用陽離子表面活性劑時所制備的PLGA微球帶負電,而OQCMC可對PLGA微球進行表面修飾以提供官能團,使藥物在緩釋過程中突釋較小,釋放時間較長;同時OQCMC可提供多種官能團,使微球可連接葉酸等不同的靶向試劑。本實驗通過在PLGA納米粒表面包裹由殼聚糖季銨鹽制備的脂質(zhì)體層形成復(fù)合載藥納米粒,再制備成微球的方法,是目前國外牙周病緩釋制劑的主要研究方向。本課題組與天津大學(xué)材料學(xué)院納米生物技術(shù)研究所合作,首先制備水油兩溶性的OQCMC,然后將其作為乳化劑與PLGA和羥乙基纖維素復(fù)合構(gòu)建一種多功能的緩釋微球體系。并經(jīng)體外緩釋實驗證明該微球體系的突釋現(xiàn)象并不明顯;由于OQCMC的加入減小了微球體系的粒徑,并提高了微球?qū)λ芎陀腿苄晕镔|(zhì)的包裹能力;微球表面帶正電并富含多種官能團,可連接基因和不同的靶向物質(zhì),在藥物傳遞、基因治療和生物檢測方面具有非常好的應(yīng)用前景。
常用的藥物敏感方法有瓊脂擴散法、稀釋法、電阻抗法以及聯(lián)合藥敏實驗和殺菌實驗等,其中以瓊脂擴散法和稀釋法更為常用。瓊脂擴散法主要包括紙片擴散法;挖溝擴散法及打孔擴散法等;稀釋法包括液體稀釋法和瓊脂稀釋法等。本實驗采用瓊脂紙片擴散法(K-B法)進行體外抑菌實驗,可用于測定藥物體外抑制細菌生長的效力,與瓊脂稀釋法、液體稀釋法一并被美國國立臨床實驗標(biāo)準化委員會(National Committee for Clinical Laboratory Standards,NCCLS)推薦為三種主要藥物敏感實驗方法。
本研究采用超聲乳化法制備20 g/L鹽酸米諾環(huán)素緩釋凝膠及非緩釋凝膠,采用瓊脂紙片擴散法分別檢測其對牙周主要可疑致病菌 (Pg、Fn、Pi、Av)的抑菌效果,結(jié)果顯示,鹽酸米諾環(huán)素緩釋凝膠對牙周主要可疑致病菌有較強的抗菌活性,并且其抑菌作用可持續(xù)7 d以上,緩釋抑菌作用明顯優(yōu)于非緩釋凝膠組。說明鹽酸米諾環(huán)素納米復(fù)合微球凝膠能釋放出足夠濃度的鹽酸米諾環(huán)素,達到抑制細菌的作用,不僅可以避免全身給藥的不良反應(yīng),而且可提高療效,減少日益嚴重的細菌耐藥性的發(fā)生,有一定的臨床應(yīng)用價值,值得進一步的研究開發(fā)。
[1]Nishihara T,Koseki T.Microbial etiology of periodontitis[J].Periodontol,2004,36(1):14 -26.
[2]Salari MH,Kadkhoda Z.Rate of cultivable subgingival periodontopathogenic bacteria in chronic periodontitis[J].J Oral Sci,2004,46(3):157 -161.
[3]Estrela CR,Pimenta FC,Alencar AH,et al.Detection of selected bacterial species in intraoral sites of patients with chronic periodontitis using multiplex polymerase chain reaction[J].J Appl Oral Sci,2010,18(4):426 -431.
[4]Trombelli L,Tatakis DN.Periodontal disease:current and future indications for local antimicrobial therapy[J].Oral Disease,2003,9(S1):11 -15.
[5]蔣挺大.殼聚糖[M].2版.北京:化學(xué)工業(yè)出版社,2006:4-14:347-352.
[6]孫冀平.殼聚糖及其應(yīng)用[J].中國食品添加劑,2005,(5):83-86.
[7]Issam ST,Adele MG,Adele CP,et al.Chitosan polymer as biative coating and film against aspergillus niger contamination[J].J Food Science,2005,70(2):100 -104.
[8]李世遷,姚評佳,魏遠安,等.羧甲基殼聚糖季銨鹽的制備及其抑菌性能研究[J].化學(xué)與生物工程,2006,23(11):22-24.
[9]Kelly HM,Deasy PB,Ziaka E,et al.Formulation and preliminary in vivo dog studies of a novel drug delivery system for the treatment of periodontitis[J].Int J Pharm,2004,274(1 -2):167-183.
[10]梁曉飛,王漢杰,常津,等.生物降解多功能緩釋微球的制備與表征[J].化學(xué)學(xué)報,2008,66(19):2178 -2183.

